丁二酸酐修飾對枯草芽孢桿菌氨肽酶結構及酶學特性的影響
張 靜, 田亞平
(江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122)
氨肽酶是一類從蛋白質或肽鏈的N端酶切氨基酸殘基的外肽酶的總稱[1]。氨肽酶的分布廣泛,主要存在于動物組織和植物中,由于動植物中的氨肽酶的含量比較低,提取成本高,所以利用微生物發酵法生產酶是近年來酶制劑行業的熱點和趨勢,產氨肽酶的微生物的種類繁多,例如細菌、霉菌、酵母等。
氨肽酶的應用廣泛,可協助切掉肽鏈末端疏水性氨基酸,脫除蛋白水解物的苦味[2];與不同的內切酶復配,參與蛋白質的深度水解[3];制備多功能活性肽;還可以作為N端測序工具酶和醫療診斷用酶。
酶作為一種生物催化劑,因其半衰期短、易失活等缺點嚴重影響著酶的使用效果。氨肽酶作為一種工業化酶制劑,酶的熱穩定性是一個很關鍵的因素。酶的熱穩定性提高具有明顯的優勢,延長酶的儲存時間、減少在運輸過程中的酶活損失,使酶在較高反應溫度下延長酶的反應時間,提高生產效率,有效的降低生產成本[4]。所以,如何提高酶的穩定性,從而擴大酶的應用范圍的研究越來越引起人們的重視。
目前,提高酶穩定性的策略主要從酶分子改造和微環境改良[5]兩方面入手。酶分子改造包括定點突變、化學修飾以及酶固定化等方法;微環境改良包括添加保護劑、防腐劑、蛋白酶抑制劑、抗氧化劑和還原劑等。其中化學修飾是提高和改善酶催化性能的有效方法之一。季波、徐瀅波等[6]采用氰脲酰氯法活化的聚乙二醇-6000對牛血Cu,Zn-SOD進行化學修飾,制得的修飾酶比天然SOD在熱穩定性、酸堿條件以及抗酶解三方面的穩定性均有不同程度的提高。曹向宇、劉劍利等[7]利用右旋糖酐對玉米SOD進行修飾,修飾后玉米SOD的溫度穩定性、pH穩定性均有顯著提高,半衰期延長,對蛋白酶的耐受性增強。天然酶分子上的Lys殘基末端的ε-NH2由于具有較強的親核性,使得ε-NHε成為化學修飾的首選官能團。Marta Kotorman、Andras Cseri、Ilona Laczko等[8]用乙酸酐、丙酸酐、丁二酸酐、鄰苯二甲酸酐等不同的酸酐修飾α-胰凝乳蛋白酶,提高了酶在不同有機溶劑中的穩定性。
采用丁二酸酐對氨肽酶進行化學修飾,通過紫外-可見吸收光譜和圓二色光譜表征修飾前后酶的結構變化,并考察了修飾前后酶反應動力學常數、最適溫度、穩定穩定性、最適pH、pH穩定性等酶學性質的變化。
1 材料與方法
1.1 材料
1.1.1 菌種 枯草芽孢桿菌 (Bacillus subtilis)Zj016,作者所在實驗室保藏菌種。
1.1.2 主要試劑 L-亮氨酸-對硝基苯胺:美國Alfa 公司;氨肽酶:作者所在實驗室制備;2,4,6-三硝基苯磺酸:上海晶純實業有限公司;丁二酸酐:化學純,國藥集團化學試劑有限公司;考馬斯亮藍試劑:自制;其他試劑均為國產分析純。
1.1.3 主要儀器 BCD-208K型低溫冰箱:青島海爾股份有限公司;722型分光光度計:上海第三分析儀器廠;SHZ-22電熱恒溫水浴鍋:上海醫療器械五廠;Delta320 pH計:電子天平AL204,梅特勒-托利多公司;MOS-450圓二色光譜儀:法國Biologic公司;UV-3000掃描型紫外-可見分光光度計:日本HITACHI公司;透析袋(截留相對分子質量為10 000):Millipore公司。
1.2 實驗方法
1.2.1 丁二酸酐對氨肽酶的化學修飾方法 參照文獻[9]方法并進行優化,稱取20 mg的氨肽酶粉溶解在15 mL、0.05 mol/L pH 8.5的 Tris-HCl緩沖液中,然后向混合液中緩慢加入10 mg的丁二酸酐,攪拌溶解,在整個反應過程中用2 mol/L NaOH溶液維持反應體系的pH值為8.0,在4℃條件下反應1 h,反應結束后,用 0.05 mol/L、pH 8.5 的 Tris-HCl緩沖液在4℃透析過夜,以除去多余的修飾劑,得到丁二酸酐修飾的氨肽酶 (修飾酶SA-AE);稱取20 mg的氨肽酶粉溶解在15 mL、0.05 mol/L pH 8.5的Tris-HCl緩沖液中,用0.05 mol/L pH8.5的Tris-HCl緩沖液在4℃透析過夜,得到原酶液(AE),4℃冰箱保存。
1.2.2 紫外-可見吸收光譜 采用UV-3000掃描型紫外分光光度計,掃描波長為200~600 nm,石英比色皿光程為10 mm,酶質量濃度為0.5~2.0 mg/mL。
1.2.3 圓二色性光譜 采用MOS-450圓二色光譜儀,波長范圍為 190~250 nm,速度 1 nm/2 s,使用0.1 cm石英池,酶質量濃度為0.5~2.0 mg/mL。
1.2.4 動力學特征參數的測定 以L-亮氨酸-4-硝基苯胺為底物,在原酶和修飾酶的最佳酶活測定的條件下, 測定底物濃度為 0.2、0.4、0.6、0.8、1.0、1.2、1.4 mmol/L時原酶和修飾酶的酶活。按照Lineweaver-Burk作圖法取雙倒數作1/v-1/s曲線,計算原酶和修飾酶的米氏常數Km和最大反應速率Vm。
1.2.5 原酶液和修飾酶液最適溫度的測定 分別取原酶液和修飾酶液各1 mL,用0.05 mol/L、pH 8.5的Tris-HCl緩沖液在不同的溫度條件下測定酶活力,溫度梯度為 40、45、50、55、60、65、70 ℃,以同組實驗中酶活最高的一組作為對照。
1.2.6 原酶液和修飾酶液的溫度穩定性 將原酶液和修飾酶液放置在70℃、0.05 mol/L pH 8.5的Tris-HCl緩沖液中,每隔1 h取樣,立即冰浴,測定其酶活力,以同組實驗中酶活最高的一組作為對照。 水浴保溫時間為 0、1、2、3、4、5 h。
1.2.7 原酶液和修飾酶液最適pH值的測定 分別取原酶液和修飾酶液各1 mL,在不同pH、0.05 mol/L的Tris-HCl緩沖液中、50℃下測定其酶活力,pH值梯度為 6.0、7.0、7.5、8.0、8.5、9.0、9.5、10.0、11.0。 以同組實驗中酶活最高的一組作為對照。
1.2.8 原酶液和修飾酶液的pH穩定性 將原酶液和修飾酶液分別在pH 5.0~7.0(0.05 mol/L磷酸氫二鈉-檸檬酸緩沖液)、pH 7.0~10.0(0.05 mol/L 甘氨酸-氫氧化鈉緩沖液)體系中于4℃下放置,6 h后取樣將pH調至它們的最適反應pH值以測定酶活力。以同組實驗中酶活最高的一組作為對照。
1.3 分析方法
1.3.1 氨肽酶酶活測定方法 LNA法:加入2 mL、0.05 mol/L、pH 8.5的 Tris-HCl緩沖液,1 mL的 L-亮氨酸對硝基苯胺溶液,再加入稀釋一定倍數的酶液1 mL,50℃水浴反應10 min后,在405 nm波長處測定吸光值[10]。
酶活力定義:50℃下,每分鐘分解L-亮氨酸對硝基苯胺產生1 μmol的對硝基苯胺所需酶量定義為一個酶活單位。
1.3.2 平均氨基修飾度測定 采用三硝基苯磺酸(TNBS)法對修飾酶進行平均氨基修飾度的測定[11]。
氨基修飾率(%)=1-氨基殘留率(%)。
1.3.3 相對酶活力測定 在同組實驗中以酶活力最高的為100,與其余的酶活力之比,通常以百分數表示。
1.3.4 酶活殘留率測定 酶活殘留率=樣品酶液殘余酶活/樣品酶液初始酶活×100%。
1.3.5 蛋白質總量測定 考馬斯亮藍染色法[12],以牛血清白蛋白作為標準。
2 結果與討論
2.1 丁二酸酐化學修飾結果
在最佳修飾條件下,采用丁二酸酐對氨肽酶進行化學修飾,得到化學修飾酶。修飾酶的相對酶活為105.81%,較原酶有所提高,氨基修飾率為55.86%。與透析前相比,透析后原酶液和修飾酶液的酶活均有所下降,這是因為枯草芽孢桿菌Zj016氨肽酶是一種金屬酶[13],透析導致部分金屬離子除去,酶活下降。可通過加入適當濃度的相應金屬離子提高酶活。
2.2 修飾酶的結構與催化特性表征
2.2.1 紫外-可見吸收光譜分析 蛋白質在紫外光范圍內有兩個特征吸收峰,一是由于蛋白質所含有的色氨酸殘基和酪氨酸殘基,其分子內部存在共軛雙鍵,在280 nm處有一個吸收峰,二是因肽鍵存在而引起的,在200~220 nm處有一個吸收峰。由圖1可知,原酶液的最大吸收波長在213.5 nm處,經過修飾之后,修飾酶的最大吸收波長出現紅移,為216.5 nm。其原因可能是丁二酸酐的引入改變了酶分子的微環境,n和π*軌道間的能量差減小,引起吸收峰向長波長移動[14]。吸收峰的微小變化表明丁二酸酐修飾后已導致酶分子的構象發生了一定程度的改變。
2.2.2 圓二色性光譜分析 在蛋白質的二級結構中,存在著α螺旋、β折疊、β轉角、無規則卷曲等結構。蛋白質的α螺旋結構在靠近192 nm處有一正的譜帶,在222 nm和208 nm處表現出兩個負的特征肩峰譜帶;β折疊的CD譜在216 nm有一個負譜帶,在185~200 nm有一正譜帶;β折疊在206 nm附近有一正CD譜帶[15]。由圖2可知,原酶液和修飾酶液的CD光譜特征產生了一定的變化,進一步說明酶經修飾后其結構發生了改變。
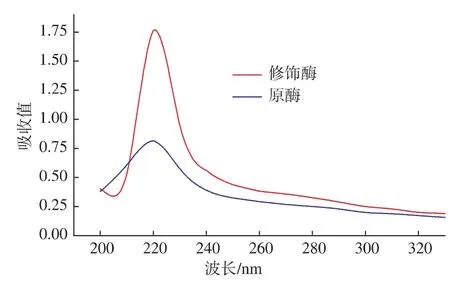
圖1 原酶液和修飾酶液的紫外吸收光譜Fig.1 Absorbancespectra ofnativeand modified Aminopeptidase
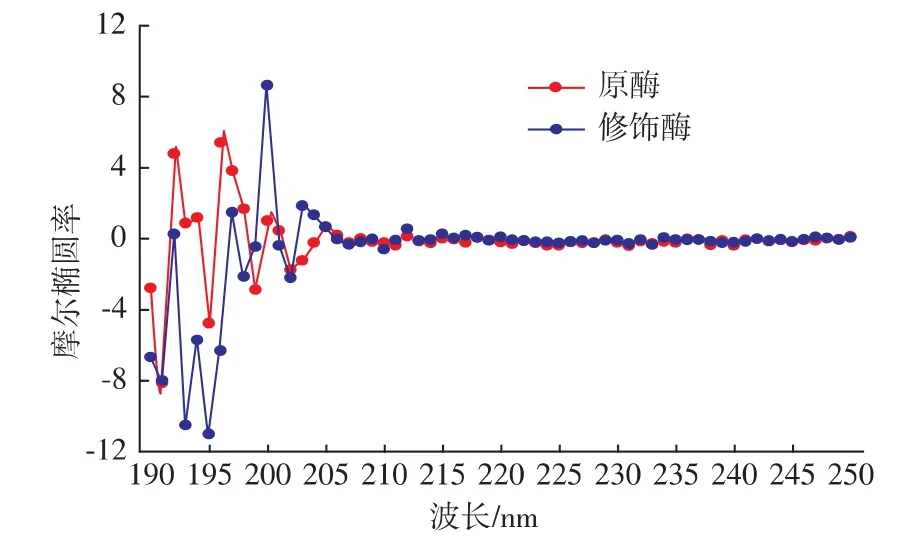
圖2 原酶液和修飾酶液的圓二色性光譜圖Fig.2 CD spectra of native and modified Aminopeptidase
用Selcon3軟件分析修飾前后酶的二級結構含量的變化,結果見表1。由表1可見,酶經修飾后,α螺旋、β折疊以及β轉角的含量均有所下降,無規則卷曲的含量有所增加。在經化學修飾引入丁二酸酐之后,酶的二級結構發生了改變。
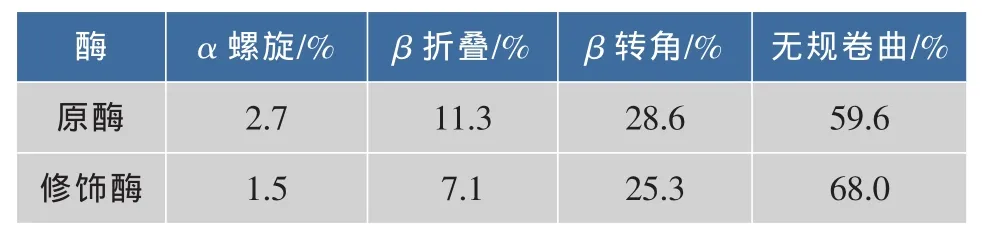
表1 原酶液與修飾酶液的二級結構變化Table 1 Secondary structure of native and modified Aminopeptidase
2.2.3 修飾氨肽酶的催化特征 在丁二酸酐修飾前后,分別考察了原酶和修飾酶的動力學參數,以雙倒數作圖法作圖,Lineweaver-Burk曲線見圖3,求得反應動力學參數見表2。
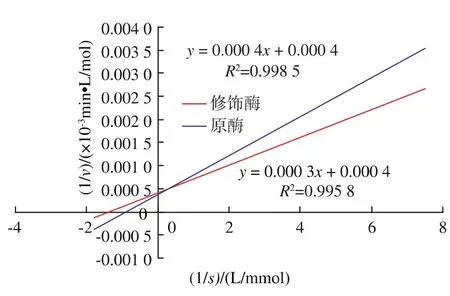
圖3 原酶和修飾酶的Lineweaver-Burk曲線Fig.3 Lineweaver-burk plot of native and modified Aminopeptidase
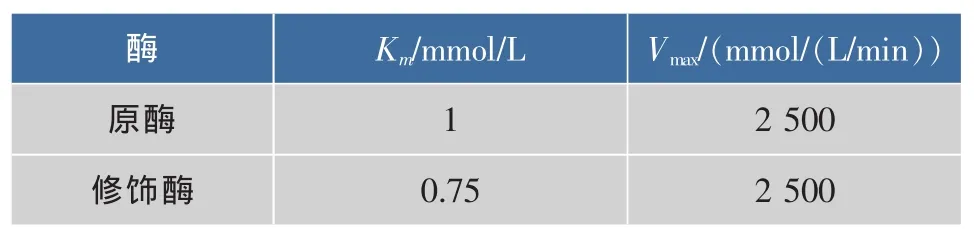
表2 原酶和修飾酶的動力學參數Table 2 Kinetic parameters of native and modified Aminopeptidase
由表2可知,與原酶相比,修飾酶的Km值減小,表明修飾劑的加入導致氨肽酶的空間構象發生了改變,使其對底物L-亮氨酸-4-硝基苯胺的親和力增加,更加有利于底物分子進入酶的活性中心。
2.2.4 原酶液和修飾酶液的最適溫度 由圖4可知,不管是原酶液還是修飾酶液,其酶活均隨著溫度的上升而增加,原酶液的最適溫度是60℃,而修飾酶液的最適溫度是65℃,較原酶液有所提高。
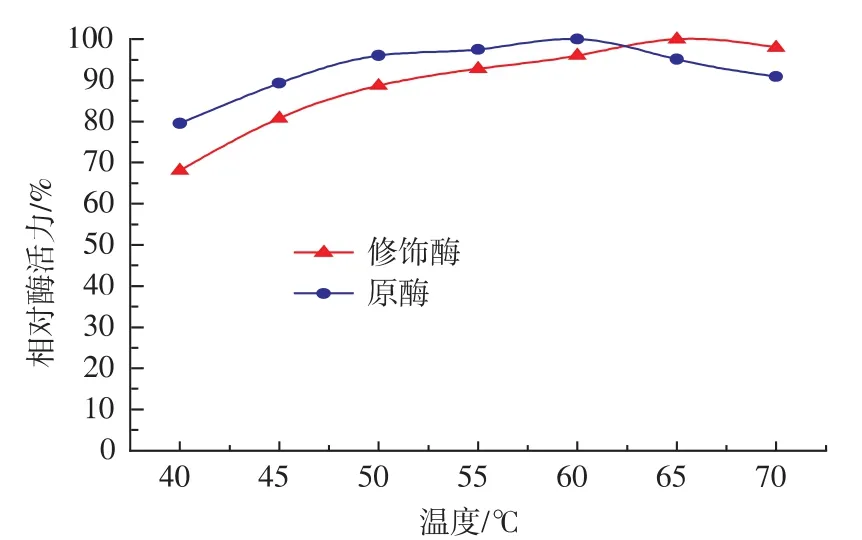
圖4 原酶液和修飾酶液的最適作用溫度Fig.4 Optimalreaction temperatureofnativeand modified Aminopeptidase
2.2.5 原酶液和修飾酶液的熱穩定性 由圖5可知,隨著時間的延長,原酶液和修飾酶液酶活的變化趨勢相同,但是,修飾酶液在70℃保溫5 h后,仍然保留70%的酶活,而原酶液的酶活僅余35%。和原酶液相比,修飾酶液具有較好的熱穩定性。
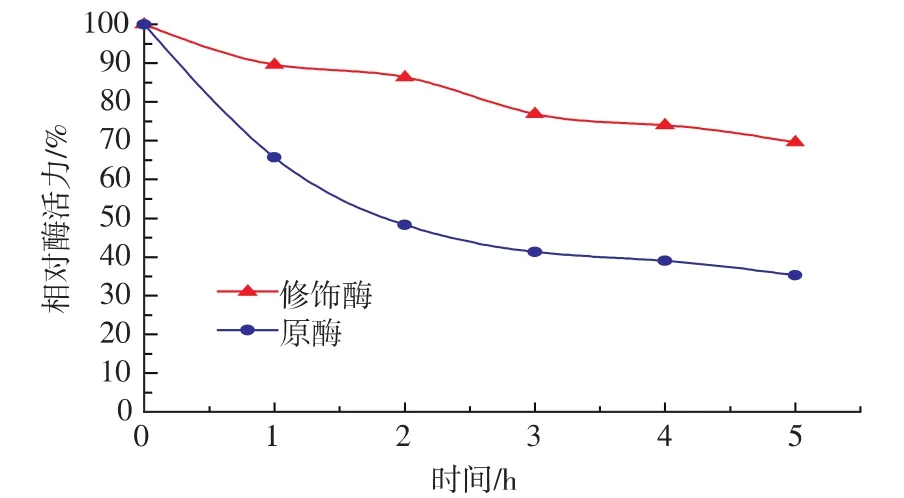
圖5 原酶液和修飾酶液的熱穩定性Fig.5 Thermalstability of native and modified Aminopeptidase at 70℃
至于酶經化學修飾后熱穩定性提高的原因,不同學者都圍繞著修飾后酶分子結構的變化進行討論。如Baek等[16]認為可能是由于修飾劑共價連接在酶分子后,使其天然構象局部產生一定的“剛性”,不易伸展失活,并減少了酶分子內部基團的熱振動,從而提高酶的熱穩定性;Gouda等[17]認為修飾劑與酶分子共價連接后,使得酶分子的結構變得致密,其分子內的作用力增強,導致酶的熱穩定性提高。
2.2.6 原酶液和修飾酶液的最適pH值 由圖6可知,原酶液的最適pH值為8.5,修飾酶液的最適pH值為9.5~10.0。原酶液在pH值為10.0時的相對酶活為90%。經丁二酸酐修飾后,酶的最適pH值向堿性方向偏移了1~1.5個單位。
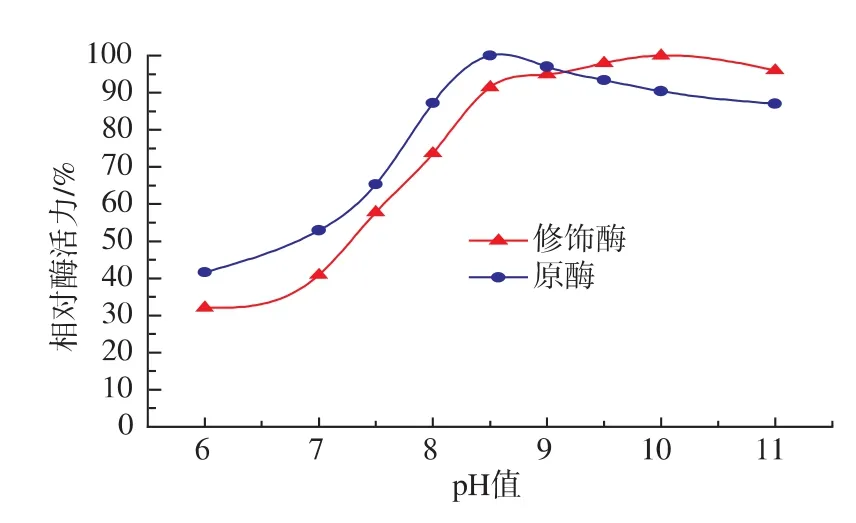
圖6 原酶液和修飾酶液的最適作用pH值Fig.6 Optimal reaction pH of native and modified Aminopeptidase
Khaparde等[18]采用丁二酸酐修飾木瓜蛋白酶導致最適反應pH值由6.0偏移至7.5,熊亞紅等[19]用鄰苯二甲酸酐(PA)修飾木瓜蛋白酶使其最適反應pH值由7.0提高到8.5。人們普遍認為這可能是由于酸酐與酶分子的Lys殘基上帶正電荷的氨基反應后,在酶分子中引入了帶負電荷的羧基,使得最適pH向堿性方向偏移。
2.2.7 原酶液和修飾酶液的pH穩定性 由圖7可知,在4℃放置6 h后,緩沖液的種類對酶活的測定也有影響,所以在更換緩沖液之后,pH 7時相對酶活力出現不同。以最高酶活的80%為界確定酶的pH穩定范圍,原酶在pH 7.0~9.0范圍內,酶活力較高且穩定;而修飾酶在pH 6.0~9.0范圍內較穩定,pH穩定性范圍比原酶變寬,說明修飾酶的pH穩定性得到提高。
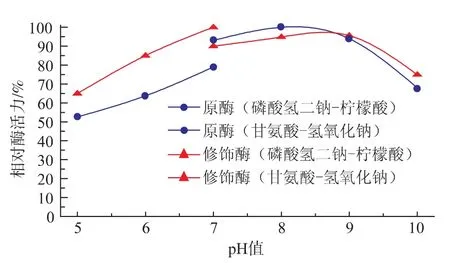
圖7 原酶液和修飾酶液的pH穩定性Fig.7 pH stability of native and modified Aminopeptidase
3 結語
作者采用丁二酸酐在經過一定優化的最佳修飾條件下對氨肽酶進行化學修飾,修飾后的枯草芽孢桿菌氨肽酶酶活較原酶有所提高,分子構象發生了一定的改變,同時伴隨了一系列的酶學特性表征方面的變化。修飾后酶學特征中最突出的變化是修飾酶的熱穩定性比原酶顯著增強,對底物的親和力也有所增加,表明特定條件下的丁二酸酐化學修飾可較好改善枯草芽孢桿菌氨肽酶的應用特性,對促進該酶的工業化生產和進一步的應用有一定的參考作用。
[1]王俊.枯草芽孢桿菌氨肽酶的研究[D].無錫:江南大學,2009.
[2]魏亞娟,田亞平,須瑛敏.枯草芽孢桿菌脫苦氨肽酶在水解大豆分離蛋白中的應用研究[J].食品工業科技,2008,4:149-151.WEI Ya-juan,TIAN Ya-ping,XU Ying-min.Study on hydrolysis of soybean protein isolate by Bacillus subtilis aminopeptidase[J].Science and Technology of Food Industry,2008,4:149-151.(in Chinese)
[3]呂廣林,田亞平.氨肽酶與中性蛋白酶協同水解大豆分離蛋白的研究[J].食品與生物技術學報,2011,30(1):101-105.LU Guang-lin,TIAN Ya-ping.Study on hydrolysis of soybean protein isolate by aminopeptidase and neutral protease[J].Journal of Food Science and Biotechnology,2011,30(1):101-105.(in Chinese)
[4]鄭賢良.重組α-環糊精葡萄糖基轉移酶酶制劑穩定性的研究[D].無錫:江南大學,2010.
[5]Iyer P V,Ananthanarayan L.Enzyme stability and stabilization-aqueous and non-aqueous environment[J].Biochemistry Prog,2008,43:1019-1032.(in Chinese)
[6]季波,徐瀅波,趙樹進.聚乙二醇修飾超氧化物歧化酶及其穩定性研究[J].廣州醫學院學報,2002,30(3):16-18.JI Bo,XU Yin-Bo,ZHAO Shu-Jin.A stability study of PEG-SOD[J].Academic Journal of Guangzhou Medical College,2002,30(3):16-18.(in Chinese)
[7]曹向宇,劉劍利,朱俊豐,等.右旋糖酐修飾玉米SOD研究[J].食品研究與開發,2010,31(3):17-19.CAO Xiang-yu,LIU Jian-li,ZHU Jun-feng,et al.Study on modification of SOD from maize with detran[J].Food Research and Development,2010,31(3):17-19.(in Chinese)
[8]Marta Kotorman,Andras Cseri,Ilona Laczko,et al.Stabilization of α-chymotrypsin in aquepus organic solvents by chemical modification with organic acid anhydrides[J].Journal of Molecular Catalysis B:Enzymatic,2009,59:153-157.
[9]熊亞紅,高敬忠,鄭堅鵬,等.丁二酸酐修飾對漆酶穩定性和除酚效率的影響[J].催化學報,2011,32(10):1584-1591.XIONG Ya-hong,GAO Jing-zhong,ZHENG Jian-peng,et al.Effects of succinic anhydride modification on laccase stability and phenolics removal efficiency[J].Chin J Catal,2011,32(10):1584-1591.(in Chinese)
[10]王俊,呂廣林,田亞平.一種枯草芽孢桿菌亮氨酸氨肽酶的提取及部分酶學性質研究[J].食品工業科技,2010,30(1):203-206.WANG Jun,LV Guang-lin,TIAN Ya-ping.Study on extraction process and partial characterization of the leucine aminopeptidase of Bacillus subtilis[J].Science and Technology of Food Industry,2010,1:203-206.(in Chinese)
[11]Habeeb A.Determination of free amino groups in proteins by trinitrobenzene sulfonic acid[J].Analytical Biochemistry,1966,14(3):328-336.
[12]王福榮.生物工程分析與檢驗[M].北京:中國輕工業出版社,2010:124-125.
[13]田亞平,須瑛敏.一種枯草芽孢桿菌氨肽酶的純化及酶學性質[J].食品工業科技,2006,32(3):7-9.TIAN Ya-ping,XU Ying-min.Purification and characterization of one kind of Bacillus subtilis aminopeptidase[J].Science and Technology of Food Industry,2006,32(3):7-9.(in Chinese)
[14]高向陽.新編儀器分析[M].北京:科學出版社,2004:16-17.
[15]李蘇,閆明,戈鈞,等.葡聚糖修飾漆酶的制備及其催化特性和穩定性[J].化工學報,2007,58(12):3046-3052.LI Su,YAN Ming,GE Jun,et al.Dextran conjugated laccase and its catalytic property and stability[J].Journal of Chemical Industry and Engineering,2007,58(12):3046-3052.(in Chinese)
[16]Beak W O,Wijayalakshmi M A.Effect of chemical glycosylation of RNase A on the protein stability and surface histidines accessibility in immobilized metal ion affinity electrophoresis (IMAGE) system[J].Biochimica et Biophysica Acta (BBA)-General Subjects,1997,1336(3):394-402.
[17]Gouda M D,Singh S A,Rao A G,et al.Thermal inactivation of glucose oxidase[J].The Journal of Biological Chemistry,2003,278:324-333.
[18]Khaparde S S,Singhal R S.Chemically modified papain for applications in detergent formulations[J].Bioresource Technology,2001,78:1-4.
[19]熊亞紅,吳巧兒,蘇健鴻.化學修飾木瓜蛋白酶的酶學性質研究[J].分子催化,2010,24(6):529-536.XIONG Ya-hong,WU Qiao-er,SU Jian-hong.Study on the enzymatic property of chemical modification papain[J].Journal of Molecular Catalysis,2010,24(6):529-536.(in Chinese)

