茭白總蛋白質雙向電泳技術體系的建立
羅海波 , 陳 偉 , 周靜峰 , 宋慧波 , 郁志芳
(1.浙江醫藥高等專科學校 生物與食品系,浙江 寧波 315100;2.南京農業大學 食品科技學院,江蘇 南京210095;浙江萬里學院 生物與環境學院,浙江 寧波 315100)
蛋白質是基因表達的產物,直接參與生命的各種生理代謝活動,是生物細胞各種代謝和調控途徑的靶分子,也是聯系基因和生理代謝的重要橋梁[1]。隨著功能基因組學的興起,蛋白質組學成為生命科學研究的重要內容,目前已廣泛應用于植物生理的研究,如植物群體遺傳蛋白質組、植物信號應答蛋白質組和植物組織器官蛋白質組等[2]。雙向電泳技術(Two-dimensional electrophoresis,2-DE)作為蛋白質組學三大關鍵核心技術之一,是目前惟一能同時將上千種蛋白質分離和展示的方法,也是分析復雜組分蛋白質分辨率最高的工具[3]。由于植物中蛋白質含量相對較低,且含有如色素、淀粉、多糖、多酚、單寧和有機酸類等大量干擾性物質,給植物蛋白質組學研究增加了困難,因而雙向電泳技術在植物中的應用早期主要集中于擬南芥[4]、水稻[5]、小麥[6]、玉米[7]等傳統模式作物。近年來,隨著蛋白質提取技術的改進,雙向電泳技術在桃[8]、草莓[9]、柑橘[10]、西紅柿[11]、生菜[12]、發菜[13]等水果蔬菜中的應用逐漸增多,但在茭白中的應用鮮見報道。茭白屬禾本科宿根性多年水生草本植物,是我國特有的水生蔬菜,其質地脆嫩、味道鮮美且營養豐富,素有“水中參”的美稱[14]。然而,茭白不耐貯藏,采后常溫下3 d左右就出現組織軟化及木纖化等品質劣變現象,商品價值急劇下降。研究茭白采后品質劣變過程中的蛋白質組學,對從分子層面深入揭示茭白品質劣變機制具有重要意義。作者以茭白為研究對象,擬通過對總蛋白質提取方法和雙向電泳條件的優化,建立適合分離茭白蛋白質的雙向電泳技術體系,為進一步開展茭白差異蛋白質組學的研究奠定基礎。
1 材料與方法
1.1 材料與儀器
1.1.1 材料 試驗用茭白為5月上旬成熟的江蘇地產露天茭白,采收后剝去外殼葉鞘,迅速用液氮冷凍,保存于-70℃冰箱備用。
1.1.2 試劑 苯甲基磺酰氟(PMSF)、乙二醇-雙-(2-氨基乙醚)四乙酸(EGTA)、固化pH梯度干膠條(IPG,)、兩性電解質(Bio-Lyte)、二硫蘇糖醇(DTT)、碘乙酰胺(IAA)、丙烯酰胺(Arc)、N,N′-甲叉雙丙烯酰胺(Bis)、二甲氨基丙磺酸(CHAPS)、低熔點瓊脂糖、考馬斯亮藍G-250:購自美國Bio-Rad公司;三氯乙酸(TCA)、尿素、硫脲、甘氨酸、β-巰基乙醇(β-Me)、十二烷基磺酸鈉(SDS)、聚乙二醇辛基苯基醚(Triton X-100)、三羥甲基氨基甲烷(Tris)、過硫酸銨、礦物油、Tris平衡酚、四甲基乙二胺(TEMED)、牛血清蛋白(BSA):均為分析純。
1.1.3 儀器 高速冷凍離心機:GL-20G-Ⅱ,上海安亭科學儀器廠;微量高速冷凍離心機:美國FRESCO 17 Thermo電子公司;等電聚焦儀:Protean IEF System,美國Bio-Rad公司;大型垂直電泳槽:PROTEAN II XL Cell,美國Bio-Rad公司;凝膠成像系統:Versdoc 3000,美國Bio-Rad公司。
1.2 蛋白質提取與含量測定
1.2.1 三氯乙酸(TCA)/丙酮沉淀法 參照劉倩等[15]的方法稍作修改。稱取5.0 g茭白樣品,用液氮研磨成粉,加入一定量的提取液Ⅰ (含10%TCA和0.07%DTT的丙酮溶液),-20℃沉淀過夜;4℃、13 000 g離心15 min,棄上清液;加入提取液Ⅱ (含0.07%DTT的丙酮溶液)于-20℃沉淀1 h,4℃、16 000 g離心15 min,棄上清液,重復用提取液Ⅱ懸浮沉淀3次。沉淀放入4℃冰箱中干燥后溶于1 mL水化液 (7 mol/L 尿素,2 mol/L 硫脲,4%CHAPS,1%DTT,0.5%Bio-Lyte)中,-70 ℃保存備用。
1.2.2 改良酚抽法 參照Zhang等[8]的方法稍作修改。稱取5.0 g茭白樣品,用液氮研磨成粉,加入50 μL、100 mmol/L PMSF原液和 5~6 mL 4℃預冷 2 h以上的蛋白質提取液 (含有 60 mmol/L Tris,1.05 mol/L 蔗糖,10 mmol/L EGTA,1%Triton X-100以及1mmol/LDTT,pH8.3)繼續研磨。勻漿液以16 000 g離心30 min。上清液中加入2.5~3倍體積的pH為7.8的Tris-飽和酚,充分搖蕩,混勻,4℃靜置1~2 h,16 000 g、4 ℃離心 30 min,取上層酚相,加入至少5倍體積-20℃預冷丙酮,充分混勻,-20℃下過夜培養,沉淀蛋白質。沉淀分別用預冷的甲醇和丙酮沖洗2次,4℃下干燥后溶于1 mL水化液中,-70℃保存備用。
1.2.3 蛋白質的測定 參照Bradford[16]的方法進行。
1.3 雙向電泳
第一向采用17 cm pH 3-10或pH 4-7的biorad預制膠條進行水化上樣 (上樣量分別為0.8、1.0 mg,上樣體積350 μL),參照表1設置等電聚焦程序。等電聚焦結束后將第一向膠條分別置于含2%DTT和 2.5%IAA的平衡液中 (6 mol/L尿素,75 mmol/L Tris-HCl,pH 8.8,20%甘油,4 g/dL SDS)各平衡15 min,然后再轉移第二向垂直電泳。
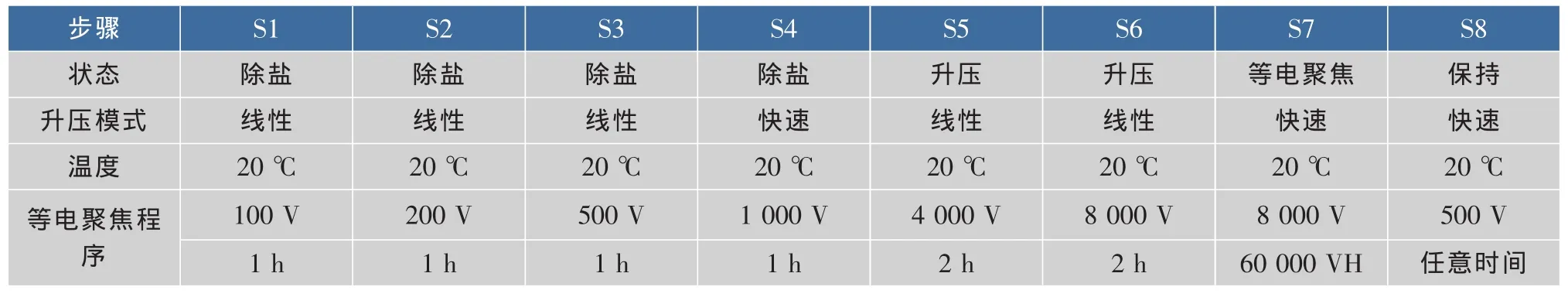
表1 17 cm線性膠條的雙向電泳等電聚焦程序Table 1 Isoelectric focusing programme of 2-DE with 17 cm liner strips
第二向SDS-PAGE采用的膠質量濃度為12 g/dL,采用恒功率進行垂直電泳,起始用1 W/gel進行100 min后,改為15 W/gel直到溴酚藍到達膠底部,停止電泳,取下凝膠。
染色方法采用考馬斯亮藍G-250膠體考染。凝膠在(40%甲醇,10%冰醋酸,50%超純水)中固定2 h,用改進的膠體考染液(0.12%G-250,10%磷酸,10%硫酸銨,20%甲醇)染色過夜,用蒸餾水沖洗凝膠兩次,加入脫色液(10%甲醇,8%冰醋酸,82%超純水)進行脫色,直到凝膠背景清晰,蛋白質點明顯可見為止。
1.4 凝膠的圖像采集與分析
脫色后的凝膠用Versdoc 3000凝膠成像系統采集圖像,分辨率為300 dpi,保存為GSC的圖像文件,應用PDQuest 7.2軟件進行圖像分析。
2 結果與分析
2.1 不同提取方法對蛋白質產量和2-DE效果的影響
試驗用TCA/丙酮沉淀法和改良酚抽法提取茭白總蛋白質,經Bradford法定量分析表明,用TCA/丙酮沉淀法提取的蛋白質質量濃度平均值為4.95 mg/mL,而改良酚抽法為19.98 mg/mL,約為TCA/丙酮沉淀法的4倍,差異顯著,表明改良酚抽法對茭白總蛋白質提取效果明顯優于TCA/丙酮沉淀法。取TCA/丙酮沉淀法和改良酚抽法得到的蛋白質樣品,分別以17 cm、pH 3~10 和 pH 4~7 IPG 膠條、1.0 mg上樣量、12 g/dL SDS-PAGE進行雙向電泳分離,0.12%考馬斯亮藍G-250膠體考染法染色,比較兩種提取方法對2-DE效果的影響,結果見圖1。
圖l顯示,用TCA/丙酮沉淀法和改良酚抽法提取的蛋白質,所得的2-DE圖譜蛋白質點均較清晰呈圓形,凝膠背景干凈,分辨率較高,橫豎條紋干擾較少。經PDQuest 7.2軟件統計分析,在相同參數設置條件下,TCA/丙酮沉淀法在膠面上可分辨出93個蛋白質點,改良酚抽法則可檢測到657個清晰的蛋白質點,比TCA/丙酮沉淀法多564個蛋白質點,進一步證明了改良酚抽法對茭白總蛋白質提取效果優于TCA/丙酮沉淀法。然而,劉倩等[15]采用TCA/丙酮沉淀法提取茭白總蛋白質,銀染法染色后所得的2-DE圖譜可檢測到1 500個蛋白質點,這可能與銀染法的高靈敏度有關,具體原因還有待進一步研究。
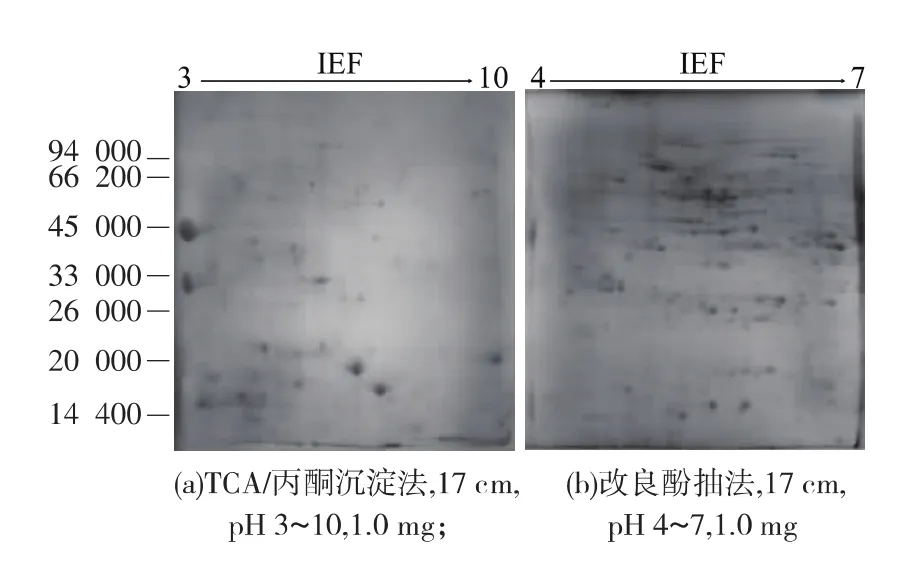
圖1 不同提取方法對茭白2-DE圖譜的影響Fig.1 Effect of different protein extraction methods on 2-DE map of Z.latifolia
2.2 第一向等電聚焦pH范圍對2-DE效果的影響
為獲得最適合茭白總蛋白質分離的IPG膠條pH范圍,首先采用17 cm、pH 3~10的IPG膠條對TCA/丙酮沉淀法提取的蛋白質進行雙向電泳分析,結果見圖1a。圖1a顯示,茭白總蛋白質主要分布在酸性至中性區域,而堿性端蛋白質點數量較少,且蛋白質點存在一些重疊現象,表明利用pH 3~10的膠條不能有效地將蛋白質點分開。為了達到更好的分離效果,用pH 4~7的膠條對改良酚抽法提取的蛋白質樣品進行試驗。結果顯示,分離效果明顯提高,在pH 3~10膠條上沒有分開的點已經完全分開,沒有明顯的重疊現象,在整個圖譜上的分布較為理想,極大地提高了2-DE圖譜的分辨率(圖1b)。
2.3 蛋白質上樣量和SDS-PAGE膠質量濃度對2-DE效果的影響
取酚抽法得到的茭白蛋白質樣品,選用17 cm、pH 4~7的IPG膠條,分別取0.8、1.0 mg的蛋白質樣品進行雙向電泳。上樣量為0.8 mg時,2-DE圖譜上蛋白質點較少,只檢測到596個蛋白質點,蛋白質點豐度均較弱,尤其低豐度蛋白質不能被檢測到,影響了雙向電泳的準確性和重復性(圖2a);上樣量為1.0 mg時,蛋白質點數較多,檢測到657個蛋白質點,且蛋白質點清晰,重疊現象少,圖譜質量較佳(圖 2b)。
此外,SDS-PAGE分離膠濃度也是影響蛋白質分離效果的重要因素。雙向電泳中,由于不同來源的蛋白質分子質量范圍不同,適宜的SDS-PAGE凝膠質量濃度亦不同。根據多次試驗分析表明,茭白總蛋白質第二向SDS-PAGE膠的質量濃度在12 g/dL最為合適,太低會導致小相對分子質量蛋白質點丟失,太高會導致蛋白質點分辨率不高,且出現部分蛋白質點重疊現象。于馮等[17]在對秋茄葉片及劉麗娟等在對生菜葉片總蛋白質雙向電泳技術體系的研究中也得到類似結果。

圖2 不同蛋白質上樣量對茭白雙向電泳圖譜的影響Fig.2 Effect of different loading quantities on 2-DE maps of Z.latifolia
3 討論
3.1 蛋白質提取方法
蛋白質樣品制備是雙向電泳技術體系中最關鍵的步驟,樣品中蛋白質的種類、純度和再溶性將直接影響雙向電泳的成敗。丙酮法、TCA/丙酮法和酚抽法是目前植物組織蛋白質提取常用的3種方法。然而,由于不同植物其組成成分各不相同,而且含有大量干擾性物質如色素、多糖、核酸、脂類和鹽類等,至今并沒有哪一種方法能適用于所有植物,研究人員往往根據自己研究的實驗材料探索適宜的蛋白質提取方法。Muccilli等[10]比較了TCA/丙酮法和酚抽法提取柑橘果實總蛋白的效果,發現酚抽法提取得到的蛋白質純度高,經雙向電泳分析能得到分辨率較高的圖譜;梁文裕等[13]對發菜總蛋白質提取方法的研究表明,改良TCA/丙酮法得到的蛋白質含量雖然少于酚抽法,但電泳圖譜顯示蛋白質分離效果較酚抽法好,蛋白質點清晰。作者比較了TCA/丙酮法和酚抽法提取茭白總蛋白的雙向電泳結果,發現利用酚抽法提取蛋白質,不僅提取效率高,而且雜質干擾少,得到的2-DE圖譜中,蛋白質條帶清晰,數量較多,適合茭白總蛋白質的提取。
3.2 上樣量的選擇
上樣量的多少是影響2-DE圖譜清晰度及蛋白質點多少的另一重要因素,受到IPG膠條長度、pH范圍、染色方法、高豐度和低豐度蛋白的分布等多種因素的制約。過低的上樣量不利于一些低豐度蛋白的檢測,但過高的上樣量也會導致蛋白質在聚焦過程中發生沉積而不能很好地進入IPG膠條。甘露等對甘藍型油菜蛋白質雙向電泳體系研究表明,采用17 cm、pH 4~7的IPG膠條時,最適蛋白質上樣量為1.0 mg。本試驗選用17 cm、pH 4~7的IPG膠條、考馬斯亮藍G-250染色,比較了0.8、1.0 mg兩種不同上樣量的雙向電泳結果,發現上樣量為1.0 mg時,得到電泳圖譜中蛋白質點數較多、背景清晰。
3.3 IPG膠條pH范圍
IPG膠條pH范圍對雙向電泳圖譜也有重要影響。寬pH范圍的IPG膠條能初步分析蛋白質的分布狀況,但是等電點相近的蛋白質難以有效分離,窄pH范圍IPG膠條盡管會丟失其pH值范圍之外的蛋白質,但分辨率和靈敏度大大提高。作者首先采用pH 3~l0的IPG膠條對茭白蛋白質進行分離,發現茭白蛋白質主要分布在pH 4~7范圍,進一步選用pH 4~7范圍的IPG膠條進行雙向電泳分離,分辨率得到顯著提高。
4 結語
通過對茭白總蛋白不同提取方法、不同pH梯度范圍、不同蛋白質上樣量的選擇,探索出一套適合茭白蛋白質分析的雙向電泳方法,即采用改良酚抽法制備蛋白質干粉、17 cm、pH 4~7的膠條、1.0 mg的蛋白質上樣量、12 g/dL的SDS-PAGE凝膠濃度,經考馬斯亮藍G-250膠體考染法染色后可獲得分辨率高、重復性好的蛋白質2-DE圖譜。
[1]張麗,羅海波,姜麗,等.果實成熟衰老過程中蛋白質組學研究進展[J].植物生理學報,2011,47(9):861-871.ZHANG Li,LUO Hai-bo,JI Li,et al.Advances in proteomics related to fruit ripening and senescence[J].Plant Physiology Journal,2011,47(9):861-871.(in Chinese)
[2]TakácˇT,Pechan T,Sˇamaj J.Differential proteomics of plant development[J].Journal of Proteomics,2011,74(5):577-588.
[3]馬洪雨,王占奎,俞闐,等.適用于黃麻根部蛋白質組學分析的雙向電泳技術[J].西北植物學報,2010,30(1):195-202.MA Hong-yu,WANG Zhan-kui,YU Tian,et al.Two-dimensional electrophoresis protocol for root proteomics analysis of Orchorus olitorius[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(1):195-202.(in Chinese)
[4]Mukherjee A K,Carp M J,Zuchman R,et al.Proteomics of the response of Arabidopsis thaliana to infection with Alternaria brassicicola[J].Journal of Proteomics,2010,73:709-720.
[5]Chen X Y,Kim S T,Cho W K,et al.Proteomics of weakly bound cell wall proteins in rice calli[J].Journal of Plant Physiology,2009,166:675-685.
[6]Irar S,Brini F,Godaya A,et al.Proteomic analysis of wheat embryos with 2-DE and liquid-phase chromatography(Proteome Lab PF-2D) — A wider perspective of the proteome[J].Journal of Proteomics,2010,73:1707-1721.
[7]Li K,Xu C,Zhang J.Proteome profile of maize (Zea mays L.) leaf tissue at the flowering stage after long-term adjustment to rice black-streaked dwarf virus infection[J].Gene,2011,6:16.
[8]Zhang L,Yu Z,Jiang L,et al.Effect of post-harvest heat treatment on proteome change of peach fruit during ripening[J].Journal of Proteomics,2011,74:1135-1149.
[9]Bianco L,Lopez L,Scalone A G,et al.Strawberry proteome characterization and its regulation during fruit ripening and in different genotypes[J].Journal of Proteomics,2009,72:586-607.
[10]Muccilli V,Liceiardello C,Fontanini D,et al.Proteome analysis of Citrus sinensis L.(Osbeck) flesh at ripening time[J].Journal of Proteomics,2009,73:134-152.
[11]Page D,Gouble B,Valot B,et al.Protective proteins are differentially expressed in tomato genotypes differing for their tolerance to low-temperature storage[J].Planta,2010,232:483-500.
[12]張僑,韓瑩琰,范雙喜,等.葉用萵苣葉片蛋白質雙向電泳技術體系的建立[J].中國農學通報,2010,26(13):279-283.ZHANG Qiao,HAN Ying-yan,FAN Shuang-xi,et al.Establishment of technique of proteome two-dimensional electrophoresis of the leaf of Lactuca sative L[J].Chinese Agricultural Science Bulletin,2010,26(13):279-283.(in Chinese)
[13]梁文裕,王星,焦廣飛,等.發菜蛋白質組雙向電泳技術的建立及優化[J].西北植物學報,2009,29(8):1550-1556.LIANG Wen-yu,WANG Xing,JIAO Guang-fei,et al.Establishment and optimizationof two dimensional gel electrophoresisfor proteomeof nostoc flagelliforme[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(8):1550-1556.(in Chinese)
[14]俞小平,陳建明.茭白高效安全生產大全[M].北京:中國農業出版社,2008:1-10.
[15]劉倩,阮松林,俞曉平,等.適于茭白莖部蛋白質組分析的雙向電泳技術體系的建立[J].浙江農業學報,2010,22(3):281-286.LIU Qian,RUAN Song-lin,YU Xiao-ping,et al.A two-dimensional electrophoresis protocol suitable for proteomic study of stem in Zizania latifolia Turcz.[J].Acta Agriculturae Zhejiangensis,2010,22(3):281-286.(in Chinese)
[16]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[17]于馮,鄭春芳,施孟如,等.紅樹植物秋茄葉片雙向電泳技術體系的建立及優化[J].熱帶亞熱帶植物學報,201l,19(6):519-523.YU Feng,ZHENG Chun-fang,SHI Meng-ru,et al.Establishment and optimization of 2-DE technique system in leaf proteome of Kandelia candel[J].熱帶亞熱帶植物學報,201l,19(6):519-523.(in Chinese)

