混合液態載體對高壓射流均質玉米淀粉顆粒微細化的影響
劉 斌,張 媛,馮 濤,吳 雪
(北京工商大學材料與機械工程學院,北京 100048)
高壓射流均質是利用一定的壓力或動力系統迫使液態混合物料短時間內高速通過微米級縫隙(環形或狹長狀)或微孔,造成物料各組分發生破碎或化學變化的過程。在微細化作用機理的研究中,剪切作用[1-3]、壓力釋放作用[4-6]導致的剪切破碎、碰撞作用[7-8]導致的沖擊破碎以及湍流作用導致的摩擦破碎皆受限于動力系統的速度和形成的壓力。而文獻[9]表明,隨著均質壓力和通過次數的增加,高壓射流均質的破碎效力呈邊際效應遞減規律。在單純提高壓力和破碎次數無法增強微細化效果時,以強化空化作用提高高壓射流均質過程的微細化效果研究顯得十分必要[10-13]。因為空泡的產生以及空泡潰滅的沖擊作用受流道結構、介質、溫度等因素影響較大,而受單純的壓力提高因素較小;而且空化作用是高壓射流均質過程中載料介質的瞬間氣液相變和體積改變產生的微爆炸和微撞擊作用,不論系統操作壓力如何,只要空泡產生,在周圍不可壓縮介質上,空泡潰滅時的微爆炸和微撞擊作用巨大;同時空泡產生在固態顆粒周圍的概率較大,這是因為“雜質”的存在會形成復雜界面導致類似“尖點放電效應”而加劇空泡的產生,這也提高了空泡潰滅在“雜質”顆粒附近的概率,提高了空化效應的作用效率[14-17]。在前期的研究工作中,依據高壓射流均質過程的射流噪聲量級和頻譜分析,筆者發現通過在載料介質(通常為水)中添加低沸點組分(例如乙醇)可以明顯強化空化效應;乙醇-水溶液中乙醇摩爾分數xA為0.24時,射流噪聲量級達到最高,表明空化作用最強[18]。
淀粉是重要的食品和化工原料,通過物理、化學或酶法改性處理獲得的變性淀粉具有更優良的性質。淀粉顆粒在物理破碎條件下,隨著形態的改變,淀粉的分子結構也發生變化,從而導致物理化學性質如糊化性質和化學活性等相應發生改變。已有研究結果指出,經過160MPa高壓射流均質處理,糯米淀粉被沖擊成片狀,完全失去原有顆粒狀態[19]。經過150MPa高壓射流均質處理,木薯淀粉的熔化焓大幅降低[20]。玉米淀粉在140MPa高壓射流均質處理后,晶體結構消失[21]。因此,本實驗主要通過顯微結構及糊化特性的變化,對比研究單一載料介質與添加低沸點介質制成的混合載料介質對玉米淀粉高壓射流均質過程的影響,以探索通過改變載料介質以強化空化效應的高壓射流均質方法對玉米淀粉分子結構的影響,以期為新的高壓射流均質方法應用于生物大分子改性提供一定的依據。
1 材料與方法
1.1 材料
玉米淀粉 河北科恩淀粉有限公司。
1.2 儀器與設備
NCJJ-0.005/150納米超高壓均質機 廊坊通用機械制造有限公司;Tescan Vega Ⅱ掃描電子顯微鏡 捷克Tescan S.R.O公司;BX51- 75A21P偏光顯微鏡 奧林巴斯中國有限公司;DSC Q100差示掃描量熱分析儀 美國TA儀器公司。
1.3 方法
1.3.1 制備淀粉懸濁液
稱取4g淀粉置于燒杯中,用蒸餾水定容至1000mL,制成4g/L淀粉懸濁液1#。秤取4g淀粉置于燒杯中,用乙醇摩爾分數為0.24的乙醇-水溶液定容至1000mL,制成4g/L淀粉懸濁液2#。1#、2#淀粉懸濁液經200目篩網過濾。
1.3.2 高壓射流均質處理
對1#、2#淀粉懸濁液進行高壓射流均質處理6次。均質操作采用天然金剛石閥,閥孔直徑70μm,柱塞直線速率0.0555m/s。設備運行過程中,增壓泵柱塞反復推進,料腔內積累了由部分壓力能轉變的熱能,應用數字溫度計監測料腔溫度,通過停機冷卻方式,保證料腔溫度低于40℃。
1.3.3 顯微結構觀察
將經過0、3、6次高壓射流均質處理后的淀粉懸濁液1#、2#搖勻,量取10mL,置于高速離心機內,在3500r/min轉速條件下,離心處理5min,然后除去清液,加入10mL無水乙醇,上述離心處理執行3次。然后除去8mL上清液,再次搖勻剩余底液,用移液槍量取0.1mL懸濁液置于樣品臺的導電膠上。待導電膠自然干燥后,將樣品臺置于噴金室內,在25mA電流條件下噴金處理2min,分別制成1#-0次、1#-3次、1#-6次、2#-0次、2#-3次、2#-6次樣品,放入掃描電鏡內觀察。
1.3.4 DSC分析檢測
將經過0、6次高壓射流破碎處理的1#、2#淀粉懸濁液樣品真空過濾后,經無水乙醇清洗3次,置于烘箱內在37℃干燥處理24h,制成1#-0次、1#-6次、2#-0次、2#-6次干樣品。分別稱量干樣品2.500g后,與7.5mL去離子水均勻混合,制成1#-0次、1#-6次、2#-0次、2#-6次濕樣品。搖勻后,分別取1#-0次、1#-6次、2#-0次、2#-6次濕樣品2~5mg置于鋁制坩堝,立即密封。放入差示掃描量熱分析儀中進行熱分析,樣品加熱范圍20~90℃,升溫速率10℃/min。
1.3.5 偏光顯微鏡觀察
將經過0、6次高壓射流破碎處理的淀粉懸濁液1#、2#搖勻后,分別滴于載玻片,蓋上蓋玻片,置于偏光顯微鏡的載物臺上進行觀察。
2 結果與分析
2.1 單一或混合載料介質對玉米淀粉顯微結構的影響

圖1 掃描電鏡分析(×5000)Fig.1 SEM observation (×5000)
1#淀粉懸濁液的高壓射流均質過程中,平均操作壓力為95MPa。與原淀粉顆粒(圖1a)相比,經過3次高壓射流均質處理,顆粒大小無明顯變化,淀粉仍然保持完整的微粒結構,少量淀粉顆粒表面局部產生剝落、缺損,部分顆粒表面光滑程度降低,有輕微凹凸痕跡出現(圖1b);如圖1c所示,6次高壓射流處理后,淀粉顆粒基本保持完整結構,顆粒棱角明顯模糊,呈現一定的卵石化效果。這一系列結果說明,高壓射流均質過程的壓力釋放、剪切、空化、湍流、摩擦等多重作用對玉米淀粉固體顆粒的表觀結構破壞不明顯。在相同實驗條件下,2#淀粉懸濁液的高壓射流破碎過程平均操作壓力為98MPa。與原淀粉顆粒(圖1d)相比,經3次高壓射流均質處理,顆粒大小無明顯變化,但大多數顆粒表面開始有明顯的片狀剝落,不規則區域增多,并且淀粉顆粒表面出現了碎屑狀附著物(圖1e);如圖1f所示,6次處理后,除淀粉顆粒卵石化效果更加明顯、表面缺損進一步增加外,最突出的現象是淀粉顆粒間出現了大量膠體形態的黏著物。
0、3、6次高壓射流均質處理的1#、2#淀粉懸濁液的顯微結構對比分析表明,與水相比,乙醇-水溶液為載料介質時,高壓射流均質對淀粉顆粒的破壞作用明顯加強。而前期研究結果證實[18],與單一載料介質水相比,以乙醇-水二元組分介質作為載料介質的高壓射流均質過程壓力釋放、剪切等多重作用無明顯變化,但空泡潰滅形成的空化作用明顯加劇。同時2.1節的實驗結果是在嚴格控制進料溫度低于40℃的條件下進行的,在一定程度上可以排除常規條件下溫度造成的影響。因此,通過在單一載料介質水中添加低沸點組分乙醇,高壓射流均質過程的空化作用增強,而引起空化作用的空泡潰滅發生在玉米淀粉固體顆粒周圍時,多次的微爆炸沖擊作用明顯改變淀粉顆粒的表觀結構。
2.2 DSC分析
2#-0次濕樣品的DSC結果見圖2a,熔融峰的極值溫度Tp為72.19℃,說明未處理淀粉顆粒具有規則排列的晶體結構,DSC分析過程存在明顯的熱流變化,1#-0次濕樣品與2#-0次濕樣品的DSC結果基本相同,因此不再累述。1#-6次濕樣品的DSC分析結果如圖2b所示,熔融峰的極值溫度Tp為69.90℃,說明淀粉顆粒的微晶結構稍有變化,但淀粉顆粒仍然基本保持規則排列的晶體結構。如圖2c所示,與2#-0次、1#-6次濕樣品的DSC過程相比,2#-6次濕樣品的DSC分析過程中不再有明顯的熔融峰出現,說明淀粉顆粒晶體排列的有序狀態可能被破壞,在其DSC分析過程中不同于具備晶體結構的顆粒那樣存在明顯的熱流變化。圖2c中,1#-6次、2#-6次濕樣品DSC曲線的對比分析說明,高壓射流均質過程采用混合液態載體要比單一液態載體對顆粒的破碎作用明顯。

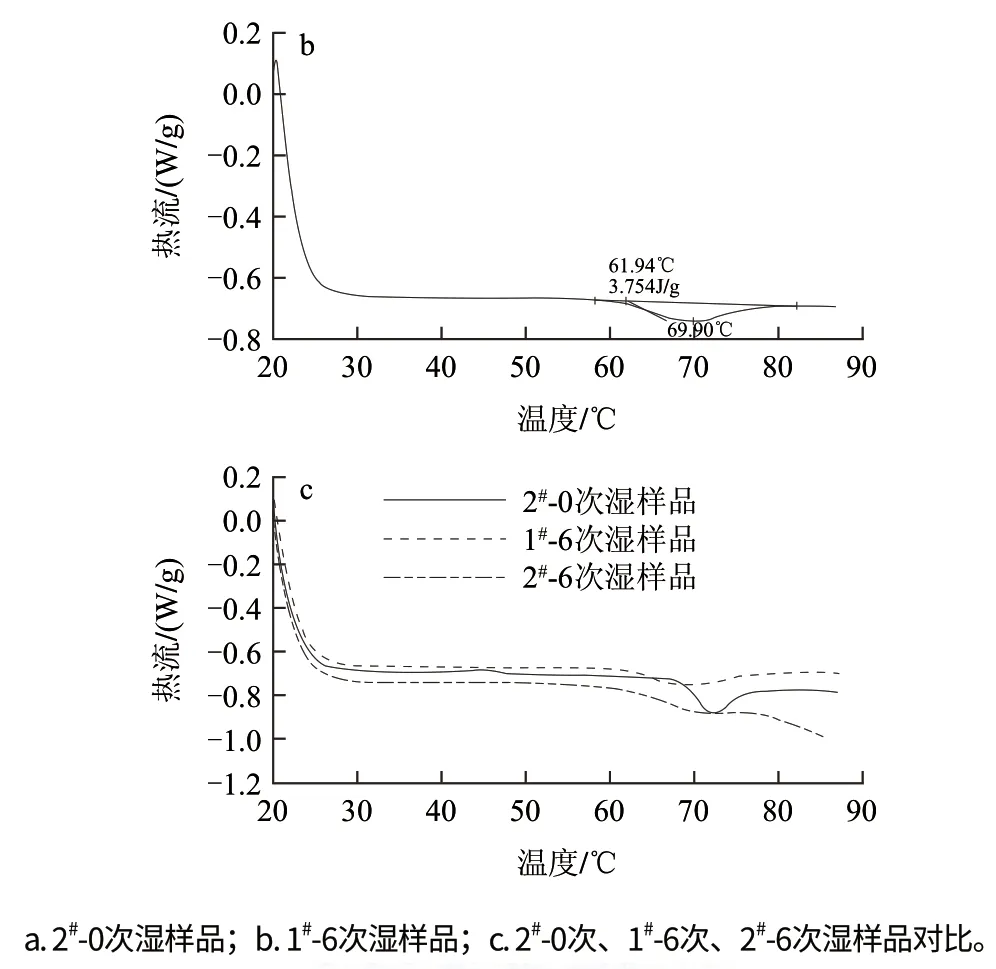
圖2 差示掃描量熱分析Fig.2 DSC analysis
2.3 偏光顯微鏡觀察結果

圖3 偏光顯微鏡分析(×5000)Fig.3 PLM analysis (×5000)
在正交偏振光條件下,原淀粉顆粒大多數出現了黑十字效應,如圖3a、c所示。1#-6次樣品中的多數淀粉顆粒在正交偏振光條件下基本保持黑十字效應,如圖3b所示。在正交偏振光條件下,2#-6次樣品中的淀粉顆粒的黑十字變得模糊,如圖3d所示,說明淀粉的微晶結構受到一定程度的破壞。偏光顯微鏡的觀察結果與DSC分析結果基本一致。
3 結 論
掃描電鏡、DSC分析和偏光顯微鏡的綜合檢測結果表明,以水為載料介質,在95MPa的操作壓力條件下高壓射流均質過程對淀粉微晶結構的破壞能力有限;而以乙醇-水溶液為載料介質,在相同操作壓力條件下,對淀粉微晶結構的破壞作用更加明顯,與文獻[19-21]中操作壓力在140~160MPa時的破壞能力相當。通過掃描電鏡的觀察,乙醇-水溶液作為高壓射流均質過程的載料介質,對淀粉顆粒結構的表觀破壞主要是淀粉顆粒表層剝落。DSC分析則證明了采用混合液態載體,高壓射流均質過程能夠改變淀粉顆粒原有的規則、密實晶體排列形式。淀粉顆粒的DSC過程無明顯的熔融峰出現,有可能是高壓射流均質過程造成了晶體間連接的松動并導致了微裂紋的產生,進而更多地暴露出親水基團,使原有的完全依賴提供熱量來增加分子動能、克服分子間連接和相互束縛、與水結合膨脹成無序溶膠結構的能量供給形式發生改變,即用破碎能替代糊化熱能。從而進一步證實在相同設定操作條件下,二元組分載料介質的比單一載料介質有更強的氣-液-固沖擊作用。
[1]BROOKMAN J S G.Mechanism of cell disintegration in a high pressure homogenizer[J].Biotechnology and Bioengineering, 1974,16: 371-383.
[2]RAM A, KADIM A.Shear degradation of polymer solutions[J].Journal of Applied Polymer Science, 1970, 14: 2145-2156.
[3]LANDER R, MANGER W, SCOULOUDIS M, et al.Gaulin homogenization: a mechanistic study[J].Biotechnology Progress,2000, 16: 80-85.
[4]BROOKMAN J S G.Further studies on the mechanism of cell disruption by extreme pressure extrusion[J].Biotechnol Bioengng,1975, 17: 465-479.
[5]KEINIG A R, MIDDLEBERG A P J.the correlation of cell disruption with homogeniser valve pressure gradient determined by computational fluid dynamics[J].Chemical Engineering Science,1996, 51(23): 5103-5110.
[6]SHIRGAONKAR I Z, LOTHE R R, PANDIT A B.Comments on the mechanism of microbial cell disruption in high-pressure and highspeed devices[J].Biotechnol Prog, 1998, 14: 657-660.
[7]ENGLER C R, ROBINSON C W.Disruption of Candida utilizes cells in high pressure flow devices[J].Biotechnology and Bioengineering,1981, 23: 765-780.
[8]KESHAVARZ M E, HOARE M P.Disruption of bakers yeast in a high-pressure homogenizer:new evidence on mechanism[J].Enzyme Microbial Technology, 1990, 12: 764-700.
[9]DONSI F, FERRARI G, LENZA E, et al.Main factor regulating microbial inactivation by high-pressure homogenization: operating parameters and scale of operation[J].Chemical Engineering Science,2009, 64: 520-532.
[10]FLOURY J, BELLETTRE J, LEGRAND J, et al.Analysis of a new type of high pressure homogeniser[J].Chemical Engineering Science,2004, 59: 843-853.
[11]BUDDE C, SCHAFFNER D, WALZEL P.Drop breakup in liquidliquid dispersion at an orifice plate observed in a large-scale model[J].Chemical Engineering & Technology, 2002, 25: 1164-1167.
[12]INNINGS F, TRAGARDH C.Visualization of the drop deformation and break-up process in a high pressure homogenizer[J].Chemical Engineering & Technology, 2005, 28: 882-891.
[13]HAKANSSON A, FUCHS L, INNINGS F, et al.Visual observations and acoustic measurements of cavitation in an experimental model of a high-pressure homogenizer[J].Journal of Food Engineering, 2010,100: 504-513.
[14]WANG Y C, BRENNEN C E.Numerical computation of shock waves in a spherical cloud of cavitation bubbles[J].Trans ASME J Fluid Eng,1999, 121(2): 872-880.
[15]SHAH Y T, PANDIT A B, MOHOLKAR V S.Cavitation reaction engineering[M].New York: Kluwer Academic/Plenum Publishers.1999: 15-33.
[16]巴切勒G K.流體動力學引論[M].北京: 科學出版社, 1997: 559-571.
[17]BRENNEN C E.Cavitation and bubble dynamics[M].Oxford: Oxford University Press, 1995: 35-43.
[18]吳雪, 張紹英, 馮濤, 等.高壓均質過程中射流噪聲與空化效應的關聯分析與實證[J].農業工程學報, 2011(1): 170-174.
[19]涂宗財, 朱秀梅, 陳鋼, 等.動態超高壓微射流對糯米淀粉結構的影響[J].光譜學與光譜分析, 2010, 30(3): 834-837.
[20]KASEMWONG K, RUNGSARDTHONG U, SRINUANCHAI W, et al.Effect of high-pressure microfluidization on the structure of cassava starch granule[J].Starch-St rke, 2011, 63: 160-170.
[21]WANG Bao, LI Dong, WANG Lijun, et al.Effect of high-pressre homogenization on the structure and thermal properties of maize starch[J].Journal of Food Engineering, 2008, 87: 436-444.

