甲狀腺乳頭狀癌合并橋本病的超聲及臨床病理特征
葉昀亮,項穎穎,鄭華敏,程溥,張筱驊
(溫州醫科大學附屬第一醫院,浙江 溫州 325000,1.腫瘤外科;2.超聲診斷科)
甲狀腺癌是頭頸部最常見的惡性腫瘤之一,而甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)是最常見的甲狀腺癌表現型,占了所有甲狀腺癌的70%~80%。橋本病(Hashimoto’s thyroiditis,HT)作為甲狀腺最常見的自身免疫性疾病,在病理上可見到特征性的廣泛擴散的淋巴細胞浸潤。自從1955年Dailey等[1]發現 HT患者中PTC的發病率要遠遠超過流行病學普通人群的發病率,并第一次提出HT和PTC存在相關性后,人們對兩者間的關系進行了大量研究,但至今關于HT對PTC的術前超聲特征及臨床病理特點的影響仍存在爭議,且國內相關的臨床大樣本研究(總例數大于1000例)尚較少。故本研究旨在通過大樣本分析探討PTC合并HT患者的術前超聲特征及臨床病理特點。
1 對象和方法
1.1 對象 2010年7月-2012年10月在我院行甲狀腺手術且術后病理證實為PTC的連續性患者共1090例,其中男265例,女825例,男女比約為1:3,最小年齡13歲,最大年齡83歲,平均(46.01±10.93)歲。所有患者術前均行常規甲狀腺B超檢查。根據術后病理檢查是否合并HT,將患者分為PTC合并HT組(PTC-HT組)和PTC未合并HT組(PTC組)。
1.2 研究方法 采用回顧性資料分析,比較兩組間術前B超特征及臨床病理特點存在的差別。術前B超特征包括腫塊邊界、形態、內部回聲、內部血流、鈣化等。臨床病理特點包括年齡、性別、術前促甲狀腺激素(thyroid-stimulating hormone,TSH)水平、腫塊大小、包膜侵襲、包膜外侵襲、淋巴結轉移、病理分期等。
1.3 統計學處理方法 使用SPSS 19.0統計學軟件處理數據。計數資料組間比較采用x2檢驗;計量數據用 ±s表示,如服從正態分布,采用t檢驗,如不服從,則采用Mann-Whitney U檢驗。將單因素分析有統計學意義的變量納入logistic回歸分析以確定獨立的影響因素。P<0.05表示差異有統計學意義。
2 結果
2.1 兩組患者基本資料 本研究中患者1090例均采用甲狀腺全切或近全切手術方式,伴或不伴中央區或側區頸淋巴結清掃術。PTC-HT組患者共232例,其中女213例(占91.81%),男19例(占8.19%),平均年齡為(44.55±10.41)歲,行中央區淋巴結清掃術159例,側區淋巴結清掃術47例。PTC組患者共858例,其中女612例(占71.33%),男246例(占28.67%),平均年齡為(46.42±11.05)歲,行中央區淋巴結清掃術586例,側區淋巴結清掃術180例。
2.2 單因素分析結果 術前B超方面,PTC-HT組患者較PTC組腫塊邊界不清的概率更高(x2=4.435,P<0.05),其余指標如腫塊形態、內部回聲、內部血流、鈣化、腫大的淋巴結差異均無統計學意義(P>0.05)(見表1)。臨床病理特點方面,PTC-HT組較PTC組患者年齡更輕(t=-2.372,P<0.01)、女性患者更多見(x2=41.633,P<0.01)、術前TSH水平更高(Z=-4.935,P<0.01)、甲狀腺癌多灶性發生率更高(x2=14.641,P<0.05),而兩組在腫塊大小、包膜侵襲、包膜外侵襲、淋巴結轉移、腫瘤分期之間差異無統計學意義(P>0.05)(見表2)。
2.3 Logistic回歸分析結果 腫塊邊界不清發生率在兩組間不存在統計學差異,但年齡、性別、術前TSH水平和甲狀腺癌多灶性方面差異仍有統計學意義(P<0.05)(見表3)。
3 討論
B超作為術前甲狀腺結節的常規檢查,在輔助診斷方面起著重要的作用。單純PTC的超聲典型圖像特征常表現為低回聲、邊界不清、微鈣化、內部豐富血流等。HT在超聲圖像上常顯示廣泛的纖維化、彌漫性增大的腺葉及不均勻的實質背景。PTC合并HT時,HT是否會顯著改變PTC的超聲典型圖像特征目前仍存在爭議。本研究發現PTC合并HT患者在超聲上有著更高的腫塊邊界不清發生率,可能與HT在發展過程中由于彌漫性浸潤的淋巴結細胞逐漸趨于局限化在超聲上呈現為邊界不清的結節樣改變有關。這與崔文霞等[2]在大樣本的PTC患者(n=2144)的超聲特征研究中得出的結論相似。但Glu等[3]研究發現合并HT并不會對PTC相關的超聲特征產生影響,這可能與其入選的例數較少有關。Ohmori等[4]研究發現合并HT的PTC患者超聲圖像上表現出更高的粗大鈣化發生率及更低的微鈣化發生率(P<0.05),而本研究結果顯示不論是粗大鈣化的發生率還是微鈣化的發生率在兩組間差異均無統計學意義,分析結果不一致的可能原因為對HT的定義不同:本研究中采用診斷金標準術后病理定義HT患者,而Ohmori等的研究將術前血清甲狀腺球蛋白抗體或甲狀腺過氧化物酶抗體陽性的患者亦定義為HT患者,故關于HT對于鈣化的影響尚需要更多入選標準統一的大樣本研究來明確。本研究中進一步logistic回歸分析顯示腫塊邊界不清并不是PTC合并HT的獨立預測因素,故筆者認為,當HT患者合并甲狀腺結節時,超聲醫師在關于結節惡性風險的評估和診斷方面無需作出特殊的改變,這與文獻[3]的研究結論相似。
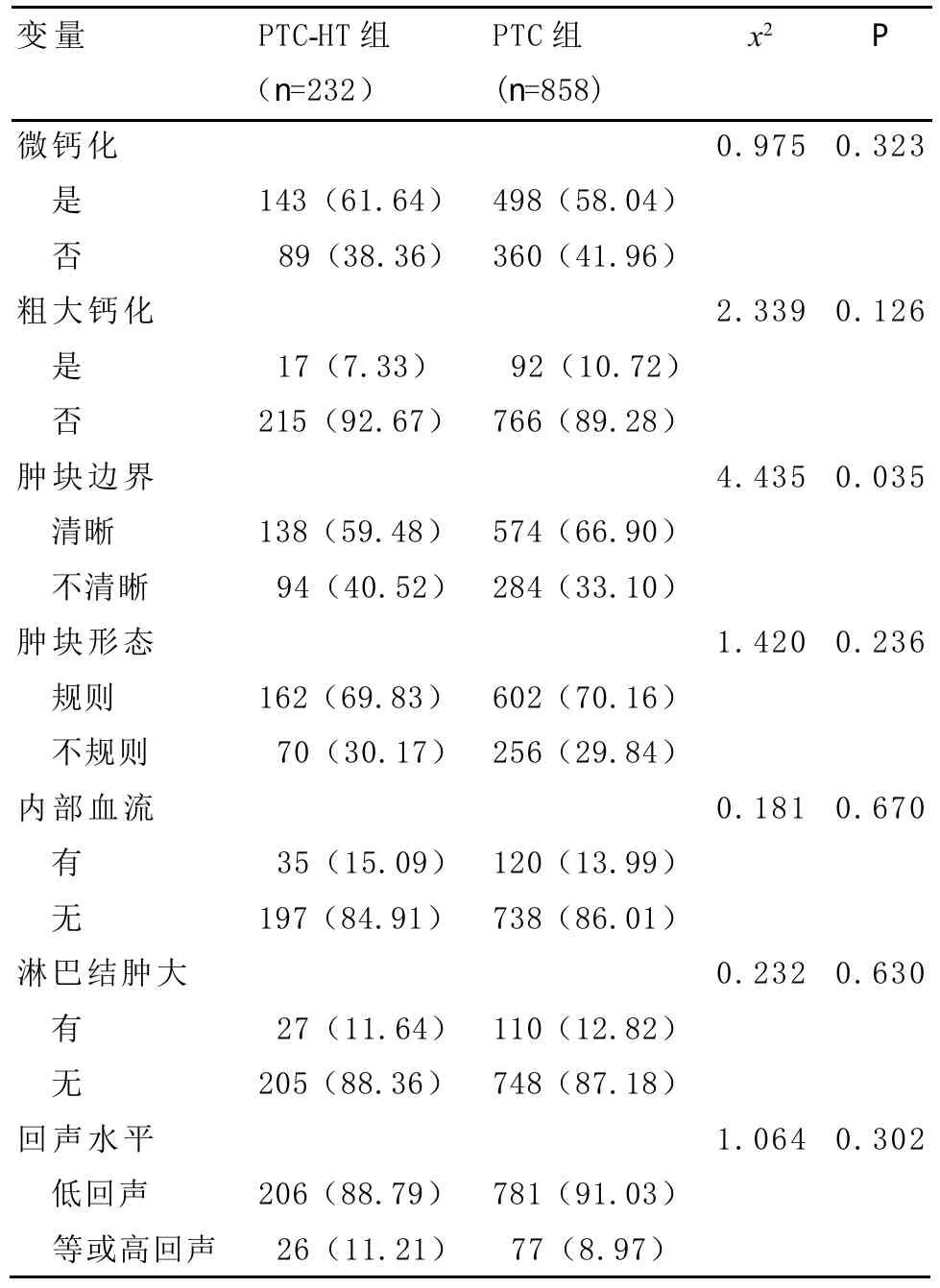
表1 兩組術前B超特征的比較 n(%)
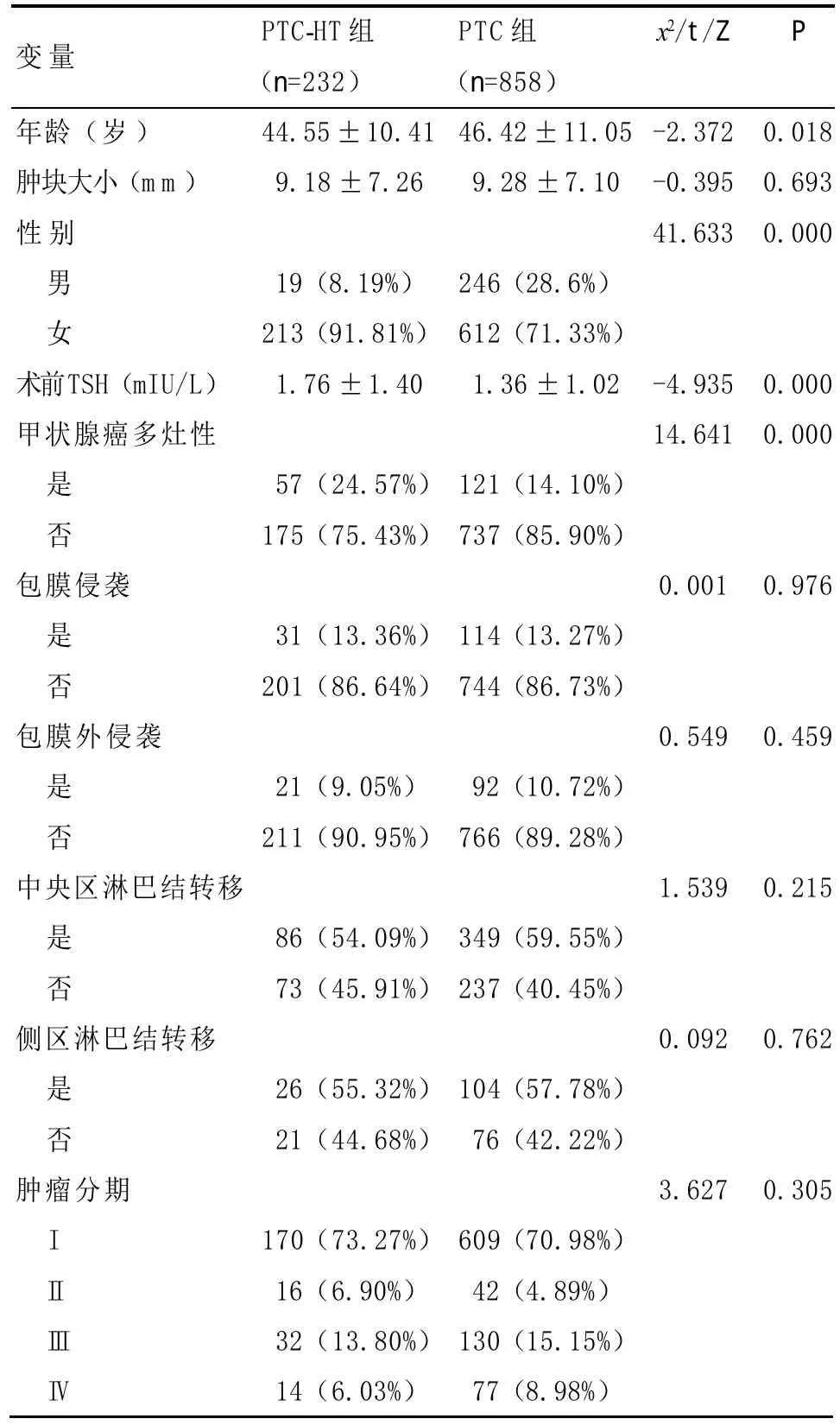
表2 兩組臨床病理特點的比較
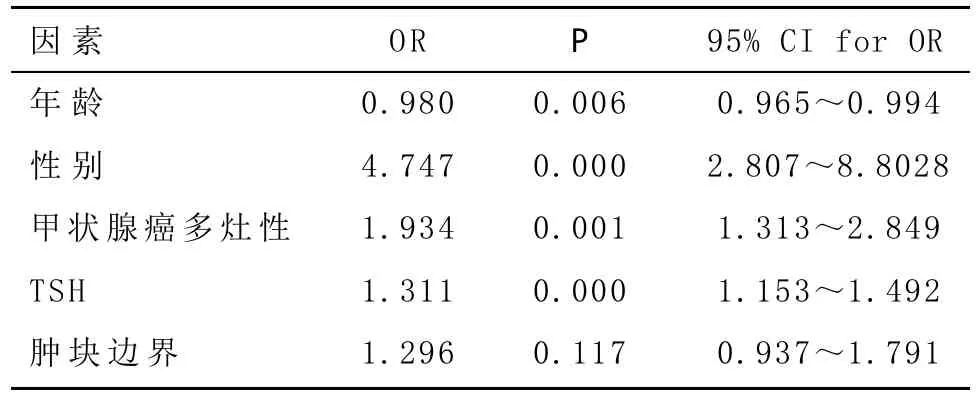
表3 logistic回歸分析結果
本研究顯示PTC-HT組較PTC組患者年齡更輕、女性患者更多見及更高的多灶性癌發生率,這與Kebebew等[5]的研究結果相符。女性更多見可能是因為HT更好發于女性患者,相關文獻亦有報道女性患HT的概率是男性的7倍[6]。HT通過破壞甲狀腺濾泡負反饋引起血清TSH濃度升高進一步刺激甲狀腺濾泡上皮增生產生可能的癌變及HT常表現為腺體內彌漫性的淋巴細胞浸潤的特性,也符合PTC合并HT患者更高的多灶性甲狀腺癌發生率和更高的TSH水平的臨床特征[7-8]。鑒于更高的多灶性癌發生率,臨床醫師在手術時對該類患者應注意對除主要病灶外其他病灶的仔細檢查和切除,尤其是難以察覺的微小病灶,手術方式也更傾向于選擇甲狀腺全切術。
有學者報道稱甲狀腺癌的預后與年齡、性別、腫塊大小、包膜外侵襲及淋巴結轉移等臨床因素相關[9-10]。然而對于合并HT是否可致PTC患者更好的預后目前尚無一致結論[9-11]。本研究顯示更輕的年齡及女性患者是PTC合并HT的獨立預測因素,這與文獻[9]報道相符。其中更輕的年齡提示患者處于更早的腫瘤分期及更高概率獲得早期診斷的可能性。Sciuto等[12]對1503例甲狀腺癌患者進行隨訪研究發現男性患者較女性患者的術后病死率及復發率均要高(P<0.05),故年輕女性患者多見提示PTC合并HT的患者在流行病學上可能有著更好的預后。此外關于HT可致PTC更好預后的可能機制和隨訪研究目前已有較多文獻報道。文獻[13]指出,HT在破壞正常甲狀腺組織的同時也可能參與了對腫瘤細胞的破壞,HT患者的甲狀腺濾泡細胞內可以檢測到由FAS/FAS配體激活的凋亡信號通路,該信號通路也可能參與了腫瘤細胞的破壞從而對機體起到保護作用。Kimura等[14]發現浸潤的淋巴細胞可通過分泌白介素-1抑制人類甲狀腺癌細胞的生長。Kim等[15]發現在PTC合并HT的患者中BRAF突變率顯著低于未合并HT的PTC患者,而BRAF突變是一項公認的用于預測甲狀腺癌預后的指標,故該結果提示合并HT的患者預后更佳。而一項1788例PTC患者的隨訪研究發現合并HT的PTC患者較單純PTC患者有著術后更低的腫瘤復發率和更長的無病生存期[16]。本研究中,腫瘤的侵襲性生物學行為包括包膜侵襲、包膜外侵襲及淋巴結轉移情況在兩組間差異無統計學意義,這與文獻[11]報道相符,但這與Dvorkin等[17]報道HT在腫瘤侵襲性方面存在保護作用存在差異,可能部分歸因于樣本選擇、手術指征、人群種族差異及HT定義的不同。盡管如此,本研究的結果顯示HT的存在對癌的侵襲性生物學行為影響甚小,而相關文獻報道HT所致的更好預后在本研究中很可能與年輕女性患者多見相關。
總之,相比單純的PTC,PTC合并HT的患者傾向于更輕的發病年齡,更多見的女性患者,更常見的甲狀腺癌多發灶,更高的術前TSH水平和B超腫塊邊界不清發生率。更高的甲狀腺癌多灶性發生率使得手術方式也更傾向于選擇甲狀腺全切術。較輕的年齡使得PTC合并HT患者早期診斷和治療的可能性提高,其與女性患者多見在流行病學方面均提示更好的預后。而腫塊邊界不清并不是PTC合并HT的獨立預測因素,故對于HT合并甲狀腺結節的患者,超聲醫師在關于結節惡性風險的評估和診斷方面無需作出特殊的改變。因時間及其他因素限制,本研究未對觀察對象做進一步的術后預后隨訪,關于PTC合并HT的術后復發及生存分析尚需長期隨訪研究。
[1] Dailey ME, Lindsay S, Skahen R. Relation of thyroid neoplasms to Hashimoto disease of the thyroid gland[J]. AMA Arch Surg, 1955, 70(2): 291-297.
[2] 崔文霞, 朱有志, 陳祥錦, 等. 超聲診斷甲狀腺乳頭狀癌并存橋本甲狀腺炎的臨床價值[J]. 中國醫師進修雜志,2012, 35(29): 12-14.
[3] Gul K, Dirikoc A, Kiyak G, et al. The association between thyroid carcinoma and Hashimoto’s thyroiditis: the ultrasonographic and histopathologic characteristics of malignant nodules[J]. Thyroid, 2010, 20(8): 873-878.
[4] Ohmori N, Miyakawa M, Ohmori K, et al. Ultrasonographic findings of papillary thyroid carcinoma with Hashimoto’s thyroiditis[J]. Intern Med, 2007, 46(9): 547-550.
[5] Kebebew E, Treseler PA, Ituarte PH, et al. Coexisting chronic lymphocytic thyroiditis and papillary thyroid cancer revisited[J]. World J Surg, 2001, 25(5): 632-637.
[6] Bindra A, Braunstein GD. Thyroiditis[J]. Am Fam Physician,2006, 73(10): 1769-1776.
[7] Kim KW, Park YJ, Kim EH, et al. Elevated risk of papillary thyroid cancer in Korean patients with Hashimoto’s thyroiditis[J]. Head Neck, 2011, 33(5): 691-695.
[8] 劉友忠, 于洋, 趙翠, 等. 甲狀腺乳頭狀癌合并橋本甲狀腺炎的臨床生物學特性分析[J]. 中華普通外科雜志, 2013,28(4): 256-258.
[9] Yoon YH, Kim HJ, Lee JW, et al. The clinicopathologic differences in papillary thyroid carcinoma with or without co-existing chronic lymphocytic thyroiditis[J]. Eur Arch Otorhinolaryngol, 2012, 269(3): 1013-1017.
[10]Baek SK, Jung KY, Kang SM, et al. Clinical risk factors associated with cervical lymph node recurrence in papillary thyroid carcinoma[J]. Thyroid, 2010, 20(2): 147-152.
[11]Del Rio P, Cataldo S, Sommaruga L, et al. The association between papillary carcinoma and chronic lymphocytic thyroiditis: does it modify the prognosis of cancer?[J].Minerva Endocrinol, 2008, 33(1): 1-5.
[12]Sciuto R, Romano L, Rea S, et al. Natural history and clinical outcome of differentiated thyroid carcinoma: a retrospective analysis of 1503 patients treated at a single institution[J]. Ann Oncol, 2009, 20(10): 1728-1735.
[13]Giordano C, Stassi G, De Maria R, et al. Potential involvement of Fas and its ligand in the pathogenesis of Hashimoto’s thyroiditis[J]. Science, 1997, 275(5302): 960-963.
[14]Kimura H, Yamashita S, Namba H, et al. Interleukin-1 inhibits human thyroid carcinoma cell growth[J]. J Clin Endocrinol Metab, 1992, 75(2): 596-602.
[15]Kim SK, Song KH, Lim SD, et al. Clinical and pathological features and the BRAF(V600E) mutation in patients with papillary thyroid carcinoma with and without concurrent Hashimoto thyroiditis[J]. Thyroid, 2009, 19(2): 137-141.[16]Huang BY, Hseuh C, Chao TC, et al. Well-differentiated thyroid carcinoma with concomitant Hashimoto’s thyroiditis present with less aggressive clinical stage and low recurrence[J]. Endocr Pathol, 2011, 22(3): 144-149.
[17]Dvorkin S, Robenshtok E, Hirsch D, et al. Differentiated thyroid cancer is associated with less aggressive disease and better outcome in patients with coexisting hashimotos thyroiditis[J]. J Clin Endocrinol Metab, 2013, 98(6): 2409-2414.

