植物抗旱基因HDCS1的克隆和表達(dá)載體的構(gòu)建
張 莉,蘇曼琳
(1.山西農(nóng)業(yè)大學(xué) 農(nóng)學(xué)院, 山西 太谷 030801;2.北京林業(yè)大學(xué) 林學(xué)院,北京 100083)
植物抗旱基因HDCS1的克隆和表達(dá)載體的構(gòu)建
張 莉1,蘇曼琳2
(1.山西農(nóng)業(yè)大學(xué) 農(nóng)學(xué)院, 山西 太谷 030801;2.北京林業(yè)大學(xué) 林學(xué)院,北京 100083)
以二棱大麥幼苗Hordeum distichon Linn.中提取的總RNA為模板,通過RT-PCR的方法獲得與抗旱相關(guān)的轉(zhuǎn)錄因子基因,并將此基因片段用PMD-19T載體進(jìn)行克隆,序列分析得知該目的片段HDCS1長約664 bp,含有一個(gè)完整的閱讀框,其編碼的蛋白質(zhì)屬于LEA蛋白,且HDCS1與Genebank中已報(bào)道的同源蛋白編碼基因HVA1(FJ026803.1)序列相似性為98.64%。以植物表達(dá)載體PBIl21為基礎(chǔ),將HDCS1基因連接于組成型啟動(dòng)子CamV35S和NOS終止子之間,構(gòu)建植物表達(dá)載體PBI121-HDCS1并進(jìn)行PCR和酶切鑒定,為提高植物抗旱性研究奠定了基礎(chǔ)。
植物抗旱基因(HDCS1);基因克隆;表達(dá)載體
干旱是影響植物正常生長發(fā)育的一個(gè)最重要的逆境因子,有關(guān)植物抗旱性能以及植物與干旱脅迫之間關(guān)系的研究一直受到人們的關(guān)注[1-2]。隨著現(xiàn)代分子生物學(xué)與生物技術(shù)的發(fā)展,人們已經(jīng)能夠從分子水平上研究植物抗旱性能的機(jī)制。干旱脅迫會(huì)引起植物細(xì)胞脫水,從而誘導(dǎo)植物體內(nèi)多種抗性基因的表達(dá)。植物的抗旱性是一個(gè)復(fù)雜的多基因控制系統(tǒng)[3-5],抗旱的轉(zhuǎn)錄因子可以調(diào)控一系列抗旱相關(guān)基因的表達(dá),是一種十分有效的提高耐旱性的途徑。目前,已有研究從各種植物中發(fā)現(xiàn)和鑒定了幾十種與抗旱性相關(guān)的功能基因[6]。將這些基因轉(zhuǎn)入植物,對(duì)抗旱性都有了不同程度的提高。這些抗旱相關(guān)功能基因的發(fā)現(xiàn),為人們通過抗旱基因工程改良植物的抗旱性開辟了新的途徑。
HDCS1基因最早是從二棱大麥中發(fā)現(xiàn)的抗旱基因,它與大麥中的一個(gè)抗旱基因HVA1具有高度的同源性[7],但是關(guān)于它的系統(tǒng)研究還未見報(bào)道。本研究在此背景下,選擇對(duì)抗旱基因HDCS1進(jìn)行克隆,并構(gòu)建了HDCS1的植物表達(dá)載體,為進(jìn)一步利用抗旱基因HDCS1的優(yōu)異性能及價(jià)值并為下一步進(jìn)行該抗旱基因的轉(zhuǎn)化提供了前提條件。
1 材料和方法
1.1 材料
1.1.1 植物材料
二棱大麥Hordeum distichon Linn.,種子先用自來水浸泡12 h,發(fā)芽后備用;
1.1.2 菌株和質(zhì)粒
大腸桿菌菌株DH5α,質(zhì)粒PBIl21載體及載體PMD-l9T均購自大連TaKaRa生物工程有限公司。
1.1.3 酶及主要試劑
DNA限制性內(nèi)切酶、T4DNA連接酶;RNA抽提試劑盒、RT-PCR反轉(zhuǎn)錄試劑盒、小量瓊脂糖凝膠回收試劑盒、酵母質(zhì)粒小量提取試劑盒,均購自大連TaKaRa生物工程有限公司;DMSO等其他常規(guī)生化試劑均為國產(chǎn)分析純。
1.2 方法
1.2.1 二棱大麥的培養(yǎng)
二棱大麥的種子先用水浸泡12 h,然后用0.1 mmol/L的ABA澆灌幼苗,生長24 h后用DEPC水反復(fù)沖洗,然后用滅菌濾紙吸去表面水滴,稱取0.8 g莖葉組織備用;
1.2.2 RNA的提取和cDNA的克隆
采用Trizol試劑盒從二棱大麥的莖葉組織中提取總RNA,然后用反轉(zhuǎn)錄試劑盒合成cDNA第一條鏈。根據(jù)HVA1cDNA序列合成一對(duì)引物:
P1上游引物:5’-CGTGAGACGAAGATGG CCTCCAACC-3’
P2下游引物:5’-AAACACGACTAAAGGA ACGG-3’
通過隨機(jī)引物反轉(zhuǎn)錄合成cDNA第一鏈后,建立如下體系進(jìn)行PCR反應(yīng):
200 μL EP 管中分別加入 2.5 μL cDNA 第一模板鏈、5 μL dNTPs、2.5 μL 反應(yīng)緩沖液、2 μL DMSO、各1 μL的上、下游引物(15 pmol),最后加入加ddH2O使反應(yīng)液總體積為25 μL;
進(jìn)行PCR反應(yīng)時(shí)的程序設(shè)定如下:先95℃變形10 min,加入1 μL Taq DNA聚合酶,然后按94℃ 1 min、55℃ 53℃各 40 s、72℃延伸 90 s,共進(jìn)行35次循環(huán)。所得的PCR擴(kuò)增產(chǎn)物經(jīng)電泳和紫外分析鑒定后,用小量瓊脂糖凝膠回收試劑盒回收所需目的片段。
1.2.3 反轉(zhuǎn)錄產(chǎn)物的克隆與測(cè)序分析
反轉(zhuǎn)錄產(chǎn)物經(jīng)瓊脂糖凝膠電泳分離并回收后,HDCS1基因片斷首先在T4連接酶的作用下與載體PMDTM-l9T連接,然后將該連接產(chǎn)物轉(zhuǎn)化已經(jīng)準(zhǔn)備好的大腸桿菌DH5α感受態(tài)細(xì)胞。通過藍(lán)白斑篩選后,用PCR的方法篩選以獲得陽性克隆,經(jīng)鑒定后命名陽性克隆重組子為PMD-HDCS1,由上海生工工程有限公司測(cè)序。
1.2.4 植物表達(dá)載體PBI121-HDCS1的構(gòu)建
1.2.4.1 目的片段的修飾
將 2 μL 重 組 克 隆 質(zhì) 粒 PMD-HDCS1、2 μL Multi-core buffer、1 μL NcoI 和 15 μL ddH2O 組成的反應(yīng)體系于37℃溫浴1 h;經(jīng)電泳檢查消化完全后,加入 1 μL dNTPs、1 μL 大腸桿菌聚合酶ⅠKlenow片段,37℃溫浴20 min后再于75℃水浴10 min;降至室溫后加入1 μL SacⅠ,37℃溫浴1 h。采用低熔點(diǎn)瓊脂糖凝膠電泳回收目的片段。
1.2.4.2 PBI 121 的酶切處理
取 2 μg PBI121、2 μL Multi-core buffer和 1 μL SamI 混勻后于25℃溫浴70 min,經(jīng)電泳檢測(cè)酶切完全后加入1 μL SacⅠ,37℃溫浴1 h。采用低熔點(diǎn)瓊脂糖凝膠電泳回收目的片段。
1.2.4.3 植物表達(dá)載體的構(gòu)建和檢測(cè)
將以上2種處理好的回收產(chǎn)物在T4連接酶作用下進(jìn)行連接并用連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5 α感受態(tài)細(xì)胞,然后用40 mg/L 卡那霉素的LB平板培養(yǎng)篩選單菌落。挑選轉(zhuǎn)化后形成的單菌落,用小量提取試劑盒小量提取質(zhì)粒,用BarnH I和Sac I雙酶切方法鑒定陽性克隆,并將最終獲得的HDCS1基因的重組子命名為PBI121-HDCS1。
2 結(jié)果與分析
2.1 二棱大麥HDCS1基因的cDNA的RT-PCR擴(kuò)增
提取總RNA之后,經(jīng)分光光度計(jì)和凝膠電泳分析,提取的總RNA純度較高而且沒有發(fā)生嚴(yán)重降解。根據(jù)大麥相似基因HVA1cDNA序列合成的引物,PCR反應(yīng)后得到一段長約700 bp的DNA片段,如圖1所示。如圖1所示。
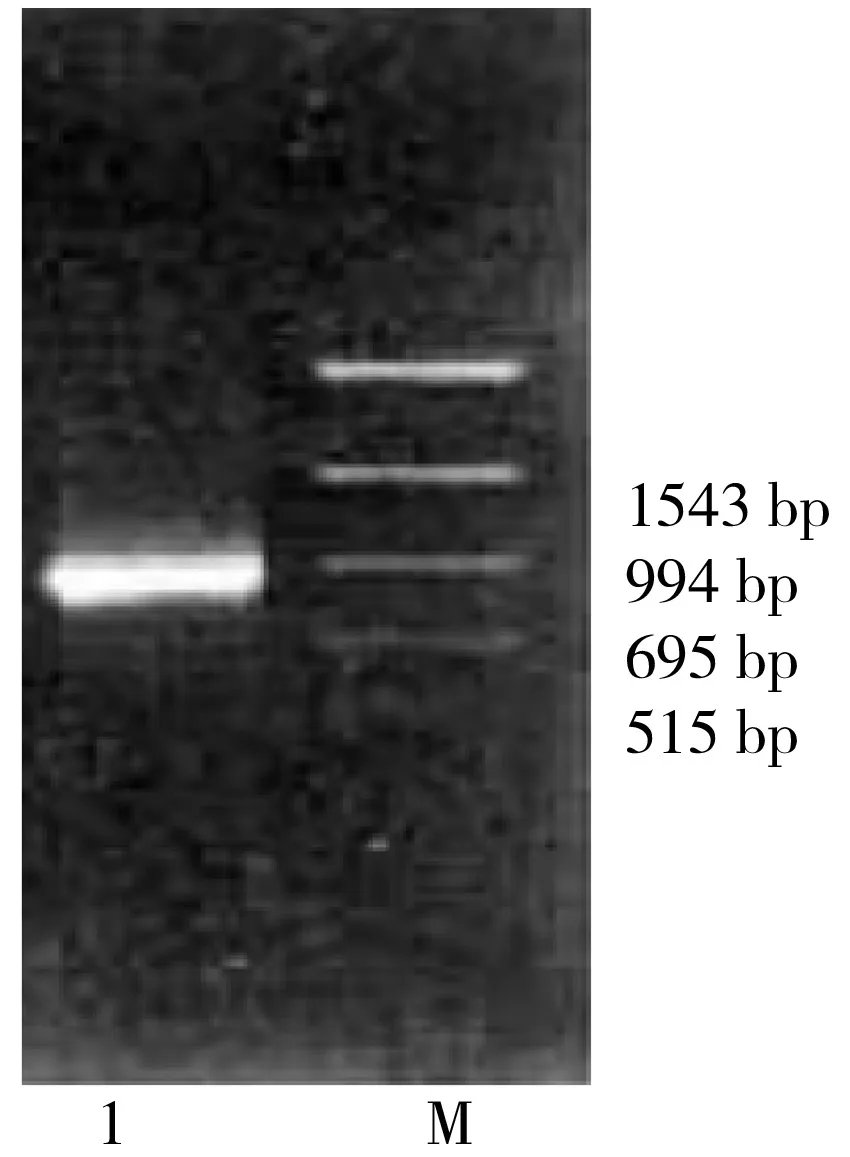
圖1 RT-PCR產(chǎn)物瓊脂糖凝膠電泳結(jié)果Fig. 1 RT-PCR product by agarose gel electrophoresis
2.2 目的基因片段的克隆與測(cè)序
RT-PCR產(chǎn)物切膠回收后,將目的片段連接到PMDTM-l9T載體上,以重組質(zhì)粒PMD-HDCS1為模板,以HDCS1的特異性序列為引物經(jīng)PCR擴(kuò)增可得一條長約700 bp的片段,表明PMDHDCS1中存完整的HDCS1片段。經(jīng)過測(cè)序,發(fā)現(xiàn)其與Genebank中報(bào)道的大麥HVA1基因的cDNA序列同源性為98.64%。
重組質(zhì)粒PMD-HDCS1酶切鑒定結(jié)果如下:

圖2 HDCS1序列基因測(cè)序結(jié)果Fig. 2 HDCS1 gene sequence results by sequencing analysis
2.3 構(gòu)建植物表達(dá)載體PBI121- HDCS1
選擇常用的植物表達(dá)載體PBI121,首先用Sma Ⅰ和Sac Ⅰ切除其GUS基因,然后用已獲得的HDCS1基因的cDNA片段進(jìn)行替換,最終構(gòu)建出一個(gè)以CaMV35S啟動(dòng)子調(diào)控的HDCS1基因的植物表達(dá)載體 PBI121- HDCS1,酶切鑒定如圖3。

圖3 植物表達(dá)載體PBI121- HDCS1的酶切鑒定結(jié)果Fig. 3 Identification of PBI121- HDCS1 by restriction enzymes digestion注:其中1,2,3,M分別代表λDNA/HindⅢMarker,PBI121- HDCS1的酶切產(chǎn)物,PCR產(chǎn)物和PCR Marker。
3 討 論
植物抗旱性屬多基因控制的數(shù)量性狀,通過常規(guī)育種方法改良作物抗旱性的效果往往不理想。借助基因組學(xué)和分子生物學(xué)技術(shù),發(fā)掘、研究和利用植物抗旱相關(guān)基因是提高植物抗旱性的有效途徑。目前越來越多的研究的關(guān)注將相關(guān)抗旱基因及通過構(gòu)建表達(dá)載體載入來發(fā)揮其抗旱功能。
HDCS1是二棱大麥中編碼豐富蛋白(LEA蛋白)的一個(gè)基因,而LEA蛋白可以再大麥胚胎發(fā)生后期形成脫水保護(hù),因此能夠在干旱脅迫時(shí)保護(hù)生物大分子,因而HDCS1基因的表達(dá)可以提高植物的抗旱性能[8-9]。大麥和二棱大麥?zhǔn)峭瑢俚慕壷参铮麄兊腖EA編碼基因幾乎相同。本實(shí)驗(yàn)也證實(shí),HDCS1與大麥的LEA蛋白編碼基因HVA1的序列同源性為98.64%,有研究表明這種差異是因?yàn)镠DCS1比HVA1少1個(gè)含有11個(gè)氨基酸殘基的基元序列。也有研究顯示,由11個(gè)氨基酸構(gòu)成的基元序列來編碼LEA蛋白是一種共性,該基元序列是中性的,成α-螺旋結(jié)構(gòu),而這也可能是LEA蛋白高級(jí)結(jié)構(gòu)的基因基礎(chǔ)[8]。本研究克隆了HDCS1基因并構(gòu)建了其植物表達(dá)載體PBI121- HDCS1,為進(jìn)一步進(jìn)行抗旱基因的轉(zhuǎn)化奠定了基礎(chǔ),并為相應(yīng)植物的抗旱基因工程研究提供了參考。
[1] Aharoni A, Dixit S, Jetter R, et a1. The SHINE clade of AP2 domain transcription factors activates wax biosynthesis, alters cuticle properties, and confers drought tolerance when over expressed in Arabidopsis[J]. Plant Cell, 2004, 16: 2463-2480.
[2] 呂 靜,劉衛(wèi)東,王 麗,等. 4種暖季型草坪草的抗旱性分析[J]. 中南林業(yè)科技大學(xué)學(xué)報(bào),2010, 30(3): 100-104.
[3] Huang B, Jin L, Liu J. Molecular cloning and functional characterization of a DREBI/CBF-like gene (GhDREBIL) from cotton [J]. Science in China Series C: Life Sciences, 2007, 50(1):7-14.
[4] 韓 剛,韓恩賢,李凱榮,等. 油菜素內(nèi)酯對(duì)沙棘抗旱生理的影響[J]. 中南林業(yè)科技大學(xué)學(xué)報(bào),2007, 27(3): 5-9.
[5] Agarwal P, Agarwal P K, Nair S, et a1. Stress inducible DREB2A transcription factor from Pennisetum glaucura is a phosphoprotein and its phosphorylation negatively regulates its DNA binding activity[J]. Molecular Genetics and Genomics,2007, 277(2): 189-198.
[6] 張永恩,李潮海,王 群,等. 植物抗旱相關(guān)功能基因研究進(jìn)展[J]. 中國農(nóng)學(xué)通報(bào),2004, 20(6): 85-88,113.
[7] 郭衛(wèi)東,饒景萍,李嘉瑞,等. 二棱大麥LEA cDNA的克隆與測(cè)序[J]. 西北農(nóng)業(yè)大學(xué)學(xué)報(bào),2000, 28(2): 8-12.
[8] Dure L, Crouch M, Harada J, et al. Common amino acid sequence domains among the LEA proteins of higher plants [J].Plant Molecular Biology, 1989, 12: 475-486.
[9] Hong B, Uknes S J, Ho D T. Cloning and characterization of a cDNA encoding a mRNA rapidly induced by ABA in barley aleurone layers [J]. Plant Molecular Biology, 1988, 11: 495-506.
Cloning of plant drought-tolerant gene HDCS1 and construction of its expression vector
ZHANG Li1, SU Man-lin2
(1.College of Agronomy, Shanxi Agricultural University, Taigu 030801, Shanxi, China;2. Department of Forestry Science, Beijing Forestry University, Beijing 100083, China)
∶ By using the total RNA extracted from the two-rowed barley seedlings Hordeum distichon Linn. as a template, the droughttolerant transcription factor gene was obtained with RT-PCR method. The gene fragments were cloned with the PMD-19T vector.Sequence analysis shows that the target fragment HDCS1 was about 664 bp, containing a complete open reading frame and the encoded protein belongs to the LEA proteins. The sequence similarity between HDCS1 and its homologous gene HVA1 (FJ026803.1,) reported in Genebank was 98.64%. Through plant expression vector PBIl21, HDCS1 genetic was connected between the constitutive promoter of CamV35S and NOS terminator to construct the plant expression carrier PBI121-HDCS1 and PCR, and the restriction endonuclease were used to digest. This study created a laid foundation to improve the drought resistance of plant.
∶ plant drought-tolerant gene (HDCS1); gene cloning; expression vector
S722.3+6
A
1673-923X(2012)06-0115-03
2012-03-22
山西農(nóng)業(yè)大學(xué)科技創(chuàng)新基金項(xiàng)目(2011014)
張 莉(1979—),女,山西襄汾人,博士,講師,主要研究方向:植物抗旱
[本文編校:吳 彬]

