農桿菌介導轉化巨桉Eg5影響因素的研究
郭利軍,曾炳山,劉 英,李湘陽,裘珍飛
(中國林業科學研究院 熱帶林業研究所,廣東 廣州 510520)
農桿菌介導轉化巨桉Eg5影響因素的研究
郭利軍,曾炳山,劉 英,李湘陽,裘珍飛
(中國林業科學研究院 熱帶林業研究所,廣東 廣州 510520)
以巨桉無性系Eg5葉片為外植體材料,以GUS瞬時表達率和瞬時表達率指數作為評價指標,主要探討了預培養時間、菌液濃度、侵染時間、共培養基pH、共培養時間和乙酰丁香酮(Acetosyringone,AS)對遺傳轉化的影響,結果表明預培養3 d、菌液濃度OD600nm為0.5、接種30~60 min、共培養基pH值為5.8~6.0、共培養基中添加150 mg·L-1AS、菌液中不添加AS、共培養1 d遺傳轉化效果最佳,初步建立了巨桉Eg5的遺傳轉化體系。
巨桉;農桿菌;Eg5;遺傳轉化
Eg5是優良的巨桉Euclyptus grandis W.Hill ex Maiden無性系,具有速生、干形通直、分枝角度小、出材率高等特點,在我國江西南部、湖南南部、福建中部等南亞熱帶地區已廣泛栽培,但巨桉Eg5也存在青枯病抗性較低、抗寒能力不足等問題。通過根癌農桿菌介導的遺傳轉化可以將抗病、抗寒等目的基因轉入巨桉基因組中,將大大改善上述不良性狀。本文系統研究了影響農桿菌介導轉化巨桉Eg5的多個因素,旨在建立巨桉的遺傳轉化體系,為巨桉的轉基因育種研究奠定基礎。
1 材料與方法
1.1 試驗材料
以生根培養45 d左右的Eg5無菌生根苗為試驗材料,選取頂端完全展開的1~4片帶葉柄的葉片為外植體,剪去占全葉1/3長度的葉尖部分。
1.2 基本培養基及培養條件
農桿菌培養基為LB培養基,pH 7.0;預培養和共培養培養基為改良MS+TDZ0.12 mg·L-1+NAA0.25 mg·L-1+蔗糖30 g·L-1+瓊脂6 g·L-1,pH 5.8;培養基在0.11 MPa壓力下,121℃滅菌17 min后冷卻待用。
1.3 農桿菌菌株及質粒
菌株為華南農業大學提供的農桿菌菌株GV3101含有載體質粒pBI121,該質粒攜帶有CaMV35S啟動子、NOS終止子、NPTⅡ基因和GUS基因。
1.4 農桿菌工程菌液的制備
取-75℃凍存的根癌農桿菌菌株GV3101,在冰上解凍后劃平板活化培養3 d。挑取單菌落于4 ml液體LB培養基中180 rpm過夜培養,當菌液OD600nm值達到0.2后,按照1∶40比例接入新鮮LB液體培養基,培養至所需OD600nm值,4 000 rpm離心8 min,再用等量的液體再生培養基重懸菌體備用。
1.3 試驗方法
1.3.1 基本轉化條件
農桿菌采用GV3101,將修剪好的葉片外植體于黑暗條件下預培養3 d,菌液濃度OD600nm值0.5時侵染10 min,取出外植體于黑暗條件下共培養2 d。采用逐步優化的方法進行試驗,每一步驟得到的結果將應用到下一步的轉化實驗中[1]。
1.3.2 轉化條件的優化
預培養時間試驗設置為0、3、6、9、12、15 d 6種處理;菌液濃度試驗設置OD600nm值0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 共 8 種 處理;接種時間試驗設置為10、20、30、40、50、60 min 6 種處理;共培養基pH值試驗設置為5.0、5.2、5.4、5.6、5.8、6.0、6.2共7種處理;菌液中添加乙酰丁香酮試驗設置為:0、45、90、135、180 mg·L-1共5種處理;共培養基中添加乙酰丁香酮試驗設置為:0、50、100、150、200 mg·L-1共5種處理。
1.3.3 試驗重復
所有試驗每處理重復3次,每個重復外植體20~30個。
1.3.4 GUS染色分析
參照Jefferson R.A的GUS組織化學染色法[2],共培養結束后對葉片外植體進行GUS染色。
1.3.5 轉化效果評價指標
轉化效果的評價指標為葉柄GUS瞬時表達率和瞬時表達率指數。
GUS瞬時表達率是指葉柄有GUS藍斑的外植體占總外植體數的百分率,GUS瞬時表達率=
瞬時表達率指數指葉柄經農桿菌侵染后整個葉柄被染色面積大小的程度,瞬時表達率指數采用分級計數法,瞬時表達率指數=
各字母代表數值見表1,分級計數法具體內容可參見方中達植病研究方法一書[3]。

表1 巨桉Eg5葉柄侵染效果分級Table 1 Grading of infection effect on petiole of E.grandis clone Eg5
1.3.6 統計分析
所有百分數經平方根反正弦化ASIN(SQRT(X))、個數經平方根轉化SQRT(X),采用SPSS13.0分析軟件進行方差分析(ANOVA)和Duncan多重比較(p=0.05)。文中數據為未轉化數據均值。
2 結果與分析
2.1 預培養時間
預培養時間是農桿菌介導的遺傳轉化實驗中一個重要的影響因素,侵染前外植體一般要經過一段時間的預培養以促進外植體細胞分裂,使受體細胞處于更容易整合外源DNA的狀態,從而提高遺傳轉化效率[4]。表2的多重比較結果顯示,隨著預培養時間的增加,GUS瞬時表達率和瞬時表達率指數均呈現先增大后減小的趨勢,預培養0 d和3 d,GUS瞬時表達率維持在40%左右,達到了最高水平;預培養3 d,葉片外植體進入了最佳的脫分化時間,瞬時表達率指數達到31%,染色效果最佳,顯著優于其它水平;超過3 d后,葉片外植體則由脫分化狀態進入了分化狀態,妨礙了外源基因的整合,所以對于Eg5葉片外植體來說最佳的預培養時間為3 d。

表2 預培養時間對遺傳轉化的影響?Table 2 Effects of different pre-culture time on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.2 菌液光密度
光密度值是衡量農桿菌菌液濃度的最好指標[5],通常以600 nm處菌液的可見光光度值OD600nm代表菌液的濃度進行農桿菌侵染實驗。由表3可知,隨著菌液光密度的逐漸增大,GUS瞬時表達率和瞬時表達率指數均呈現先增大后降低的趨勢。OD600nm為0.1時,由于細菌數量不足,葉柄部位GUS基因GUS瞬時表達率為0;OD600nm在0.2~0.4時,GUS瞬時表達率維持12.22%~13.33%之間,瞬時表達率指數維持在0.04和0.05之間;當OD600nm達到0.5時,葉柄Gus瞬時表達率和瞬時表達率指數增加到了33.67%和0.11,達到了最大值,顯著優于其它處理;OD600nm大于0.5時,GUS瞬時表達率和瞬時表達率指數則逐漸下降。因此,適宜轉化材料的菌液光密度值OD600nm應以0.5為最佳。

表3 菌液濃度對遺傳轉化的影響?Table 3 Effects of different bacterial concentration on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.3 侵染時間
侵染時間是農桿菌介導的遺傳轉化實驗中非常重要的影響因素[6],侵染時間10~20 min時,GUS瞬時表達率和瞬時表達率指數維持在20%和0.1左右,未顯著提高染色效果;侵染時間達到30~60 min時,GUS瞬時表達率和瞬時表達率指數與10~20 min相比獲得了明顯提升,此時間范圍兩指標沒有明顯差異,但以侵染時間60 min的兩指標為最高,葉柄GUS瞬時表達率達到51.89%,瞬時表達率指數達到0.25,所以農桿菌GV3101的侵染時間為30~60 min為宜,且以60 min為最佳。筆者進行抗生素抑菌實驗中發現,葉片外植體經過500 mg·L-1Cef處理后,置于100 mg·L-1Cef培養基中便可以抑制農桿菌的生長,侵染60 min不會造成后期農桿菌的過度繁殖[7]。

表4 侵染時間對遺傳轉化的影響?Table 4 Effects of different infection time on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.4 共培養pH
低于6.0的pH可以活化農桿菌的Vir區,從而增強遺傳轉化效果,pH降至5.1~5.8將使Vir區基因的誘導將達到最高水平[8]。表5顯示隨著pH的升高,葉柄GUS瞬時表達率和瞬時表達率指數呈現先升高后降低的趨勢。pH為5.2時GUS瞬時表達率和瞬時表達率指數最低,5.4~6.2各個水平間GUS瞬時表達率和瞬時表達率指數無顯著差異,當pH維持在5.8~6.0時,GUS瞬時表達率和染色效果達到最高值,所以適宜GV3101轉化葉柄的共培養pH應維持在5.8~6.0之間。

表5 共培養pH值對遺傳轉化的影響?Table 5 Effects of different Co-culture pH on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.5 共培養時間
農桿菌附著、T-DNA的轉移及整合都在共培養時期內完成,共培養時間是決定轉化能否成功的關鍵[8],國內外研究也表明共培養時間是影響遺傳轉化的重要參數[9-10]。多重比較分析表明(表6),共培養時間1 d時GUS瞬時表達率和瞬時表達率指數均達到最大值,且與2、3、4、5 d存在顯著差異,而共培養2、3、4、5 d各處理間沒有顯著差異,所以最佳共培養時間為1 d。隨著共培養時間的延長,筆者也發現葉片外植體褐化率逐漸增大,所以較短的共培養時間既能減少農桿菌的過度繁殖還可以提高遺傳轉化的效率。
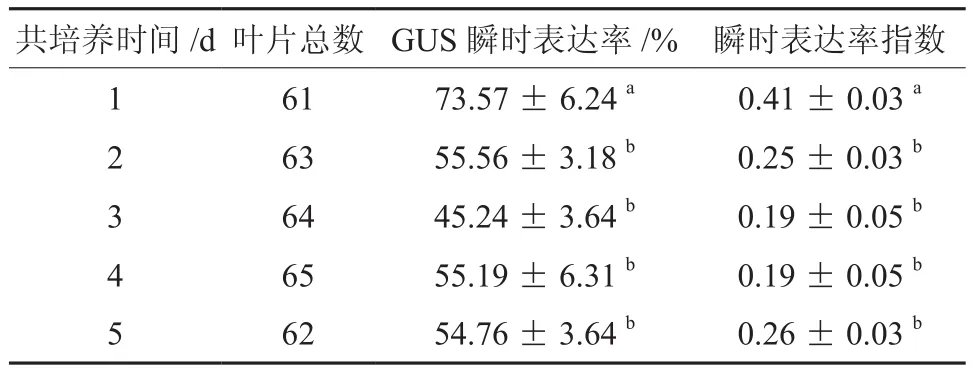
表6 共培養時間對遺傳轉化的影響?Table 6 Effect of Co-culture time on the agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.6 乙酰丁香酮的添加試驗
乙酰丁香酮作為農桿菌Vir區基因活化的誘導物被廣泛應用于農桿菌介導的遺傳轉化研究工作中。許多研究表明不同的乙酰丁香酮添加方式對于遺傳轉化效率的提高至關重要[11-13]。
2.6.1 菌液中添加乙酰丁香酮
本研究表明,菌液中添加乙酰丁香酮并未顯著提高GUS瞬時表達率和瞬時表達率指數。表7的多重比較表明雖然GUS瞬時表達率隨AS添加濃度的增大有逐漸增大的趨勢,但是各處理間的GUS瞬時表達率和瞬時表達率指數的差異未達到顯著差異的水平;菌液中添加乙酰丁香酮并沒有顯著改善農桿菌的侵染力,相反隨著GUS瞬時表達率的變大,葉柄瞬時表達率指數沒有明顯變化,卻使得葉柄的相對染色效果變差,對遺傳轉化造成了不利影響。

表7 菌液中添加乙酰丁香酮對遺傳轉化的影響?Table 7 Effects of different AS concentration in bacterium liquid on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.6.2 共培養基中添加乙酰丁香酮
與對照相比,共培養基中添加乙酰丁香酮極大提高了葉柄的GUS瞬時表達率和瞬時表達率指數。表8顯示共培養基中添加50~200 mg·L-1的乙酰丁香酮與對照相比,顯著改善了葉柄GUS瞬時表達率,其中以添加100~200 mg·L-1的乙酰丁香酮使葉柄瞬時表達率指數達到最佳,添加150 mg·L-1的乙酰丁香酮時瞬時表達率指數達到最高。

表8 共培養基中添加乙酰丁香酮對遺傳轉化的影響?Table 8 Effects of different AS concentration in medium on agrobacterium mediated genetic transformation of E.grandis clone Eg5
3 結論與討論
本研究首次提出采用瞬時表達率指數作為評價轉化效果的一項指標,目前,國內外研究多采用瞬時表達率作為單一的評價指標,但瞬時表達率存在不能確切表示出葉柄染色程度的不足,瞬時表達率指數的提出很大程度上彌補了單一采用瞬時轉化率的不足,使轉化評價體系更為精確合理。目前有關巨桉遺傳轉化的研究在國內還未見報道,國際上也只有Yao J L等關于LBA4404介導巨桉的報道,其轉化研究僅局限于莖段再生階段抗生素敏感性和菌液濃度兩方面[14],本研究初步建立了農桿菌GV310介導巨桉Eg5葉片外植體的遺傳轉化體系,對影響巨桉Eg5遺傳轉化的因素預培養時間、菌液濃度、侵染時間、共培養pH值、共培養時間和乙酰丁香酮等一系列因素進行了全面報道。
3.1 預培養時間對遺傳轉化的影響
農桿菌侵染外植體前一般要經過一段時間的預培養使外植體細胞處于最佳的分裂狀態,以更好地接受外源基因的整合,許多研究也表明預培養對于遺傳轉化的重要性[15-21]。桉屬植物的農桿菌轉化研究表明預培養時間大多維持在2~3 d[15-18,21],本研究也表明巨桉Eg5葉片外植體的最佳預培養時間為3 d,楊樹屬植物的農桿菌轉化研究預培養時間一般在0~1 d[19,22],席夢利等確定了杉木的最佳預培養時間為1~3 d[20],柚木的農桿菌遺傳轉化研究表明最佳的預培養時間為11~15 d[23],由以上可知不同的樹種預培養時間存在一定的差異,可能是不同樹種在不同的誘導培養基上進入最佳脫分化狀態的時間不同所致,所以預培養時間的確定關鍵在于使外植體細胞處于最佳的脫分化狀態,否則,則會由脫分化狀態進入分化狀態,從而妨礙外源基因的整合,對遺傳轉化造成不利影響。
3.2 菌液光密度與侵染時間對遺傳轉化的影響
菌液光密度和侵染時間是農桿菌介導的遺傳轉化的重要影響因素。本研究表明采用GV3101菌液OD600nm值0.5侵染巨桉Eg5葉片30~60 min瞬時染色效果最佳,這與桉樹屬植物多采用OD600nm值0.5以上的較濃菌液處理外植體10~30 min[14,17-18,21]的結果相一致,楊樹屬多采用OD600nm值0.2~0.4較稀菌液處理外植體10~20 min[19,22,24-25],小麥的遺傳轉化研究中,采用OD600nm值1.0以上菌液侵染1 h以上,方能達到較好的轉化效果[26-28]。以上表明不同植物的最佳農桿菌菌液OD600nm值及侵染時間不盡相同,相對楊屬樹種,這說明桉屬樹種對農桿菌不太敏感,小麥由于是單子葉植物對農桿菌最不敏感,桉屬樹種的轉化仍需要用相對較高的菌液濃度處理一定時間才能達到較好的效果。
3.3 添加乙酰丁香酮對遺傳轉化的影響
本文中研究了菌液中添加乙酰丁香酮和培養基中添加乙酰丁香酮兩種添加方式對遺傳轉化的影響。很多研究表明菌液中添加乙酰丁香酮并不能顯著改善遺傳轉化效果,甚至會降低遺傳轉化率[19,29-31],本研究也得出了同上述研究相一致的結論,對于沒能提高轉化率,分析可能有以下原因:一是乙酰丁香酮加入菌液時間不當,有研究認為在工程菌液使用前4~6 h加入,也有研究主張在制備好工程菌液后加入并放置一定時間之后再用于侵染,使農桿菌既處于對數生長期,又處于Vir基因高度活化狀態[8]。二是由于乙酰丁香酮需要加入有毒的二甲基亞砜溶解,二甲基亞砜的加入可能在一定程度上抑制了農桿菌的侵染活力,使農桿菌受到了毒害。三是加入的乙酰丁香酮濃度與工程菌液濃度之間存在一定協同效應,菌液濃度過高,加入一定乙酰丁香酮則不能使遺傳轉化率提高,菌液濃度得到稀釋后,加入乙酰丁香酮則可顯著提高遺傳轉化率[11]。
本研究表明共培養基中添加150 mg·L-1乙酰丁香酮則大大提高了遺傳轉化率,許多研究也表明了共培養基中添加乙酰丁香酮對于遺傳轉化的積極作用[11,12,32]。由于共培養階段是轉化的最關鍵階段,共培養時期添加乙酰丁香酮酚類物質促進了農桿菌Vir區基因的表達和外源基因的整合,使遺傳轉化率獲得了大大提高。但也有研究認為乙酰丁香酮與培養基pH值存在協調效應,一定pH值條件下乙酰丁香酮才可以更好發揮其高效作用[12,33]。所以乙酰丁香酮與培養基pH值的交互作用還有待進一步研究。
3.4 因素優化順序
研究采用單因素逐步優化法建立巨桉Eg5的轉化體系,一些實驗數據存在后期優化結果低于前期優化結果的問題,究其原因,可以從以下方面解釋:一是提供葉片外植體的幼苗生理狀態較差,某一批次的葉片外植體生長時間過長造成后期優化結果較低。Tournier, V等[34]和Aggarwal, D等[35]曾報道幼嫩組織的遺傳轉化率和器官發生率均較高。二是活化的不同批次的農桿菌之間可能存在侵染活力的差異。三是不同批次的GUS染色液其染色效果可能也存在一定差異。
[1] 范春節. 尾赤桉再生體系及農桿菌介導的轉基因體系研究[D]. 北京:中國林業科學研究院學位論文,2008.
[2] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: betaglucuronidase as a sensitive and versatile gene fusion marker in higher plants.[J]. The EMBO journal, 1987,6(13):3901-3907.
[3] 方中達. 植病研究方法[M]. 農業出版社,1979.
[4] 唐克軒,張獻龍. 植物生物技術[M]. 科學出版社,2004.
[5] Sharma M, Kothari-Chajer A, Jagga-Chugh S, et al. Factors influencing Agrobacterium tumefaciens-mediated genetic transformation of Eleusine coracana (L.) Gaertn[J]. Plant Cell,Tissue and Organ Culture, 2011,105(1): 93-104.
[6] 楊 波,丁莉萍,姚 璐,等. 苗齡和農桿菌侵染時間對小麥莖尖轉化效率的影響(英文)[J]. 分子植物育種,2008,6(2):358-362.
[7] 郭利軍,曾炳山,劉 英,等. 巨桉無性系Eg5的卡那霉素和頭孢霉素敏感性研究[J]. 中南林業科技大學學報,2012,32(3): 75-80.
[8] 王關林, 方宏筠. 植物基因工程[M]. 科學出版社,2002.
[9] Dutt M, Grosser J. Evaluation of parameters affecting Agrobacterium-mediated transformation of citrus[J]. Plant Cell,Tissue and Organ Culture, 2009,98(3):331-340.
[10] 賴家業,石海明,劉 凱,等. 尾巨桉遺傳轉化系統建立的研究[J]. 四川大學學報:自然科學版,2007, 44(2): 415-419.
[11] Huang F H, Li X Y. Effects of concentration of vacetosyringone and Agrobacterium tumefaciens on Gus gene transformation efficiency of Populus[J]. In Vitro Cell Dev Biol, 1994,30(3): 67.
[12] Godwin I, Todd G, Ford-Lloyd B, et al. The effects of acetosyringone and pH on Agrobacterium-mediated transformation vary according to plant species[J]. Plant Cell Reports, 1991,9(12):671-675.
[13] 陳 志, 陳金慧, 李婷婷, 等. 雜交鵝掌楸轉雙價抗病基因影響因子研究[J]. 分子植物育種,2007,5(4):588-592.
[14] Yao J L, Lin-Wang K. Eucalyptus transformation method[Z].WO Patent WO/2005/032,241, 2005.
[15] Ho C K, Chang S H, Tsay J Y, et al. Agrobacterium tumefaciensmediated transformation of Eucalyptus camaldulensis and production of transgenic plants[J]. Plant Cell Reports,1998,17(9): 675-680.
[16] Prakash M, Gurumurthi K. Genetic transformation and regeneration of transgenic plants from precultured cotyledon and hypocotyl explants of Eucalyptus tereticornis Sm.using Agrobacterium tumefaciens[J]. In Vitro Cellular &Developmental Biology - Plant, 2009,45(4):429-434.
[17] Aggarwal D, Kumar A, Sudhakara Reddy M. Agrobacterium tumefaciens mediated genetic transformation of selected elite clone(s) of Eucalyptus tereticornis[J]. Acta Physiologiae Plantarum, 2011,33(5):1603-1611.
[18] Da Silva A L L, de Oliveira Y, Da Luz Costa J. Preliminary results for genetic transformation of shoot tip of Eucalyptus saligna Sm. via Agrobacterium tumefaciens[J]. Journal of Biotechnology and Biodiversity, 2011,2(1):1-6.
[19] 諸葛強, 王婕琛, 陳 英, 等. 新疆楊高效遺傳轉化系統的建立[J]. 植物資源與環境學報,2003,12(4):6-10.
[20] 席夢利, 施季森. 不同因素對農桿菌介導的杉木轉化效率的影響[J]. 林業科學,2007,43(3):46-50.
[21] Alcantara G B D, Bespalhok Filho J C, Quoirin M.Organogenesis and transient genetic transformation of the hybrid Eucalyptus grandis × Eucalyptus urophylla [J]. Scientia Agricola, 2011,68:246-251.
[22] Confalonieri M, Balestrazzi A, Bisoffi S. Genetic transformation of Populus nigra by Agrobacterium tumefaciens[J]. Plant Cell Reports, 1994,13(5):256-261.
[23] 曾炳山, 裘珍飛, 李湘陽, 等. 柚木愈傷組織的LBA 4404轉化條件[J]. 中南林業科技大學學報,2008, 28(3): 60-64.
[24] Liu T, Pang X, Long C, et al. Successful Agrobacteriummediated transformation of Populus tomentosa with apple SPDS gene[J]. Forestry Studies in China, 2008, 10(3): 153-157.
[25] 郝貴霞, 朱 禎, 朱之悌. 毛白楊遺傳轉化系統優化的研究[J]. 植物學報,1999,41(9): 936-940.
[26] Cheng M, Fry J E, Pang S, et al. Genetic transformation of wheat mediated by Agrobacterium tumefaciens[J]. Plant Physiology,1997,115(3):971-980.
[27] 王永勤, 張愛民. 農桿菌介導的小麥遺傳轉化幾個影響因素的研究[J]. 遺傳學報,2002,29(003):260-265.
[28] 張志清, 鄭有良, 王丕武, 等. 農桿菌介導轉化小麥幾個影響因素的再研究[J]. 四川農業大學學報,2006, 24(1):1-6.
[29] 劉小琳, 王繼峰, 胡曉艷, 等. 根癌農桿菌介導的紫花苜蓿遺傳轉化體系的建立與優化[J]. 中國草地學報,2007, 29(2):102-106.
[30] 鄭樹松, 安成才, 李啟任, 等. 乙酰丁香酮對棉花下胚軸遺傳轉化效率的影響[J]. 棉花學報,2003,15(2):125-126.
[31] 楊秀榮, 陳永文, 方 平, 等. 乙酰丁香酮對根癌農桿菌介導的甘薯遺傳轉化的影響[J]. 西南師范大學學報:自然科學版,2002,27(5):751-754.
[32] 董喜才, 杜建中, 王安樂, 等. 乙酰丁香酮在植物轉基因研究中的作用[J]. 中國農學通報,2011, 32(5): 292-299.
[33] Holford P, Hernandez N, Newbury H J. Factors influencing the efficiency of T-DNA transfer during co-cultivation of Antirrhinum majus with Agrobacterium tumefaciens[J]. Plant Cell Reports, 1992,11(4): 196-199.
[34] Tournier V, Grat S, Marque C, et al. An efficient procedure to stably introduce genes into an economically important pulp tree(Eucalyptus grandis× Eucalyptus urophylla)[J]. Transgenic Research, 2003,12(4): 403-411.
[35] Aggarwal D, Kumar A, Reddy M S. Shoot organogenesis in elite clones of Eucalyptus tereticornis[J]. Plant cell, tissue and organ culture, 2010,102(1): 45-52.
Study on the factors influencing Agrobacterium tumefaciens mediated transformation of Eucalyptus grandis clone Eg5
GUO Li-jun, ZENG Bing-shan, LIU Ying, LI Xiang-yang, QIU Zhen-fei
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, Guangdong, China)
∶ By taking Eucalyptus grandis clone Eg5 leaves as explants, the GUS gene transient expression efficiency and transient expression efficiency index as evaluation indicators, effects of the pre-culture time, bacterial concentration, infection time, co-culture pH, co-culture time,Acetosyringone(AS)concentration in the bacterium liquid and Acetosyringone concentration in the medium on genetic transformation were investigated. The results show that pre-culture 3 days, 0.5 of OD600nm, 30~60 min of infection time, 5.8~6.0 of co-culture pH, 150 mg·L-1AS of the medium, and no AS in the bacterium liquid, 1day of co-culture time, the best transformation effects were achieved. Thus, an effective system for Agrobacterium-mediated transformation of Eucalyptus grandis clone Eg5 was established.
∶ Eucalyptus grandis; Agrobacterium tumefaciens; Eg5; genetic transformation
S792.39;Q943.2
A
1673-923X(2012)06-0061-06
2012-03-09
863高新技術項目“白樺、桉樹等分子育種與品種創制”項目編號(2011AA100202)
郭利軍(1983—),男,河北蠡縣人,碩士研究生,主要從事熱帶林木組培快繁和桉樹轉基因研究
曾炳山(1969—),男,江西井岡山人,博士,研究員,主要從事熱帶林木組培快繁和基因轉化研究
[本文編校:吳 彬]

