紫元益消丸急性毒性實驗研究
趙 晶,謝艷華,賀中民,洪 流,王四旺
紫元益消丸急性毒性實驗研究
趙 晶,謝艷華,賀中民,洪 流,王四旺
目的 觀察紫元益消丸對昆明小鼠和SD大鼠的急性毒性反應,為新藥研發以及臨床用藥提供劑量依據。方法 采用灌胃給藥途徑,測定小鼠和大鼠分別給予紫元益消丸后的半數致死量和最大耐受量,按公斤體質量計算。結果 紫元益消丸急性毒性實驗顯示受試藥物毒性較低,實驗動物全部存活故無法測出半數致死量;小鼠的最大耐受量為24.0 g/kg,大鼠的最大耐受量為16.0 g/kg;各組實驗動物的體質量未見異常(P>0.05)。結論 紫元益消丸按擬定臨床劑量用藥具有安全性。
紫元益消丸;急性毒性;小鼠;大鼠
紫元益消丸是依據第四軍醫大學西京醫院消化內科洪流博士在前人經驗的基礎上,結合多年臨床心得提出的中藥復方制劑,為扶正固本、解毒消腫、化痰散結、活血化瘀的抑瘤藥物。本研究旨在探討紫元益消丸的安全性并對其急性毒性進行評價。
1 材料與方法
1.1 紫元益消丸藥粉 第四軍醫大學藥物研究所制劑室提供,批號20110510。
1.2 實驗動物 二級昆明種小鼠,月齡6~8周齡,體質量18~22 g,雌雄各半;二級SD大鼠,月齡7~8周齡,體質量180~220 g,雌雄各半。所有動物由第四軍醫大學實驗動物研究中心提供,生產合格證號為scxk(軍)字第2007-007號。
1.3 方法
1.3.1 小鼠急性毒性實驗 取18~22 g昆明種小鼠40只,雌雄各半,隨機分為3個給藥組(8.0 g/kg、16.0 g/kg、24.0 g/kg)和對照組(給予生理鹽水)[1]。實驗動物禁水12 h后灌胃給藥(20 mL/kg)。給藥后實驗動物正常飼養,連續觀察14 d,記錄相關指標。①體質量:每天定時稱量存活動物體質量。②毒性反應:根據《中藥、天然藥物毒性研究技術指導原則》,觀察實驗動物的行為活動、精神狀態、被毛、攝食、飲水、呼吸、糞便情況及鼻、眼口腔有無異常分泌物,以及死亡等情況。觀察時間為給藥后0、2、4、8、12、24 h;第2~14天每日觀察1次。在難以測出半數致死量(50%lethal dose,LD50)值時,另取動物20只(雌雄各半),按24.0 g/kg劑量給予小鼠2次/d灌胃,給藥間隔4 h,對照組給予生理鹽水,進行最大耐受劑量(max tolerance dose,MTD)的測定[2]。
1.3.2 大鼠急性毒性實驗 取180~220 g SD大鼠40只,雌雄各半,隨機分為3個給藥組(4.0 g/kg、8.0 g/kg、16.0 g/kg)和對照組(給予生理鹽水)。實驗動物禁水12 h后灌胃給藥,正常飼養,連續觀察14 d,記錄相關指標。①體質量:每天定時對存活動物稱體質量。②毒性反應:根據《中藥、天然藥物毒性研究技術指導原則》,觀察實驗動物的行為活動、精神狀態、被毛、攝食、飲水、呼吸、糞便情況及鼻、眼口腔有無異常分泌物,以及死亡等情況。觀察時間為給藥后0、2、4、8、12、24 h;第 2 ~14 天每日觀察1次。在難以測出LD50值時,另取動物20只(雌雄各半),試藥組按16.0 g/kg劑量給予大鼠,第1天給藥2次,給藥間隔4 h,第2~14天每日觀察1次,對照組給予生理鹽水,進行MTD值的測定。
1.3.3 臟器組織病理學檢查 14 d后處死實驗動物,解剖,肉眼觀察臟器情況;死亡動物應及時進行尸檢,發現病變器官做病理組織學檢查[3]。
1.4 統計學處理 采用SPSS 16.0統計軟件處理,計量資料以均數±標準差(ˉx±s)表示,計量資料組間均數比較采用方差分析,P<0.05為有統計學意義。
2 結果
2.1 小鼠急性毒性實驗 灌胃給予紫元益消丸后,中、高劑量組小鼠均即刻出現短暫的靜臥、呼吸頻次加快等反應,5~10 min后開始逐漸活動,30 min左右主動覓食和飲水,2 h后恢復正常;第2天觀察,小鼠糞便稀薄、不成形,被毛直立無光澤;第4天基本恢復正常。小鼠口鼻無異常分泌物。低劑量組小鼠僅見一過性靜臥、呼吸頻次加快等反應,一般10 min內恢復正常。各組小鼠連續觀察14 d無死亡,實驗動物給藥第1、7、14天的體質量與正常對照組無統計學差異(P<0.05,表1)。

表1 紫元益消丸小鼠急性毒性實驗動物體質量變化情況(ˉx±s,g)
動物觀察14 d后處死,進行體內主要臟器組織病理學檢查,心、肝、脾、肺、腎、胰腺、胃、腸、睪丸、卵巢、腦等臟器大小、顏色、位置等均未見異常。進一步測定小鼠MTD,觀察指標和時限同上,24.0 g/kg紫元益消丸給小鼠灌胃后的反應同前,無死亡。
2.2 大鼠急性毒性實驗 各組大鼠灌胃給予紫元益消丸后,行為表現未見異常反應;第2天發現各劑量組大鼠出現輕度糞便稀薄、黑色,但在第3天恢復。各組動物連續觀察14 d未見異常和死亡,各組實驗動物給藥第1、7、14天的體質量與正常對照組無統計學差異(P>0.05,表2)。14 d后處死動物,進行體內主要臟器組織病理學檢查,心、肝、脾、肺、腎、胰腺、胃、腸、睪丸、卵巢、腦等臟器大小、顏色、位置等均未見異常。進一步測定MTD,即給大鼠灌胃16.0 g/kg,觀察14 d,結果未見動物死亡。
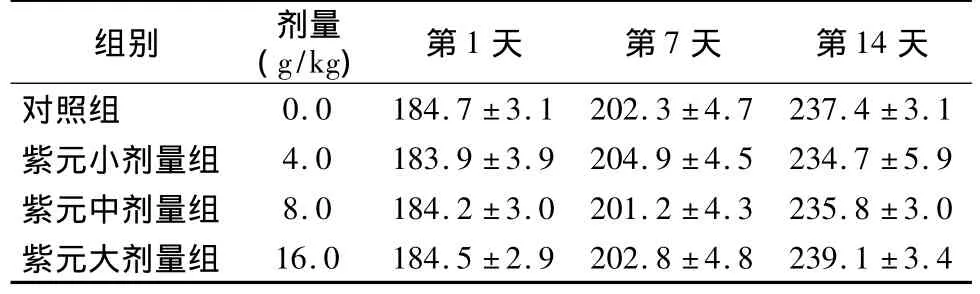
表2 紫元益消丸大鼠急性毒性實驗動物體質量變化情況(ˉx±s,g)
3 討論
紫元益消丸由紫河車、紅花、蟾酥、山慈菇等8味中藥組成,按照扶正固本、消腫散結的中醫治療原則:以紫河車扶正固本為君藥,有溫腎陰補精元、益氣生血等功效;蟾酥、蜈蚣解毒抗癌共為臣藥;山慈菇、制半夏化痰散結,紅花活血化瘀,玄明粉消腫、化瘀共為佐藥;雞內金消食和胃為使藥。全方共奏扶正固本,解毒消腫,化痰散結,活血化瘀之功。
紫元益消丸作為臨床經驗方,成人(按60 kg體質量計算)日用劑量為0.05 g/kg。本試驗給予小鼠日累積劑量為臨床成人擬推薦日用劑量的480倍,給予大鼠日累積劑量為臨床成人擬推薦日用劑量的320倍,實驗結果中未見昆明小鼠和SD大鼠死亡,表明紫氣益消丸按擬定臨床推薦劑量用藥具有安全性。但紫元益消丸灌胃后,中、高劑量組小鼠即刻出現一過性靜臥、呼吸頻次加快等反應;給藥次日可見小鼠、大鼠糞便稀薄。提示紫元益消丸超劑量使用存在誘發不良反應的風險,尤其是中樞神經、呼吸功能及胃腸道刺激等不良反應不容忽視。超劑量所致不良反應的機制,大鼠灌胃給藥后一過性靜臥、呼吸頻次加快等反應不明顯的原因,尚需在后續的大鼠長期毒性實驗研究中證實。
本方劑的前期臨床應用中曾發現個別患者出現輕度胃腸道反應,如惡心、嘔吐、納差等不適,提示在后續長期毒性實驗等藥理毒理學研究中應給予重點關注,并確定有效劑量與不良反應劑量的閾值,以指導本制劑臨床用藥的有效性和安全性[4-5]。
[1]SFDA.中藥、天然藥物急性毒性研究技術指導原則[M].2 版.北京:人民衛生出版社,2005:2-4.
[2]陳奇.中藥藥理研究方法學[M].北京:人民衛生出版社,1993:112.
[3]李中煉,周明,劉昌英,等.“百消散”毒理學實驗觀察[J].江西中醫學院學報,2009,21(6):60-63.
[4]安賓,陳常春,李治建.阿里紅提取物急性毒性實驗研究[J].中國中醫藥科技,2011,18(6):502-503.
[5]阿不都熱依木·玉蘇甫,古孜力努爾·依馬木,麥合素木·艾克木,等.異黑成熟顆粒的急性毒性和長期毒性實驗研究[J].新疆醫科大學學報,2011,34(12):1320-1325.
The experimental study on acute toxicity of ziyuanyixiao pill
ZHAO Jing1,XIE Yan-hua1,HE Zhong-min1,HONG Liu2,WANG Si-wang1
(1.Department of Natural Medicines School of Medicine,Fourth Military Medical University,Xi’an 710032,China;2.Department of Gastroenterology,Xijing Hospital,Fourth Military Medical University,Xi’an 710032,China)
ObjectiveTo study the acute toxicity in mice and rats to evaluate the clinical safety of medication and provide dose basis for development of new drug.MethodsMice and rats were given intragastric administration by the differente dose of the tested drug,the experimental data were calculated LD50 and MTD with the Bliss method,with the continuous administration and observation for 14 days.ResultsThe mice and rats were all survived and LD50 was not measured.The largest amount of drug for mice was 480 times of clinical dose administration,for rats it was 320 times of clinical dose administration.In addition,no histopathological lesions were observed in the animals.ConclusionAcute toxicity in this experiment condition suggested the tested drug have a good clinical safety.
Ziyuanyixiao wan;Acute toxicity;Mice;Rat
R285.5-332
A
2095-3097(2012)01-0006-02
10.3969/j.issn.2095-3097.2012.01.002
710032陜西西安,第四軍醫大學藥學院天然藥物學教研室(趙 晶,謝艷華,賀中民,王四旺),西京醫院消化內科(洪 流)
王四旺,E-mail:wangsiw@fmmu.edu.cn
2012-05-31 本文編輯:馮 博)

