豇豆胰蛋白酶抑制劑不同組分的制備方法
金憲雷,張泉霖,杜林方 ,劉 科
四川大學生命科學學院,成都610064
在正常的細胞代謝中,蛋白酶抑制劑扮演著重要的角色。蛋白酶抑制劑構成了控制蛋白酶活性的最后的調節步驟。在生理調節中,蛋白酶抑制劑和蛋白酶達到一個動態的生物平衡[1,2]。Read 和Haas 第一次證明,豆粉中含有只能抑制胰蛋白酶活性的蛋白(STI)和能同時抑制胰蛋白酶和胰凝乳蛋白酶的蛋白(BBI)[3]。在過去的二十多年間,人們普遍認為,BBI 是一種抗營養的物質。BBI 類的胰蛋白酶抑制劑,會在葉子受傷后表達分泌,是一種天然的抗蟲物質[4],目前已經在轉基因抗蟲領域得到廣泛的應用[5]。近年來,體外實驗已經證實,單獨的BBI 類的胰蛋白酶抑制劑是一種抗癌癥的物質,在納摩爾含量下即起效,并對癌癥細胞有不可逆的作用[6,7]。因此,尋找及利用胰蛋白酶抑制劑是極具研究價值的。豆科(Leguminosae)豇豆屬(Vigna)植物豇豆,是一種優質的蛋白質資源。Sammour 等人證明豇豆中含有四種胰蛋白酶抑制劑(Cowpea trypsin inhibitor,CPTI)[8],本文探討了豇豆中不同組分的制備方法。
1 材料和方法
1.1 材料
豇豆(Vigna unguiculata var.)種子購自市場;中分子量標準蛋白、丙烯酰胺(Acr)為Sigma 產品;牛胰蛋白酶(Bovine Trypsin)、Na-苯甲酰-DL-精氨酸對硝基苯胺鹽酸鹽(BAPAN)、甲叉雙丙烯酰胺(Bis)為Fluka 產品;葡聚糖凝膠(Sephadex G-150)為Phamarcia 公司產品;DEAE-52 纖維素為Whatman 公司產品;Sephacryl s-300 凝膠過濾柱為GE 公司產品;牛血清白蛋白(BSA),為上海麗珠公司產品;其余試劑均為國產分析純。
1.2 方法
1.2.1 豇豆種子胰蛋白酶抑制劑粗品的制備
乙酸鈉抽提法:參照文獻[9]的方法略加改進。取150 g 豇豆種子研碎,用600 mL 無水乙醚于4 ℃分三次攪拌脫脂。自然揮干乙醚后,再用1.5 L 0.2 mol/L 乙酸鈉于4 ℃下分兩次抽提(第一次800 mL,第二次700 mL),每次12h。合并兩次上清液,離心(10 000×g,60 min,4 ℃),棄沉淀;調上清液的pH 至6.0,邊攪拌邊加入固體硫酸銨至50% 飽和度,4 ℃下放置過夜,離心(10 000 × g,25 min,4℃),棄去沉淀。上清液的pH 再調至6.0,邊攪拌邊加入固體硫酸銨至70%飽和度,4 ℃下放置4 h,離心(10 000 ×g,25 min,4 ℃)。沉淀用少量去離子水溶解,對緩沖液A(0.05 mol/L Tris-Hcl,pH 8.0)充分透析,離心(10 000 ×g,15 min,4 ℃)所得上清液,即為抑制劑粗提物。
1.2.2 豇豆種子胰蛋白酶抑制劑的純化
將抑制劑粗提物分批上樣至經緩沖液A 預先平衡的Sephadex G-150 凝膠過濾柱(3. 2 cm ×56 cm,流速20 mL/h),收集活性峰,合并后對緩沖液A充分透析,離心(10 000 ×g,15 min,4 ℃),上樣到預先經緩沖液A 平衡的DEAE-52 離子交換層析柱(1 cm×5 cm,流速20 mL/h),收集穿透峰中的活性物質,并命名為Pool I,再經用含相同緩沖液的0.1~0.5 mol/L NaCl 線性梯度洗脫,收集得到一個活性峰,命名為Pool II。Pool I 經濃縮后,對去離子水充分透析,離心(10000 × g,15 min,4 ℃),然后進行FPLC 純化分析,樣品分批上樣至經0. 1 mol/L NH4HCO3平衡后的Sephacryl S-300 柱,并且用同樣的緩沖液洗脫,洗脫速度為3.9 mL/h,得到兩個活性峰命名為CPTI IA 和CPTI IB。
1.2.3 胰蛋白酶抑制劑活性的測定
1.2.3.1 明膠-PAGE 活性電泳法
按照文獻[9]的方法進行。
1.2.3.2 含SDS 的明膠活性電泳
按照文獻[10]的方法進行
1.2.3.3 BNPAN 法
參照文獻[11]略加改進,取一定量胰蛋白酶分別與不同胰蛋白酶抑制劑制備物混合,于3 mL 酶解緩沖液(含0.01 mol/L CaCl2的0.1 mol/L Tris-HCl,pH 8.0)中37 ℃保溫5 min,加入適量0.025 mol/L BNPAN,37 ℃溫育10 min 后,再加0.5 mL 33% 乙酸終止反應,410 nm 波長處測定光吸收值。每降低0.1 個A410為一個CPTI IB 抑制活性單位(U)。
1.2.4 蛋白質濃度的測定
采用Brandford 法[12]。
2 結果和分析
2.1 豇豆胰蛋白酶抑制劑粗提物制備與凝膠過濾初步分離
豇豆種子經過研磨、乙醚脫脂、乙酸鈉抽提、50%~70%硫酸銨分部鹽析與透析,得到粗提物。經Bradford 法測定,150 g 豇豆種子制備得到的粗提物含有1050 mg 蛋白質,用1.2.3.3 的方法測定,其對胰蛋白酶的抑制比活為50.37 U/mg。樣品粗提液稀釋50 倍和100 倍后進行明膠活性電泳(圖1A)和SDS-PAGE(圖1B)。胰蛋白酶抑制劑會形成自聚體,所以在活性電泳時會形成數量不等的條帶,在圖1A 中我們看到,當蛋白質濃度降低時,自聚體現象減弱。
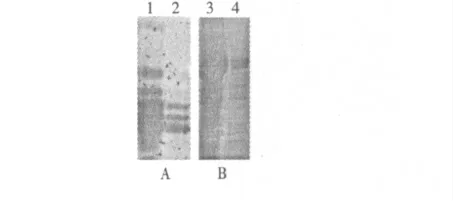
圖1 硫酸銨分級沉淀后的明膠活性電泳和SDSPAGE.Fig.1 Active-staining of gelatin PAGE and SDS-PAGE analysis of Ammonium sulfate precipitation.
CPTI 粗提物(含有308.7 mg 蛋白)對緩沖液A充分透析后,取20 mL 上樣到Sephadex G-150 凝膠過濾層析柱(3.2 cm ×56 cm),經緩沖液A 充分洗脫,洗脫速度為20 mL/h,每管10 mL,圖2A 為層析圖譜.對洗脫液進行胰蛋白酶抑制活性測定,發現10~20 管含有胰蛋白酶抑制劑活性。

圖2 Sephadex G-150 凝膠過濾層析圖譜、明膠活性電泳及SDS-PAGEFig.2 Gel filtration chromatography,Active-staining of gelatin PAGE and SDS-PAGE analysis
取前30 管按照1.2.3.1 的方法進行活性電泳,分離膠含0. 5% 的明膠,電流為1 mA/孔,電泳完后,膠板浸在含有25 μg/mL 胰蛋白酶的100 mmol/L 的Tris -Hcl (pH 8.0)中,處理40 min,其結果見圖2B。選取有抑制劑活性的11-13 管進行SDS-PAGE分析,結果如圖2C 所示,在膠板的下緣均有條帶,說明這部分與抑制劑活性相關。
2.2 離子交換層析分離組分I 與組分II
收集凝膠過濾中有抑制劑活性的樣品,合并11-13 管,并對緩沖液A 充分透析,離心,樣品濃縮后取5 mL 上樣到DEAE-52 纖維素陰離子交換柱(3.2 cm ×20 cm),先用緩沖液A 洗脫,收集穿透峰,洗脫速度為20 mL/h,每管10 mL,共收集12 管。活性測定結果表明,穿透峰仍具有活性,作為組分I(圖3A 中Pool I 部分)。換用含相同緩沖液A 的0.1~0.5 mol/L NaCl,進行線性梯度洗脫,洗脫速度為20 mL/h,每管10 mL。活性測定結果表明,在0.1 mol/L NaCl 時洗脫下的樣品有活性,作為組分II(圖3A 中Pool II 部分)。
對前30 管樣品按照1.2.3.1 的方法進行活性電泳檢測,圖3B 顯示了電泳結果。結果顯示,在穿透峰的3~5 管有胰蛋白酶抑制劑存在,對應著組分I。在洗脫峰的14~18 管有胰蛋白酶抑制劑存在,對應著組分II。取4、5、15、16 管進行SDS-PAGE 分析,結果如圖3C,我們可以看到通過離子交換層析已經除去了大部分蛋白,尤其穿透峰中雜蛋白含量已經明顯較少。

圖3 DEAE-52 離子交換層析、明膠活性電泳及SDSPAGE 分析Fig.3 Ion exchange chromatography on DEAE-52,Activestaining of gelatin PAGE and SDS-PAGE
2.3 通過Sephacryl S-300 層析分離CPTI IA 和CPTI IB
收集的組分I 對去離子水充分透析,離心(10000 ×g,15 min,4 ℃),濃縮后取6 mL 上清液進行FPLC 純化。分批上樣至經0.1 mol/L NH4HCO3平衡后的Sephacryl S-300 凝膠過濾柱,并且用同樣的緩沖液洗脫,洗脫速度為3.9 mL/h,每管2 mL。如圖4A 所示,洗脫下兩個蛋白峰,經活性測定都有抑制劑活性。
取第一個峰對應的15~20 號管和第二個峰對應的25~35 管按照1.2.3.2 的方法進行活性電泳檢測,電泳結果見圖4B。取第32 和33 管進行SDSPAGE,圖4C 顯示有單一的條帶,說明已經得到了CPTI IB。
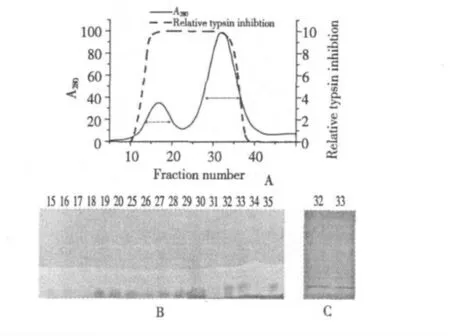
圖4 FPLC 的sephacryl s-300 凝膠過濾層析及活性電泳Fig.4 Gel filtration chromatography on sephacryl s-300 and active-staining of gelatin PAGE and SDS-PAGE
3 結論
綜上所述,本文通過幾種分離純化方法探討了豇豆胰蛋白酶抑制劑不同組分的制備方法,并運用兩種活性電泳方法對各組分進行了活性測定,同時對各組分也進行了SDS-PAGE 分析。最后經過Sephacryl S-300 層析分離了CPTI IB 蛋白,經過SDS-PAGE 鑒定,其含有單一的條帶,其理化性質有待進一步研究。
對于其他的組分的純化,可對相應的組分做進一步的FPLC 層析,本文為分離提純幾種胰蛋白酶抑制劑提供了基礎。
1 Von der Helm,Korant KBD,Cheronis JCE,Proteases as targets for therapy,2000.
2 Koblinski JE,Ahram B,Sloane BF. Unraveling the role of proteases in cancer. Clinica chimica acta,2000,291:113-135.
3 Birk Y,et al.Purification and some properties of a highly active inhibitor of trypsin and alpha-chymotrypsin from soybeans.Biochim Biophys Acta,1961,54:378-381.
4 Brown WE,et al. Wound-induced trypsin inhibitor in alfalfa leaves:identity as a member of the Bowman-Birk inhibitor family.Biochemistry,1985,24:2105-2108.
5 Carlini CR,Grossi-de-Sa MF.Plant toxic proteins with insecticidal properties.A review on their potentialities as bioinsecticides.Toxicon,2002,40:1515-1539.
6 Kennedy AR,et al. The Bowman-Birk inhibitor from soybeans as an anticarcinogenic agent. The American journal of clinical nutrition,1998,68:1406S-1412S.
7 Ekrami H,Kennedy AR,Shen WC. Disposition of positively charged Bowman-Birk protease inhibitor conjugates in mice:influence of protein conjugate charge density and size on lung targeting.J Pharm Sci,1995,84:456-461.
8 Sammour RA,et al.Isolation and Characterization of Four Iso Inhibitors from Cowpea (Vigna unguiculata (L.)Walp.)seeds.Turk J Biol,2005,30:207-215.
9 Liao H(廖海),Du LF(杜林方),Zhang NH(張年輝). A method for fast active-staining gelatin-PAGE which detects the proteinase inhibitors. Plant Physiol Commun(植物生理學通訊),2002,38:257-259.
10 Sang YY(桑玉英),Hu JY(胡金勇),Zeng Y(曾勇). A fast Method for Detection of Trypsin Inhibitors Using Polyacrylamide Gel Electrophoresis(常規聚丙烯酰胺凝膠電泳快速檢測胰蛋白酶抑制劑的方法).Acta Botanica Yunnanica(云南植物研究),2001,23:236-238.
11 Dong ZP(董朝蓬),Du LF(杜林方),Zhang NH(張年輝).Purification and some properties of a mannose-binding lectin from seeds of Dolichos Purpureus.Nat Prod Res Dev(天然產物研究與開發),2003,15:188-191.
12 Wang JZ(汪家政),Fan M(范明). Protein Techniques Handbook(蛋白質技術手冊). 2000,Beijing:Science Press.77-100.

