N-乙酰半胱氨酸對活性氧誘導耳蝸毛細胞凋亡的抑制作用的觀察
原紅艷 張淑香 李興啟 李樹華
藥物性、噪聲性、缺血再灌注及老年性聽力損失均與活性氧(reactive oxygen species,ROS)密切相關[1~4],ROS參與了耳蝸組織損傷及耳蝸毛細胞凋亡的過程。目前臨床上對這些感音神性聾的治療效果還不十分滿意,所用藥物多局限于改善局部血流,尚無針對自由基來進行治療的有效藥物,因此努力尋找高效低毒的天然抗氧化劑及設法調動或激活機體中的內源性抗氧化劑至關重要。本研究旨在觀察抗氧化劑N-乙酰半胱氨酸(N-acetylcysteine,NAC)對外源性H2O2誘導的耳蝸毛細胞凋亡的抑制作用,報告如下。
1 材料與方法
1.1 實驗動物及分組 選用新生1~5天SD 大鼠24只,購自中國人民解放軍總醫院實驗動物中心,雌雄不拘,樣本數以耳計。隨機分為4組,每組6只(12耳):①無血清培養基組;②0.1mmol/L H2O2組(H2O2組);③10mmol/L NAC組(NAC組);④10mmol/L NAC+0.1mmol/L H2O2組(NAC+H2O2組)。
1.2 主要試劑與儀器 解剖顯微鏡:SZ3060型,奧林巴斯公司產品;CO2培養箱:3548 型,美國FORMA 公司產品;熒光顯微鏡:CX41-32RFL型,奧林巴斯公司產品;N-乙酰半胱氨酸(NAC):Sigma A7250;無血清添加劑(Serum-Free supplement):Sigma I-1884;丫啶橙(acridine orange,AO);華美生物工程技術有限公司BS0043;碘化丙啶(propidium iodide,PI);Sigma P-4170。
1.3 實驗方法
1.3.1 新生大鼠耳蝸Corti器的體外培養 將大鼠在-20℃環境下低溫麻醉3~5分鐘,待皮膚變白、不能活動后,浸于75%乙醇中消毒2分鐘后取出,眼科剪斷頭,剪開顱骨,去除腦組織,剪下顳骨,置于盛有PBS的培養皿中,在超凈工作臺的解剖顯微鏡下分離出Corti器,并用尖刀按頂回、中回、底回將其分為3段。將分割好的組織片段移入盛有1ml無血清培養液(Serum-Free Medium)的培養皿中,并使其下沉到培養皿底部。最后將培養皿緩慢移入37 ℃、5%CO2培養箱進行培養。整個解剖過程必須迅速、準確,嚴格無菌操作。各組動物Corti器均在無血清培養液組培養24小時后,棄去原培養液,換入新的各組相對應的培養液,繼續培養24小時。培養期間在倒置顯微鏡下觀察基底膜Corti器的細胞結構和形態。
1.3.2 AO/PI雙重染色及凋亡細胞的檢測 吸干培養皿內培養液,加入含100 mmol/L AO 及10 mmol/L PI的PBS(0.1 M ,pH 6.8)染色15分鐘,然后用PBS充分浸洗,再以4%多聚甲醛固定15~30分鐘,最后用PBS沖洗,甘油封固。
在熒光顯微鏡下觀察并攝像(熒光激發光波長360±10nm,發射光波長≥500nm)。經AO/PI雙重染色后的基底膜,凋亡細胞被染為橙紅色,活性細胞則為亮綠色。在單位長度的顯微鏡攝影取景框范圍內對耳蝸內外毛細胞進行計數觀察。
1.4 統計學方法 數據經統計軟件State 4.0 處理,組間比較采用方差分析。
2 結果
2.1 各組耳蝸基底膜熒光顯微鏡觀察結果 無血清培養基組在48小時培養過程中毛細胞始終保持良好的形態結構,在倒置顯微鏡下可以看到3排外毛細胞和1排內毛細胞及其周圍的支持細胞,內外毛細胞排列整齊,無壞死脫落,經AO/PI染色后,內、外毛細胞均被染成亮綠色,輪廓清晰,活性良好(圖1)。NAC 組耳蝸基底膜的形態結構與無血清培養基組無明顯差異,經AO/PI染色后未見凋亡細胞(圖2)。H2O2組培養過程中,毛細胞基本保持原有排列規律,經AO/PI染色后,可見大量凋亡細胞,細胞形態發生改變,出現水腫及碎裂,還有部分細胞缺失(圖3)。NAC+H2O2組培養48小時后,細胞仍保持完好形態,染色后只見少許凋亡細胞(圖4)。可見NAC明顯減輕了H2O2對毛細胞的損傷程度。
2.2 各組毛細胞凋亡情況 無血清培養基組與NAC 組毛細胞凋亡率無顯著差異(P >0.05),H2O2組和NAC+H2O2組凋亡率有顯著性差異(P<0.05)(表1),說明NAC可明顯減輕H2O2對耳蝸毛細胞的損傷。

圖1 無血清培養基組耳蝸基底膜 經AO/PI染色后,內、外毛細胞均被染成亮綠色,輪廓清晰.(AO 和PI雙重染色)×200 圖2 NAC組耳蝸基底膜 內、外毛細胞均被染成亮綠色,輪廓清晰,保持完好活性(AO 和PI雙重染色)×200 圖3 H2O2組耳蝸底回基底膜 可見大量凋亡細胞,被染成橙紅色(白箭頭所示),還有個別OHC 保持活性,被染成綠色(黑箭頭所示)(AO 和PI雙重染色)×200 圖4 NAC+H2O2組耳蝸基底膜 經AO/PI染色后,可見少許凋亡細胞(箭頭所示),大部分OHC、IHC保持良好活性(AO和PI雙重染色)×200
表1 各組耳蝸毛細胞凋亡情況(%,±s)
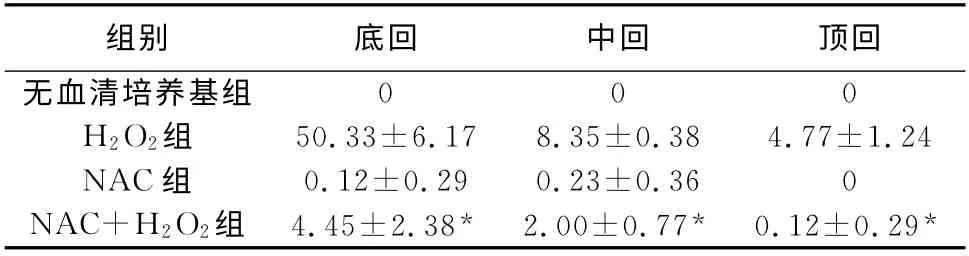
表1 各組耳蝸毛細胞凋亡情況(%,±s)
注:*與H2O2 組比較,P<0.05
組別底回中回頂回無血清培養基組0 0 0 H2O2組50.33±6.17 8.35±0.38 4.77±1.24 NAC組0.12±0.29 0.23±0.36 0 NAC+H2O2組 4.45±2.38* 2.00±0.77* 0.12±0.29*
3 討論
3.1 H2O2誘導的耳蝸毛細胞凋亡 大量研究證明ROS參與介導了細胞凋亡的過程。在耳蝸感覺細胞營養因子去除或順鉑引起的耳毒性過程中耳蝸內ROS大量增加,這些自由基與毛細胞膜磷脂交互作用產生脂質過氧化物,其中一些脂質過氧化物作為聽神經及毛細胞凋亡的介質最終引起毛細胞凋亡[5]。在應用慶大霉素等氨基糖苷類抗生素后,內耳血流減少及隨后的再灌注損傷;噪聲暴露后基底膜過度振動導致局部組織機械損傷等,這些過程中均有大量自由基產生,清除自由基的酶及其代謝產物的消耗,均可誘導毛細胞的凋亡[1,6]。此外,多數研究認為,Ca2+可促進細胞凋亡,胞漿內Ca2+濃度增加可作為細胞凋亡起始的早期信號[7];而細胞內游離Ca2+濃度增高,一方面又會促使自由基增加進一步造成細胞的直接損害,另一方面也可能通過鈣調蛋白進一步激活蛋白激酶C,導致蛋白磷酸化,從而影響細胞的生長分化[8]。本實驗發現H2O2組耳蝸基底膜有大量凋亡毛細胞,OHC 損傷最重,IHC次之,未見支持細胞凋亡,說明ROS促進了毛細胞的凋亡。
3.2 抗氧化劑NAC對H2O2誘導的耳蝸毛細胞凋亡的保護作用之機理 本實驗中NAC 組細胞凋亡率并無顯著變化,提示NAC 本身對細胞并無毒性作用,為臨床使用的安全性奠定了基礎。NAC 是一種含巰基化合物,主要用于治療充血性和阻塞性肺部疾患如慢性支氣管炎以及成人呼吸窘迫綜合征和急慢性炎癥[9];它作為體內活性氧系列物質(如H2O2和O2-)的清除劑和還原型谷胱甘肽(GSH)的供給體,在機體抗氧化反應中有重要作用[10,11]。GSH是細胞內重要的保護性穩定因素,它的抗氧化作用位置是在細胞內,體內具有將氧化型谷胱甘肽(oxidized glutathione,GSSG)轉變為還原型谷胱甘肽(GSH)的酶系統,但隨活性氧濃度增加,體內酶活性降低,因此補充外源性GSH 就顯得尤為重要。研究認為,NAC作為GSH 前體,在氧化應激發生、GSH 下降時,NAC具有提高GSH 的作用[12]。
本實驗發現H2O2組耳蝸基底膜的細胞凋亡率較無血清培養基組顯著提高,而加入NAC 干預后,明顯抑制了H2O2的細胞毒性作用,表現為細胞凋亡率顯著下降,提示NAC 對耳蝸毛細胞具有保護作用,而且與其抗氧化能力有關。NAC 可對抗多種損傷導致的細胞凋亡[13~15],NAC的保護機理有:①NAC可作為自由基的清除劑,干擾自由基的形成;②NAC的巰基作為H+供體而發揮直接的抗氧化作用;③NAC 作為還原型GSH 的前體,富集于細胞環境中時可提供GSH 發揮抗氧自由基的作用。此外,NAC 還能再合成具有生物活性的GSH起間接抗氧化作用。另有證據表明,細胞凋亡的誘導和抑制與信號傳導通路有關,NAC可以干擾凋亡通路下游的信號[16]。
總之,NAC作為活性氧清除劑和GSH 前體,對活性氧誘導的毛細胞凋亡具有明顯的抑制作用。但關于NAC 的化學特性、生物學特性及其在體內吸收和代謝環節、起始作用、靶細胞的作用位點及作用于大分子物質的本質還不十分明確,它能否應用于人體對抗氧化應激反應還有待于進一步研究。
1 麥爾,列納,緹雪,等.一種預防噪聲導致失聰的新方法[J].解放軍醫學雜志,2009,5:519.
2 Clerici WJ.Effects of superoxide dismutase and U74389Gon acute trimethltin-induced cochlear dysfunction[J].Toxicol Appl Pharmacol,1996,136:236.
3 Seidman MD,Bai U,Khan MJ,et al.Association of mitochondrial DAN delection and cochlear pathology:a molecular biological tool[J].Laryngoscope,1996,106:777.
4 Seidman MD,Bai U,Khan MJ,et al.Association of mitochondrial DAN delection associated with aging and presbyacusis[J].Arch Otolaryngol Head Neck Surg,1997,123:1 039.
5 于紅,祝威,李興啟.活性氧與內耳毛細胞凋亡相關的信號轉導及基因調控[J].國際耳鼻咽喉頭頸外科雜志,2006,30:134.
6 曲雁,李云,丁大連.噪聲性耳聾的研究進展[J].河北醫科大學學報,2009,8:860.
7 薛全福,王振綱.鈣離子和細胞凋亡及藥物調控[J].中國全科醫學,2009,12:1126.
8 趙舒武,高英茂,張曉麗.鈣離子與缺氧性神經干細胞凋亡的相關性研究[J].中國組織化學與細胞化學雜志,2007,5:575.
9 劉積鋒,鐘小寧,何志義.N-乙酰半胱氨酸對大鼠慢性支氣管炎與肺氣腫形成影響的實驗研究[J].中國實用醫藥,2008,10:1.
10 Ozaras R,Tahan V,Aydin S,et al.N-acetylcysteine attenuates alcohol-induced oxidative stress in the rat[J].World Journal of Gastroenterology,2003,1:125.
11 Gillissen A,Scharling B,Jaworska M,et al.Oxidant scavenger function of ambroxol invitro:acomparison with N-acetylcysteine[J].Res Exp Med,1997,196:389.
12 Eidelman LA,Pizov R,Sprung CL.New therapeutic approaches in sepsis:a critical review Intensive[J].Care Med,1995,21(Suppl 2):S269.
13 朱斌,孫家邦,李凱.N-乙酰半胱氨酸對大鼠急性壞死性胰腺炎胰腺損傷的影響[J].中華普通外科雜志,2009,11:904.
14 吳曉燕,任江華.N-乙酰半胱氨酸對心力衰竭兔核因子NF-κB活化及心肌凋亡的干預作用[J].中華急診醫學雜志,2008,3:276.
15 劉蕓野,謝青,王暉,等.N-乙酰半胱氨酸對內質網應激介導的HepG2細胞凋亡的作用[J].中華肝臟病雜志,2008,7:524.
16 Brecher AS,Koenig MJ.Protection of chymotrypsin from inactivation by an N-mustardanalog[J].Toxicol Lett,1995,76:11.

