豬流行性腹瀉病毒感染的診斷與病毒的初步分離
蔣 梅,楊澤曉,張榮昌,姚學(xué)萍,王 印
(1.四川農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院,四川 雅安625014;2.西藏昌都地區(qū)動(dòng)物衛(wèi)生及植物檢疫監(jiān)督所,西藏 昌都854000)
豬流行性腹瀉(PED)是由豬流行性腹瀉病毒(PEDV)引起哺乳仔豬腹瀉、嘔吐、脫水和高致死率為主要特征的一種高度接觸性腸道傳染病。自1971年首次在英國(guó)和比利時(shí)報(bào)道之后,日本、韓國(guó)、加拿大、中國(guó)等世界各國(guó)相繼報(bào)道了PED的發(fā)生[1-2]。該病對(duì)全世界的養(yǎng)豬業(yè)造成了嚴(yán)重的經(jīng)濟(jì)損失。PEDV屬于套式病毒(Nidovirales)冠狀病毒科(Coronauiridae)冠狀病毒屬(Coronauirus),基因組核酸為單股正鏈RNA,有侵染性,長(zhǎng)約28kb[3]。病毒顆粒呈球狀,有囊膜和纖突,核衣殼呈螺旋狀對(duì)稱[4]。1988年瑞士的首次報(bào)道PED病毒在Vero細(xì)胞上培養(yǎng)獲得成功之后,我國(guó)的學(xué)者也先后在PK-15、Vero、ST等細(xì)胞上進(jìn)行了該病毒分離的報(bào)道。
日前,四川省某豬場(chǎng)發(fā)生大規(guī)模的仔豬腹瀉性致死性的疾病,臨床癥狀水樣腹瀉或伴隨嘔吐(多發(fā)于吃食或吮乳后)、脫水;糞稀如水,呈灰黃色或灰色。少數(shù)病豬體溫升高1℃~2℃,精神沉郁,食欲減退或不食,尤其是繁殖種豬。該病豬年齡越小,臨床癥狀越重。本試驗(yàn)采集發(fā)病豬場(chǎng)病死豬的腸系膜淋巴結(jié)提取總RNA和DNA進(jìn)行了RT-PCR和PCR檢測(cè) ,并對(duì)引起該次大規(guī)模腹瀉的病料進(jìn)行了病毒的初步分離純化,為進(jìn)一步對(duì)該病的防控奠定基礎(chǔ)。
1 材料與方法
1.1 病料的采集 采集病死豬和發(fā)病豬的腸系膜淋巴結(jié),以及脫落的腸黏膜用于進(jìn)一步的(RT-)PCR檢測(cè)和病毒分離。
1.2 主要試劑和引物 根據(jù)文獻(xiàn)[5]選擇的Vero細(xì)胞(由四川農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院生物技術(shù)中心提供)來(lái)進(jìn)行病毒分離,DMEM(HyClone)營(yíng)養(yǎng)液,0.25%胰蛋白酶-EDTA消化液,購(gòu)自北京索萊寶科技有限公司;RNAiso Plus、RT-PCR反轉(zhuǎn)錄試劑盒,購(gòu)自TaKaRa公司;Tap Mix,購(gòu)自博邁德科技發(fā)展有限公司,DNA Marker,購(gòu)自TIANGEN公司;DNA膠回收純化試劑盒,購(gòu)自北京天恩澤基因科技有限公司;瓊脂糖,購(gòu)自BIOWEST公司;偽狂犬病病毒(PEV)、圓環(huán)病毒(PCV2)、細(xì)小病毒(PPV)、豬瘟病毒(CSFV)、豬繁殖與呼吸障礙病毒(PRRSV)、豬乙型腦炎病毒(JEV)、豬流行性腹瀉病毒(PEDV)的特異性引物分別根據(jù)參考文獻(xiàn)[6~12],由上海英駿生物技術(shù)有限公司合成;PEV、PCV2、PPV、CSFV、PRRSV、JEV 等病毒的陽(yáng)性血清,由本實(shí)驗(yàn)室自制并保存。
1.3 病毒RNA和DNA的提取及檢測(cè) 取病死豬和發(fā)病豬的腸系膜淋巴結(jié),根據(jù)RNAiso Plus提取總RNA,按照反轉(zhuǎn)錄試劑盒反轉(zhuǎn)錄為cDNA,DNA的提取參考文獻(xiàn)[13]采用酚-氯仿法。
1.4 豬源其他病毒的(RT-)PCR擴(kuò)增 以1.3步驟中所得到的cDNA和RNA作為模板,用PEV、PCV2、PPV、CSFV、PRRSV、JEV、PEDV 特異性的引物進(jìn)行(RT-)PCR擴(kuò)增。
1.5 病毒分離 取病死豬腸系膜淋巴結(jié)和已脫落的腸黏膜剪碎,置于研缽中,滴加5~10倍體積的生理鹽水,研磨20min,反復(fù)凍融3次后轉(zhuǎn)入EP管中加入青霉素(1 000IU/mL)、鏈霉素(300μg/mL)37℃水浴1h,之后經(jīng)4 000r/min離心30min,取上清用0.22μm的濾膜過(guò)濾之后用滅菌的EP管收集或直接取0.6mL接種在長(zhǎng)成單層的Vero細(xì)胞,每隔6~10h觀察細(xì)胞病變。
1.6 病毒純化 在Vero細(xì)胞上盲傳病毒至第25代之后在收集的病毒液里面加入PEV、PCV2、PPV、CSFV、PRRSV、JEV等病毒的陽(yáng)性血清,37℃溫育1h后繼續(xù)在Vore細(xì)胞上繼續(xù)傳代,收集病毒液,進(jìn)行豬源其他病毒RT-PCR檢測(cè)。
2 結(jié)果
2.1 病毒RNA和DNA的提取及檢測(cè) 獲取病料中核酸,經(jīng)PCR或RT-PCR后瓊脂糖電泳檢測(cè),PEV、PCV2、PPV、CSFV、PRRSV、JEV 等病毒的核酸擴(kuò)增均為陰性,PEDV出現(xiàn)預(yù)期大小的陽(yáng)性條帶664bp,結(jié)果見(jiàn)圖1。PCR產(chǎn)物的序列測(cè)定結(jié)果顯示同源性98%~99%,判定PEDV核酸陽(yáng)性。
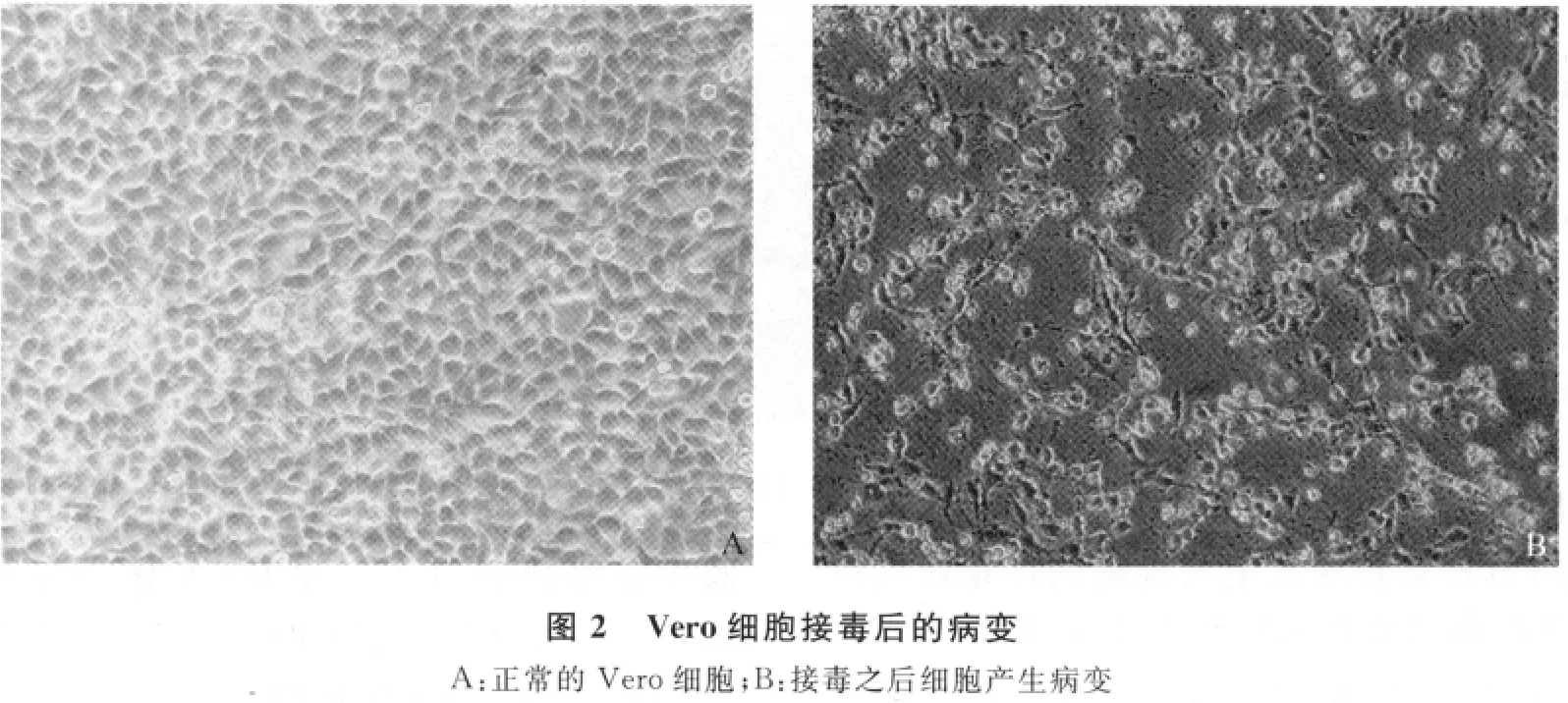
2.2 病毒的分離培養(yǎng) 用Vero細(xì)胞同步接毒后毒株在盲傳前5代時(shí)細(xì)胞都沒(méi)有發(fā)生明顯的病變,傳至第6代逐漸開(kāi)始有病變,等傳至25代以后細(xì)胞接毒24~32h出現(xiàn)了病變:細(xì)胞折光度降低、變圓、體積縮小、碎裂、細(xì)胞部分脫落見(jiàn)圖2。

2.3 病毒的純化 在第25代之后收集的病毒液里面加入PEV、PCV2、PPV、CSFV、PRRSV、JEV 等病毒的陽(yáng)性血清,37℃溫育1h后繼續(xù)在Vero細(xì)胞上傳代培養(yǎng),同時(shí)取傳代細(xì)胞提取RNA和DNA做PCR或RT-PCR檢測(cè),結(jié)果顯示,除PEDV擴(kuò)增出約664bp目的條帶外,其他病毒均為擴(kuò)增陰性見(jiàn)圖3。

圖3 病毒純化后做豬外源病毒檢測(cè)結(jié)果
3 討論
本試驗(yàn)從疑似PEDV的發(fā)病豬群的病死豬采集腸系膜淋巴結(jié)、脫落的腸黏膜等病變組織,采用RT-PCR進(jìn)行實(shí)驗(yàn)室診斷,并進(jìn)行了PCR產(chǎn)物的序列測(cè)定,結(jié)果顯示,PEDV核酸陽(yáng)性,同時(shí)我們對(duì)PEV、PCV2、PRRSV、CSFV、PPV等常見(jiàn)病毒也進(jìn)行了檢測(cè)均為核酸陰性,結(jié)合其流行病學(xué)、臨床癥狀和抗生素治療效果不佳等方面,判定引起該次仔豬腹瀉大規(guī)模致死的病原為PEDV。同時(shí)本研究采用Vero細(xì)胞對(duì)其病毒進(jìn)行了初步分離,并經(jīng)過(guò)RTPCR檢測(cè)與PEDV擴(kuò)增目的DNA片段大小相符,為進(jìn)行一步PEDV防治的相關(guān)研究提供科學(xué)材料和參考依據(jù)。
對(duì)于 PEV、PCV2、PRRSV、CSFV、PPV、JEV、PEDV等豬外源性病毒來(lái)說(shuō),均可以采用猴腎細(xì)胞來(lái)進(jìn)行分離[14],因此此次的病毒分離采用Vero細(xì)胞;病毒傳至第6代開(kāi)始出現(xiàn)病變,提示病毒已經(jīng)適應(yīng)了Vero細(xì)胞,可穩(wěn)定的增殖,傳代6次以后進(jìn)行外源病毒的陽(yáng)性血清中和試驗(yàn)應(yīng)該比較合適,同時(shí)發(fā)現(xiàn)傳至第25后代病毒在24h左右就已經(jīng)發(fā)生明顯的細(xì)胞病變,考慮到試驗(yàn)的可靠性,本研究收集第25代后細(xì)胞毒進(jìn)行(RT-)PCR檢測(cè)。為保證病毒的分離純化工作的順利進(jìn)行,本試驗(yàn)采用豬源病毒(PEV、PCV2、PRRSV、CSFV、PPV、JEV)陽(yáng)性血清處理繼續(xù)傳代,一方面提高了病毒純化效率,大大縮短了分離純化病毒所需要的時(shí)間,另一方面排除PEV、PCV2、PRRSV、CSFV、PPV、JEV 等病毒感染的可能。
[1]Lema A D,Glook R D,Mengelng W L,etal.Diseases of swine[M].6th ed,Ames,lowa State University Press,1986:402-406.
[2]倪艷秀,林繼煌,何孔旺,等.豬流行性腹瀉研究概況[J].畜牧與獸醫(yī),2001,33(1):38-40.
[3]Knipe D M,Hoeley P M,Griffin D E,etal.Fields virology(4th ed)[M].Philadelphia:Lippincott Williams & Wilkins,2001.
[4]陸承平,黃青云,吳潤(rùn),等.獸醫(yī)微生物學(xué)[M].第4版.中國(guó)農(nóng)業(yè)出版社,2007.
[5]錢永清,聞人楚,唐永蘭,等.流行性腹瀉病毒的分離培養(yǎng)與鑒定[J].上海農(nóng)業(yè)學(xué)報(bào),1999,15(2):41-44.
[6]GB/T 18641-2002,偽狂犬病診斷技術(shù)[S].
[7]GB/T 21674-2008,豬圓環(huán)病毒聚合酶鏈?zhǔn)椒磻?yīng)試驗(yàn)方法[S].
[8]SN/T 1874-2007,豬細(xì)小病毒聚合酶鏈?zhǔn)椒磻?yīng)操作規(guī)程[S].
[9]DB12/T 377-2008豬瘟病毒反轉(zhuǎn)錄-聚合酶鏈?zhǔn)椒磻?yīng)(RT-CR)試驗(yàn)方法[S].
[10]GB/T 18090-2008,豬繁殖與呼吸綜合征診斷方法[S].
[11]GB/T 22333-2008,日本乙型腦炎病毒反轉(zhuǎn)錄聚合酶鏈反應(yīng)試驗(yàn)方法[S].
[12]張坤,何啟凱.豬流行性腹瀉病毒、豬傳染性胃腸炎病毒和豬A群輪狀病毒多重RT-PCR檢測(cè)方法的建立及臨床應(yīng)用[J].畜牧獸醫(yī)學(xué)報(bào),2010,41(8):1001-1005.
[13]曹果清,莫清珊,陳鳳仙.酚/氯仿抽提法提取綿羊凝血塊中基因組 DNA[J].安徽農(nóng)業(yè)科學(xué),2009,37(34):16771-16772.
[14]第十章 常見(jiàn)的致動(dòng)物疾病性病毒[DB/OL].http://www.doc88.com/p-28344541422.html.

