微矩陣電極在人類多功能干細胞分化的心肌細胞上的應用
盧珺 Heming Wei張廣欽
微矩陣電極系統(Multielectrode array,MEA)是一個進行體外實驗的簡易且具有創新意義的研究工具。其包括數據采集系統,MEA信號放大器和溫控系統,MEA信號放大器的核心部件含有60個鈦金微電極。通過MEA信號放大器可記錄到細胞及組織(心肌,腦片和肌肉)的電生理信號。數據可由內置軟件計算分析。
自MEA問世30多年以來,相關的技術不斷改進。因其高效快捷的特點,MEA技術受到越來越多研究者的重視。其應用范圍從最初的腦片擴展到到體外培養的細胞以及多功能干細胞,如小鼠和人類的胚胎干細胞 (Embryonic stem cells,ESC)以及誘導多功能干細胞分化為神經細胞或者心肌細胞。多功能干細胞分化的心肌和神經細胞可反映人類在體細胞的生理特性,故可作為有價值的體外(細胞)疾病模型和藥物篩選工具,甚至自體細胞治療。目前,包括抗心律失常藥在內的許多心血管藥物都作用于不同的離子通道。然而,抗心律失常藥同樣會導致心律失常的副作用[1]。諸如小鼠等動物模型被應用于研究遺傳型心律失常患者的基因突變的功能性改變。但因為小鼠與人類在心肌上離子通道的類型和分布存在差異,且小鼠動作電位時程更短,心律更快(=600bpm),因此小鼠模型不能顯現出與人類相同的表現型[2]。2007年,科學家利用 c-Myc,Oct3/4,SOX2,Klf4這4種轉錄因子組合或者Oct-4,Sox2,Nanog,Lin 28將人的體細胞重編程為iPS細胞[3,4]。iPS的問世,為藥物開發的早期工作中,特別是對藥理、代謝和毒性評價提供了人類各種細胞的生理模型。MEA系統作為一個簡單新穎的實驗工具,可對iPS分化的心肌細胞進行長期的體外研究。其具有簡單高效的優點,可廣泛應用于離子通道藥物篩選和基礎研究。本實驗將hiPSC-CMs與MEA系統的有機結合,可直接評估心血管藥物的有效性。從長遠考慮,我們的模型可用于個體化用藥研究,并有利于檢測心血管藥物的安全性和有效性。
本文旨在探討應用MEA系統研究人類多功能干細胞分化的心肌細胞電生理特性,并建立穩定高效的心血管藥物篩選平臺。本文主要探討MEA技術在人類誘導性多功能干細胞分化的心肌細胞的應用。
1 材料與方法
1.1 MEA系統儀器與軟件 儀器:微矩陣電極系統(MultichannelSystems,Reutlingen,Germany)。微矩陣電極芯片(MultichannelSystems,Reutlingen,Germany)60個鈦金微電極(30 μm),電極間距為200 μm。溫度控制系統(MultichannelSystems,Reutlingen,Germany)。軟件:MC_Rack采集分析軟件(Multichannel Systems)。
1.2 細胞和培養基 人類誘導性多功能干細胞分化的心肌細胞(新加坡國家心臟中心提供)。培養基:低糖基礎培養基+20%胎牛血清 +1%谷氨酰胺+1%青霉素+1%鏈霉素(Sigma公司購買)。其他材料:0.1% 明膠。
1.3 方法
1.3.1 微矩陣電極芯片的清洗和處理 實驗前,將微矩陣電極芯片浸泡于75% 酒精2 h,擦干后置于超凈臺,紫外光照射20 min,備用。
1.3.2 心肌細胞團選擇與轉移 顯微操作下,選擇節律性跳動,強力收縮,心律為30~60/min,且直徑在500 μm以上iPS分化的心肌細胞團為操作對象,將其切割下來,并置于0.1% 明膠處理的MEA芯片上,確保心肌細胞團置于并覆蓋在微電極表面。(圖1和圖2)。小心地加入細胞培養基。將芯片置于直徑為100毫米的細胞培養皿中并放入37℃的CO2培養箱內培養72 h。

圖1 微矩陣電極
1.3.3 實驗記錄 至細胞團穩定貼附于MEA芯片后,啟動加熱系統,調節溫度至37℃。將微矩陣電極芯片放入微矩陣記錄系統,打開MC_Rack采集分析軟件,開始采集心肌細胞電生理信號。待場電位信號穩定后,開始記錄,記錄時間為180 s,整個實驗在37℃下進行,心肌細胞團維持在培養基中。
1.3.4 數據分析 應用MC_Rack分析軟件對記錄到的hiPSC-CMs的場電位(FPD)和心率進行分析,利用Bazzet公式cFPD=FPD/√(RR interval)計算場電位時程。
2 結果
2.1 人類多功能干細胞分化的心肌細胞培養與電生理記錄本實驗成功將分化的心肌細胞團貼附于微矩陣電極芯片,并保持節律性跳動,為進行長時間的心血管藥物篩選和基礎研究提供了保障。該實驗成功記錄到人類多功能干細胞分化的心肌細胞的場電位。由于心肌細胞團的大小和所處的位置不同,并非所有微電極都可檢測到電信號,圖3為60個電極分別記錄的細胞團體外電信號的變化。

圖2 人類多功能干細胞分化的心肌細胞
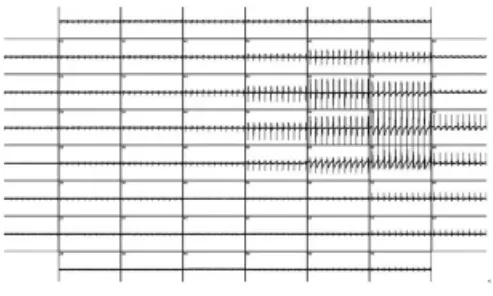
圖3 60個電極記錄的心肌細胞場電位
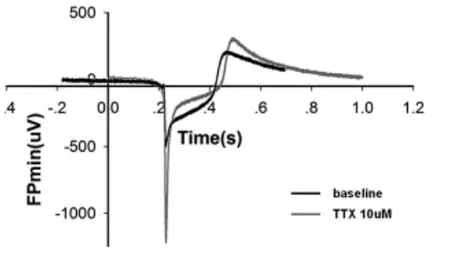
圖4 TTX對iPS心肌細胞的影響
2.2 河豚毒素(TTX)對人類多功能干細胞分化的心肌細胞 場電位的影響 由圖4可見,場電位含有快速去極化下降支,平臺期和復極相。河豚毒素為Na+通道特異性阻斷劑,10 M的TTX降低心率,并阻斷Na+電流,縮短FP min的幅度(圖 5a,b)。
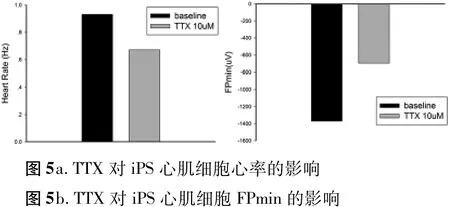
圖5
3 討論
人類多功能干細胞分化的心肌細胞形成的體外模型與MEA系統相結合可作為臨床高效安全的心血管藥物篩選平臺。本實驗旨在通過應用MEA系統研究人類多功能干細胞分化的心肌細胞電生理特性,并建立穩定高效的心血管藥物篩選平臺。
為證明MEA系統是否可作為理想的心血管藥物篩選工具,我們以人類多功能干細胞分化的心肌細胞團作為體外試驗的對象,將其貼于微矩陣電極芯片,記錄心肌細胞的電生理信號以及藥物反應,研究心肌細胞場電位和心率。本實驗記錄到的電生理信號與人類胚胎干細胞分化的心肌細胞相似,并保持節律性跳動,從而可進行長時間的心血管藥物篩選測試和基礎研究。
文獻報道場電位時程與動作電位時程存在線性關系[5]。此外,場電位快速負偏倚與Na+通道活動有關,FPslow反映的是動作電位平臺期L型Ca2+通道的活動[5,6]。因此,依據其良好的時間空間分辨率,MEA系統可用于研究類似于動作電位的場電位特性。
不同心血管藥物可作用于不同的離子通道,動作電位的去極化是由于大量的鈉通道開放引起的鈉離子大量、快速內流所致。河豚毒素(TTX)作為鈉通道阻斷劑,可阻斷鈉離子活動。實驗結果顯示心肌細胞團經10 M的TTX處理過后,心率降低,FP min明顯縮短。證明MEA系統可用于藥物對心肌細胞電生理特性的研究。
同胚胎干細胞一樣,小鼠iPS細胞和人類iPS細胞均可以分化成心肌細胞[7-9]。解決了由于缺少人自身的細胞模型而造成的藥物檢測程序費時費力,價格昂貴,效率低下和不準確等不良因素。Moretti等[10]成功的從LQT患者的皮膚成纖維細胞誘導成iPS并定向分化成心肌細胞,重現了心電圖所觀察的QT間期的延長。人類胚胎干細胞和人類誘導的多功能干細胞誘導的心肌細胞(hESC-CMs和hiPSC-CMs)均可用于對心臟毒性篩選的研究[11]。而且,心血管藥物直接作用于患者自身的hiPSC-CMs更具有臨床意義[12-13]。MEA系統可成功記錄心肌細胞的電生理信號并可評價藥物對心肌細胞的作用,有利于在藥物研發過程中評價劑量依賴性和不良反應的關系[14]。
在實驗過程中,需注意以下三點:①選擇心肌細胞團時,以節律性強力收縮,心律在0.5~1 Hz范圍,且直徑在500 μm以上的心肌細胞為宜。在切割心肌細胞團時可適當切取心肌細胞團周圍的成纖維細胞,有利于心肌細胞團貼附于MEA芯片。②因為在培養過程中,由于心肌細胞團的強力自發跳動,會出現移位現象,而導致電極不能檢測到電信號。故hiPSC-CMs必需穩定的覆蓋于MEA芯片電極表面,確保電極可采取到新信號。③在進行數據分析時,須利用Bazzet公式cFPD=FPD/√(RR interval)計算場電位時程,排除心率對場電位時程的干擾。
本實驗以人類多功能干細胞分化的心肌細胞為研究對象,應用MEA系統記錄細胞外電生理特性。在證實MEA系統可用于長期的體外模型實驗,并為因缺乏適合的疾病模型而導致的生理病理研究鋪平道路。其次,與一般急性分離的心肌細胞相比,多功能干細胞分化的心肌細胞可長時期培養,有利于研究者進行短期或長期研究。hPSC-CMs培養于微矩陣電極芯片上可進行多次反復的檢測。另外,MEA系統具有操作簡單,高效快速的特點,在未來的臨床研究中,作為高通量心血管藥物臨床篩選工具進行大規模的藥物試驗研究。
[1]Morganroth J.Proarrhythmic effects of antiarrhythmic drugs:evolving concepts.Am Heart J,1992,123(4):1137-1139.
[2]Papadatos GA,Wallerstein PM,Head CE,et al.Slowed conduction and ventricular tachycardia after targeted disruption of the cardiac sodium channel gene Scn5a.ProcNatl Acad Sci U S A,2002,99:6210-6215.
[3]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors.Cell,2007,131:861-872.
[4]Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells.Science,2007,318:1917-1920.
[5]Halbach M,Egert U,Hescheler J,et al.Estimation of action potential changes from field potential recordings in multicellular mouse cardiac myocytes cultures.Cell Physiol Biochem,2003,13:271-284.
[6]Morad M,Tung L.Ionic events responsible for the cardiac resting and action potential.Am J Cardiol,1982,49:584-594.
[7]Schenke-Layland K,Rhodes KE,Angelis E,et al.Reprogrammed mouse fibroblasts differentiate into cells of the cardiovascular and hematopoietic lineages.Stem Cells,2008,26:1537-1546.
[8]Narazaki G,Uosaki H,Teranishi M,et al.Directed and systematic differentiation of cardiovascular cells from mouse induced pluripotent stem cells.Circulation,2008,118:498-506.
[9]Zhang J,Wilson GF,Soerens AG,et al.Functional cardiomyocytes derived from human induced pluripotent stem cells.Circ Res,2009,104:30-41.
[10]Moretti A,Bellin M,Welling A,et al.Patient-speci cinduced pluripotent stem-cell models for long-QT syndrome.N Engl J Med,2010,363:1397-1409.
[11]Braam SR,Tertoolen L,van de Stolpe A,et al.Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes.Stem Cell Res,2010,4(2):107-116.
[12]Shiba Y,Hauch KD,Laflamme MA.Cardiac applications for human pluripotent stem cells.Curr Pharm Des,2009,15(24):2791-2806.
[13]Kamp TJ,Lyons GE.On the road to iPS cell cardiovascular applications.Circ Res,2009,105(7):617-619.
[14]Tanaka T,Tohyama S,Murata M,et al.In vitro pharmacologic testing using human induced pluripotent stem cell-derived cardiomyocytes.Biochem Biophys Res Commun,2009,385:497-502.

