水通道蛋白4和8在人不同病理級別星形細(xì)胞瘤組織中的表達(dá)*
朱淑娟, 孫善全△, 許士葉, 張興業(yè), 甘勝偉
(1重慶醫(yī)科大學(xué)神經(jīng)科學(xué)研究中心,重慶400016;2西安市第一人民醫(yī)院神經(jīng)外科,陜西西安710038)
水分子和離子平衡的調(diào)節(jié)對維持正常腦功能是非常關(guān)鍵的。在中樞神經(jīng)系統(tǒng)中,星形膠質(zhì)細(xì)胞作為哺乳動物腦內(nèi)最豐富的細(xì)胞類型,其調(diào)控作用主要依賴于水通道蛋白(aquaporins,AQPs)、離子通道蛋白及其錨定蛋白三者之間的相互作用而實(shí)現(xiàn)的[1]。大量的研究顯示:這些通道蛋白在細(xì)胞的表達(dá)和極化分布方式被打亂之后,將引起離子和細(xì)胞容積的平衡被破壞。另外,血腦屏障中水通道的表達(dá)變化也是膠質(zhì)瘤性腦水腫發(fā)生的重要分子機(jī)制[2],但對其增殖、生長機(jī)制仍無定論。本實(shí)驗(yàn)從星形膠質(zhì)瘤的惡性程度角度,探討了 AQPs成員中AQP4和AQP8在人不同病理級別星形細(xì)胞瘤組織中的表達(dá)變化,為初步闡明AQPs在星形細(xì)胞瘤增殖生長中的機(jī)制提供實(shí)驗(yàn)依據(jù)。
材料和方法
1 病例及標(biāo)本采集
星形細(xì)胞瘤標(biāo)本均取自重慶醫(yī)科大學(xué)附屬第一醫(yī)院神經(jīng)外科和第三軍醫(yī)大學(xué)大坪醫(yī)院神經(jīng)外科星形細(xì)胞瘤的患者,共55例;以患者腫瘤周圍相對正常腦組織作為對照組。所有標(biāo)本自術(shù)中取出后,一部分用于病理檢查,另一部分則置于液氮中迅速冷凍后,-80℃保存。經(jīng)病史詢問,所有患者術(shù)前均未接受過免疫治療、放療、化療等治療手段。
2 主要試劑及儀器
單克隆小鼠抗人AQP4和AQP8抗體均購自Abcam;辣根酶標(biāo)記的兔抗山羊IgG、山羊抗小鼠IgG、DAB顯色試劑盒和Ⅱ抗試劑盒購自中杉金橋公司;β-actin抗體購自武漢博士德公司;SDS聚丙烯酰胺凝膠配置試劑盒、Trizol和AMV逆轉(zhuǎn)錄試劑盒購自TaKaRa。
3 HE及免疫組織化學(xué)染色
將所取相對正常腦組織與各級星形膠質(zhì)瘤組織常規(guī)固定后,行石蠟包埋,連續(xù)切片,厚度為5μm。脫蠟后HE染色,進(jìn)行診斷和病理分級。選片,常規(guī)脫蠟,枸櫞酸鹽溶液(pH 6.0)修復(fù)(95℃,40 min)后,按照二步法試劑盒說明書操作,AQP4Ⅰ抗?jié)舛葹?∶500(PBS 配制),AQP8Ⅰ抗?jié)舛葹?1∶350(PBS配制),DAB顯色試劑盒顯色,蘇木精復(fù)染細(xì)胞核,脫水透明后封片,顯微鏡觀察。采用北航生物醫(yī)學(xué)圖像分析系統(tǒng)(CM-2000B)進(jìn)行圖像分析,測定免疫組化陽性反應(yīng)細(xì)胞的積分吸光度值(IA)。
4 Western blotting檢測
用細(xì)胞裂解液(碧云天)提取對照組和各級星形膠質(zhì)瘤組織樣品總蛋白,10%SDS-PAGE凝膠分離蛋白,通過濕轉(zhuǎn)方式將蛋白轉(zhuǎn)至0.45μm孔徑的硝酸纖維膜上,用Ⅰ抗封閉液室溫封閉2 h后,分別加入含 AQP4(1∶1 500)、AQP8(1∶1 000)和 β - actin(1∶5 000)的Ⅰ抗稀釋液(PBS配制),4℃過夜孵育,PBST洗膜3次,10 min/次,分別滴加山羊抗小鼠IgGⅡ抗(1∶5 000)(PBS配制)稀釋液,37℃孵育2 h,PBST洗膜3次,10 min/次,DAB 試劑盒顯色,用Quantity One軟件轉(zhuǎn)換后BandScan軟件測定條帶灰度值。將AQP4和AQP8分別與β-actin灰度值的比值作為觀察指標(biāo),進(jìn)行統(tǒng)計(jì)學(xué)分析。
5 逆轉(zhuǎn)錄聚合酶鏈?zhǔn)椒磻?yīng)(RT-PCR)
對照組及不同病理級別星形膠質(zhì)瘤組織各100 mg。按Trizol提取程序(說明書)提取組織總RNA;按AMV逆轉(zhuǎn)錄試劑盒操作說明進(jìn)行逆轉(zhuǎn)錄后,4℃保存。擴(kuò)增引物:AQP4上游引物5'-ggaatttctggccatgctta-3',下游引物 5'- aagacagacttggcgatgct-3',擴(kuò)增片段產(chǎn)物長231 bp。AQP8上游引物5'-tcctgaggagaggttctgga-3',下游引物 5'- agagggccctttgtcttctc-3',擴(kuò)增產(chǎn)物長159 bp。β-actin上游引物5'- ctgccgcatcctcttcctc-3',下游引物 5'- ctcctgcttgctgatccacat-3',擴(kuò)增產(chǎn)物長 398 bp。擴(kuò)增條件:94℃ 15 s,55℃ 15 s,72℃ 20 s,共35個(gè)循環(huán)。2%瓊脂糖凝膠電泳后,凝膠成像儀觀察并照相,用Band Scan 5.0軟件測定條帶灰度值,將 AQP4 mRNA、AQP8 mRNA分別與β-actin mRNA灰度值的比值作為觀察指標(biāo),做統(tǒng)計(jì)學(xué)分析。
6 統(tǒng)計(jì)學(xué)處理
數(shù)據(jù)均用均數(shù)±標(biāo)準(zhǔn)差(ˉx±s)表示,采用SPSS 13.0軟件對數(shù)據(jù)進(jìn)行統(tǒng)計(jì)學(xué)分析,完全隨機(jī)設(shè)計(jì),運(yùn)用兩組間比較的秩和檢驗(yàn),以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
1 病理診斷結(jié)果
按照世界衛(wèi)生組織(WHO)對腦細(xì)胞瘤分級的診斷標(biāo)準(zhǔn),結(jié)果顯示:星形細(xì)胞瘤Ⅰ級5例,星形細(xì)胞瘤Ⅱ級17例,間變性星形細(xì)胞瘤(Ⅲ級)19例,膠質(zhì)母細(xì)胞瘤(Ⅳ級)14例,見圖1。
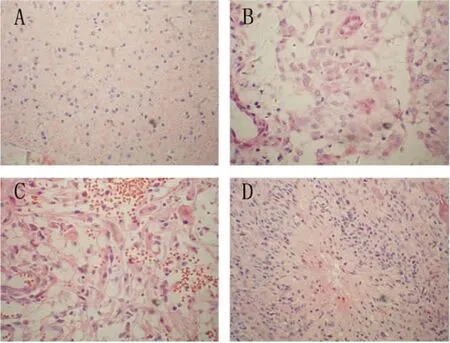
Figure 1.Different pathological grades of the astrocytoma samples(HE staining,×400).A:astrocytoma(WHO gradeⅠ);B:astrocytoma(WHO gradeⅡ);C:anaplastic astrocytoma(WHO gradeⅢ);D:glioblastoma(WHO gradeⅣ).圖1 星形細(xì)胞瘤標(biāo)本的病理分級
2 AQP4和AQP8的免疫組織化學(xué)結(jié)果
對照組中AQP8主要表達(dá)在神經(jīng)元和少量星形細(xì)胞細(xì)胞內(nèi),各病理級別星形細(xì)胞瘤組織中AQP4和AQP8主要表達(dá)在瘤性星形細(xì)胞的胞膜和胞質(zhì)內(nèi)。圖像分析結(jié)果顯示,和對照組比較,低級別(Ⅰ~Ⅱ級)腫瘤組織中AQP4表達(dá)減少(P<0.05),高級別(Ⅲ~Ⅳ級)腫瘤組織中AQP4表達(dá)增多(P<0.05);而低級別腫瘤組織中AQP8的表達(dá)明顯增多(P<0.05),高級別腫瘤組織中AQP8的表達(dá)進(jìn)一步增強(qiáng)(P<0.05);低級別(WHOⅠ~Ⅱ級)腫瘤組織之間、高級別(WHOⅢ~Ⅳ級)腫瘤組織之間比較,AQP4和AQP8表達(dá)均無明顯差異(P>0.05),見圖2、3和表1。
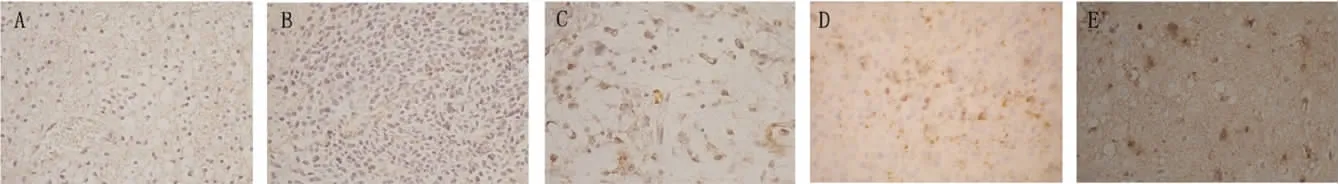
Figure 2.The immunohistochemical staining of AQP4( ×400).A:astrocytoma(WHO gradeⅠ);B:astrocytoma(WHO gradeⅡ);C:anaplastic astrocytoma(WHO gradeⅢ);D:glioblastoma(WHO gradeⅣ);E:control group.圖2 免疫組化染色顯示AQP4的分布
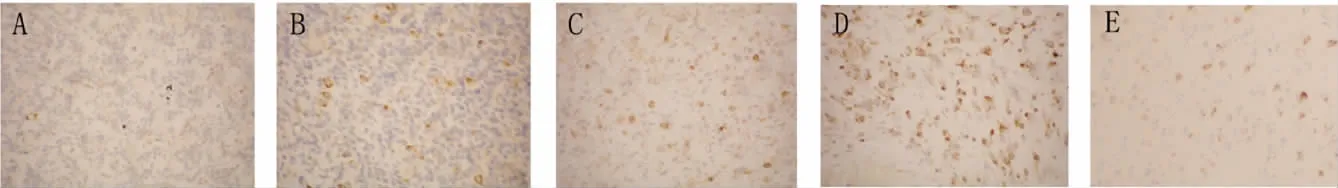
Figure 3.The immunohistochemical staining of AQP8( ×400).A:astrocytoma(WHO gradeⅠ);B:astrocytoma(WHO gradeⅡ);C:anaplastic astrocytoma(WHO gradeⅢ);D:glioblastoma(WHO gradeⅣ);E:control group.圖3 免疫組化染色顯示AQP8的分布
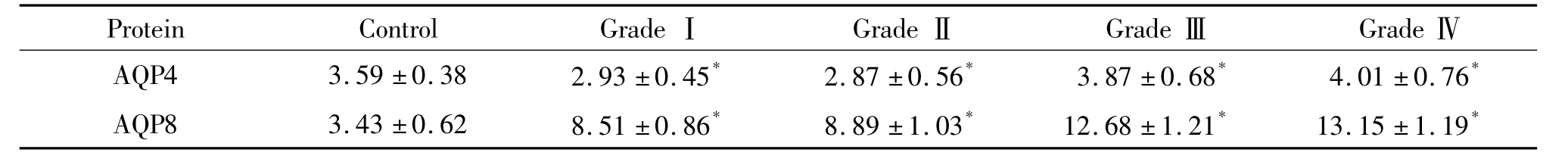
表1 對照組和各不同病理級別星形細(xì)胞瘤組織中AQP4和AQP8的免疫組化染色Table 1.The IA of AQP4 and AQP8 positive cells in control group and astrocytoma tissues of various pathological grades(IA.ˉx±s.n=9)
3 AQP4和AQP8及其mRNA的含量變化
Western blotting與RT-PCR結(jié)果一致顯示,在對照組及各腫瘤組織中均可看到AQP4和AQP8及其mRNA特定的免疫陽性反應(yīng)產(chǎn)物。條帶分析及統(tǒng)計(jì)學(xué)結(jié)果顯示,隨腫瘤病理級別的升高,AQP4及其mRNA在低級別腫瘤組織(WHOⅠ~Ⅱ級)中表達(dá)減少(P<0.05),而在高級別腫瘤組織(WHOⅢ~Ⅳ級)中表達(dá)增強(qiáng),和對照組及低級別腫瘤組織(WHOⅠ~Ⅱ級)比較,P<0.05。AQP8及其 mRNA在低級別腫瘤組織表達(dá)增強(qiáng)(P<0.05),在高級別腫瘤組織中表達(dá)進(jìn)一步增強(qiáng),和對照組及低級別腫瘤組織(WHOⅠ~Ⅱ級)比較,P<0.05。AQP4和 AQP8在低級別腫瘤組織之間、高級別腫瘤組織之間分別比較,P >0.05,見圖4、5。
討 論
1 AQP4在星形細(xì)胞瘤中的作用
AQP4是哺乳動物腦內(nèi)主要的水通道蛋白,首次在大鼠肺臟被克隆[3];AQP4廣泛分布于脊髓、視網(wǎng)膜、內(nèi)耳及骨骼肌等興奮性組織[4-6]中的神經(jīng)支持細(xì)胞,如:中樞神經(jīng)系統(tǒng)的星形膠質(zhì)細(xì)胞和室管膜細(xì)胞,視網(wǎng)膜 Müller膠質(zhì),內(nèi)耳 Hensen's、Claudius和內(nèi)溝細(xì)胞等。在腦內(nèi),AQP4多集中在毛細(xì)血管周圍的膠質(zhì)細(xì)胞終足膜、膠質(zhì)界膜、室管膜細(xì)胞及室管膜下的星形細(xì)胞,主要控制腦內(nèi)水的流動,促使星形膠質(zhì)細(xì)胞遷移,改變神經(jīng)元活性。AQP4在星形膠質(zhì)細(xì)胞膜的極化分布與血管內(nèi)皮細(xì)胞向星形細(xì)胞傳遞信號有關(guān)。AQP4不僅是一種通道蛋白,而且還是一種滲透壓感受器,它除了調(diào)節(jié)腦組織的水代謝之外還可能在腦脊液形成和細(xì)胞容積變化方面具有重要作用[7];另外[8],AQP4 和 Kir4.1 在功能方面相互作用,參與星形膠質(zhì)細(xì)胞膜上水的轉(zhuǎn)運(yùn)和鉀離子的虹吸。
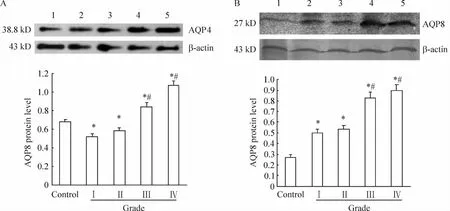
Figure 4.Expression of AQP4(A)and AQP8(B)proteins in human astrocytoma tissues of various pathological grades and control group.1:control group;2:astrocytoma(WHO gradeⅠ);3:astrocytoma(WHO gradeⅡ);4:anaplastic astrocytoma(WHO grade Ⅲ);5:glioblastoma(WHO gradeⅣ).ˉx±s.n=9.*P<0.05 vs control;#P<0.05 vs gradeⅠorⅡ.圖4 星形細(xì)胞瘤組織中AQP4和AQP8蛋白的表達(dá)
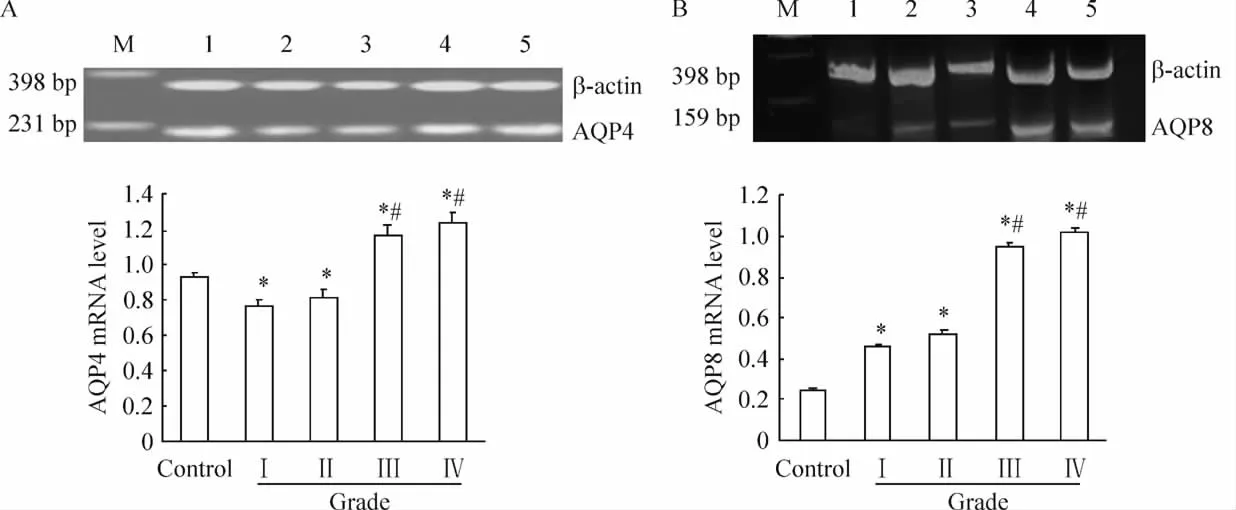
Figure 5.Expression of AQP4(A)and AQP8(B)mRNA.M:marker;1:control group;2:astrocytoma(WHO gradeⅠ);3:astrocytoma(WHO gradeⅡ);4:anaplastic astrocytoma(WHO gradeⅢ);5:glioblastoma(WHO gradeⅣ).ˉx±s.n=9.*P<0.05 vs control;#P <0.05 vs gradeⅠorⅡ.圖5 星形細(xì)胞瘤組織中AQP4和AQP8 mRNA的表達(dá)
Saadoun等[9]應(yīng)用免疫組化在5例患者腦腫瘤組織(沒有進(jìn)行病理分級)中發(fā)現(xiàn)AQP4表達(dá)減弱,Warth等[10]又在高級別星形細(xì)胞瘤中發(fā)現(xiàn)AQP4高表達(dá);關(guān)于AQP4在不同病理級別的星形細(xì)胞瘤組織中的表達(dá)情況尚未見報(bào)道。本實(shí)驗(yàn)結(jié)果顯示AQP4在低級別星形膠質(zhì)瘤組織中表達(dá)減少,而在高級別腫瘤組織中表達(dá)增強(qiáng),與Saadoun和Warth的結(jié)果相符合。AQP4在低級別腫瘤組織中呈現(xiàn)胞內(nèi)及胞膜弱表達(dá),提示低級別星形細(xì)胞瘤細(xì)胞可能出現(xiàn):(1)AQP4生成減少;(2)AQP4錨定機(jī)制損傷,重新分布。AQP4在高級別星形細(xì)胞瘤組織中的表達(dá)升高可能與腫瘤細(xì)胞在快速增殖生長過程中的水轉(zhuǎn)運(yùn)有關(guān),然而這些推測尚須進(jìn)一步通過實(shí)驗(yàn)加以驗(yàn)證。
2 AQP8在星形細(xì)胞瘤中的作用
AQP8作為水通道蛋白家族成員之一,主要分布在消化道上皮細(xì)胞(特別是結(jié)腸)、肝及胰腺以及男性和女性生殖系統(tǒng),但其功能至今仍不甚清楚。人AQP8 cDNA編碼261個(gè)氨基酸,其74.1%和大鼠AQP8同源,76%和小鼠同源。AQP8基因含有5個(gè)內(nèi)含子,外顯子-內(nèi)含子分界點(diǎn)和其它哺乳動物不同,這可能和種系發(fā)生有關(guān)。人AQP8位于染色體16p12 位點(diǎn)[11]。實(shí)驗(yàn)顯示[12],在分離純化的大鼠AQP8、人AQP8和小鼠AQP8蛋白中,人AQP8轉(zhuǎn)運(yùn)水分子和氨,不轉(zhuǎn)運(yùn)甘油和尿素,其可能在酸堿平衡中發(fā)揮重要作用。Su等[13]利用AQP8基因敲除小鼠,發(fā)現(xiàn)AQP8缺失可以通過減少卵泡細(xì)胞的凋亡而增加成熟卵泡細(xì)胞的數(shù)量。在原發(fā)性羊水過多時(shí)[14],羊膜上的AQP8表達(dá)增加,而在胎盤卻表達(dá)下降,提示AQP8在調(diào)節(jié)羊水體積方面起了重要作用。
肝細(xì)胞主要表達(dá)AQP8,AQP8起初位于胞內(nèi)囊泡,在雙丁酰 cAMP的誘導(dǎo)下,重新定位至漿膜上[15]。胰高血糖素可誘導(dǎo)劑量依賴性的漿膜AQP8表達(dá)上調(diào),同時(shí)胞內(nèi)膜AQP8的下降,表明AQP8從胞內(nèi)囊泡到漿膜的再分布。有文獻(xiàn)報(bào)道,正常肝細(xì)胞通過AQP依賴的水轉(zhuǎn)運(yùn)快速對滲透壓變化作出反應(yīng),從而遭遇凋亡后的細(xì)胞死亡結(jié)局;在原代培養(yǎng)的雞肝細(xì)胞膜上,30 mmol/L的高糖即可增加AQP8的轉(zhuǎn)位(從胞內(nèi)膜移動到胞漿膜),并呈濃度依賴性,30 mmol/L甘露醇沒有影響 AQP8 轉(zhuǎn)位[16];Magdeldin等[17]研究表明,actin相關(guān)蛋白家族可能參與調(diào)節(jié)AQP8分泌小泡遷移并整合到細(xì)胞膜的過程。與正常肝細(xì)胞相比,肝細(xì)胞癌AQP8和AQP9表達(dá)明顯下調(diào)[18],AQP8和AQP9過表達(dá)可促進(jìn)肝細(xì)胞的凋亡。上述結(jié)果提示,AQP8轉(zhuǎn)位至胞膜時(shí),可發(fā)揮其水分子快速轉(zhuǎn)運(yùn)的能力。Calamita等[21]的實(shí)驗(yàn)研究表明:AQP8介導(dǎo)的水轉(zhuǎn)運(yùn)在線粒體快速腫脹過程中起著非常重要的作用。
盡管水分子進(jìn)出線粒體的運(yùn)動對維持其形態(tài)和功能十分重要,然而水分子通過線粒體內(nèi)膜的分子機(jī)制仍然不清楚。資料顯示[19],線粒體決定細(xì)胞的生死狀態(tài)。在生理?xiàng)l件下,AQP8和AQP9表達(dá)在不同組織細(xì)胞的線粒體內(nèi)膜上(包括肝、腎和腦),調(diào)節(jié)水分子和代謝底物的轉(zhuǎn)運(yùn),參與凋亡刺激引起的滲透膨脹。實(shí)驗(yàn)發(fā)現(xiàn)[20],AQP8介導(dǎo)的線粒體對甲酰胺的轉(zhuǎn)運(yùn)能力高于對水的轉(zhuǎn)運(yùn),表明線粒體內(nèi)膜上AQP8的主要作用是轉(zhuǎn)運(yùn)氨。凋亡作為保守的細(xì)胞過程,最早的形態(tài)學(xué)特征之一是顯著的細(xì)胞皺縮(AVD)。于 AVD期間,在 Na+/K+ATP酶抑制之后,Na+、K+被擠出細(xì)胞,胞外Na+堆積,細(xì)胞內(nèi)外離子濃度發(fā)生變化,從而形成一個(gè)滲透梯度,激活A(yù)QPs其它成員(如:AQP4的表達(dá)),介導(dǎo)細(xì)胞內(nèi)水分子外流,最終導(dǎo)致細(xì)胞皺縮。
Fischer等[22]發(fā)現(xiàn),AQP8 分布在正常結(jié)腸上皮細(xì)胞的腔面,而在結(jié)腸癌組織中,AQP8沒有或極少表達(dá)。由此可見,AQP8在細(xì)胞內(nèi)、外水電解質(zhì)分布失衡的過程中,具有重要作用,其過表達(dá)可促進(jìn)細(xì)胞凋亡,而在腫瘤細(xì)胞,AQP8表達(dá)下調(diào),則可維持腫瘤細(xì)胞的增殖與生長。然而,本實(shí)驗(yàn)結(jié)果表明,在星形細(xì)胞瘤組織中,AQP8大量分布在瘤細(xì)胞的胞膜和胞漿內(nèi),這可能與AQP8的合成增多有關(guān);AQP8的表達(dá)和腫瘤病理級別相關(guān):與對照組相比較,AQP8在低級別腫瘤組織中表達(dá)上調(diào),在高級別腫瘤組織中表達(dá)進(jìn)一步增強(qiáng)。推測腫瘤細(xì)胞在增殖的過程中,體積增大,含水量增加;水通道蛋白在快速轉(zhuǎn)運(yùn)水分子的同時(shí),腫瘤細(xì)胞可獲取大量營養(yǎng)物質(zhì)和必需的生長因子以備增殖[23]。
由此看來,在不同部位,AQP8的分布具有差異性;在不同病理生理?xiàng)l件下,AQP8的表達(dá)同樣具有差異性;在細(xì)胞的生長去向過程中,AQP8究竟促使其走向凋亡還是永生化,其作用機(jī)制值得進(jìn)一步研究。
(致謝:感謝重慶醫(yī)科大學(xué)第一附屬醫(yī)院神經(jīng)外科孫曉川教授、何朝輝博士和第三軍醫(yī)大學(xué)大坪醫(yī)院神經(jīng)外科沈光建教授在標(biāo)本采集方面給予的幫助。)
[1] Benfenati V,F(xiàn)erroni S.Water transport between CNS compartments:functional and molecular interactions between aquaporins and ion channels[J].Neuroscience,2010,168(4):926 -940.
[2] 陳祎招,徐如祥,楊志林,等.膠質(zhì)瘤細(xì)胞對血腦屏障水通道表達(dá)的影響[J].中國病理生理雜志,2003,19(7):897-901.
[3] Hasegawa H,Ma T,Skach W,et al.Molecular cloning of a mercurial-insensitive water channel expressed in selected water- transporting tissues[J].JBiol Chem,1994,269(8):5497-5500.
[4] Li J,Patil RV,Verkman AS.Mildly abnormal retinal function in transgenic mice without Müller cell aquaporin- 4 water channels[J].Invest Ophthalmol Vis Sci,2002,43(2):573-579.
[5] Li J,Verkman AS.Impaired hearing in mice lacking aquaporin - 4 water channels[J].J Biol Chem,2001,276(33):31233-31237.
[6] Oshio K,Binder DK,Yang B,et al.Expression of aquaporin water channels in mouse spinal cord[J].Neuroscience,2004,127(3):685 -693.
[7] 李燕華,孫善全.低滲液對AQP4蛋白在體外培養(yǎng)星形膠質(zhì)細(xì)胞中的表達(dá)變化[J].中國急救醫(yī)學(xué),2004,24(2):87-90.
[8] Nagelhus EA,Mathiisen TM,Ottersen OP.Aquaporin-4 in the central nervous system:cellular and subcellular distribution and coexpression with KIR4.1[J].Neuroscience,2004,129(4):905 -913.
[9] Saadoun S,Papadopoulos MC,Krishna S.Water transport becomes uncoupled from K+siphoning in brain contusion,bacterial meningitis,and brain tumours:immunohistochemical case review[J].J Clin Pathol,2003,56(12):972-975.
[10] Warth A,Mittelbronn M,Wolburg H.Redistribution of the water channel protein aquaporin-4 and the K+channel protein Kir4.1 differs in low- and high-grade human brain tumors[J].Acta Neuropathol,2005,109(4):418-426.
[11] Koyama N,Ishibashi K,Kuwahara M,et al.Cloning and functional expression of human aquaporin8 cDNA and analysis of its gene[J].Genomics,1998,54(1):169 -172.
[12] Liu K,Nagase H,Huang CG,et al.Purification and functional characterization of aquaporin - 8[J].Biol Cell,2006,98(3):153 -161.
[13] Su W,Qiao Y,Yi F,et al.Increased female fertility in aquaporin 8 - deficient mice[J].IUBMB Life,2010,62(11):852-857.
[14] Zhu X,Jiang S,Hu Y,et al.The expression of aquaporin 8 and aquaporin 9 in fetal membranes and placenta in term pregnancies complicated by idiopathic polyhydramnios[J].Early Hum Dev,2010,86(10):657 -663.
[15] Gradilone SA,García F,Huebert RC,et al.Glucagon induces the plasma membrane insertion of functional aquaporin - 8 water channels in isolated rat hepatocytes[J].Hepatology,2003,37(6):1435 -1441.
[16] Suh HN,Lee SH,Lee MY,et al.High glucose induced translocation of Aquaporin8 to chicken hepatocyte plasma membrane:involvement of cAMP, PI3K/Akt, PKC,MAPKs,and microtubule[J].JCell Biochem,2008,103(4):1089-1100.
[17] Magdeldin S,Li H,Yoshida Y,et al.Comparison of two dimensional electrophoresis mouse colon proteomes before and after knocking out Aquaporin 8[J].J Proteomics,2010,73(10):2031-2040.
[18] Jablonski EM,Mattocks MA,Sokolov E,et al.Decreased aquaporin expression leads to increased resistance to apoptosis in hepatocellular carcinoma[J].Cancer Lett,2007,250(1):36-46.
[19] Lee WK,Thévenod F.A role for mitochondrial aquaporins in cellular life-and-death decisions? [J].Am J Physiol Cell Physiol,2006,291(2):C195 - C202.
[20] Soria LR,F(xiàn)anelli E,Altamura N,et al.Aquaporin-8-facilitated mitochondrial ammonia transport[J].Biochem Biophys Res Commun,2010,393(2):217 -221.
[21] Calamita G,F(xiàn)erri D,Gena P,et al.The inner mitochondrial membrane has aquaporin-8 water channels and is highly permeable to water[J].J Biol Chem,2005,280(17):17149-17153.
[22] Fischer H,Stenling R,Rubio C,et al.Differential expression of aquaporin 8 in human colonic epithelial cells and colorectal tumors[J].BMC Physiol,2001,1:1.
[23] Jablonski EM,Webb AN,McConnel NA,et al.Plasma membrane aquaporin activity can affect the rate of apoptosis but is inhibited after apoptotic volume decrease[J].Am JPhysiol Cell Phsiol,2004,286(4):C975-C985.

