Mn-Zr-O催化劑的制備及其催化苯甲醇氧化反應的活性
湯清虎,劉婷婷,吳成明,裴曉燕,趙培正
(河南師范大學 化學化工學院 綠色化學介質與反應省部共建教育部重點實驗室,河南 新鄉 453007)
Mn-Zr-O催化劑的制備及其催化苯甲醇氧化反應的活性
湯清虎,劉婷婷,吳成明,裴曉燕,趙培正
(河南師范大學 化學化工學院 綠色化學介質與反應省部共建教育部重點實驗室,河南 新鄉 453007)
采用氧化還原沉淀法制備了一系列不同n(Mn)∶n(Zr)的Mn-Zr-O催化劑,并以分子氧為氧化劑,催化苯甲醇氧化反應。實驗結果表明,當n(Mn)∶n(Zr)=3∶1時,催化劑的活性最高。在100 ℃下反應1 h,苯甲醇的轉化率達88.3%,催化劑的質量比活性(單位質量催化劑上單位時間內的苯甲醇轉化量)為17.7 mmol/(g·h)。XRD、N2物理吸附、XANES及H2-TPR表征結果顯示,以+3和+4價共存的非晶態Mn氧化物是活化分子氧氧化苯甲醇的高活性物種,添加Zr能增加催化劑的比表面積,促進Mn氧化物的還原,從而顯著提高催化劑在苯甲醇氧化反應中的活性。
錳-鋯-氧催化劑;苯甲醇;氧化;分子氧;苯甲醛
從環境友好和實現可持續發展現代化學過程的角度考慮,開發使用固體催化劑和以氧氣為氧化劑的綠色選擇氧化醇的方法具有重要的科學意義[1]。世界各國的許多研究組[2-4]相繼報道了利用負載或限域的單、雙金屬或納米Ru,Pd,Au等為催化劑的醇氧化反應。盡管以Ru,Pd,Au等貴金屬為活性組分的固體催化劑效率較高、性能穩定,但其制備成本高、價格昂貴。從經濟性和實際應用角度考慮,開發以低成本的非貴金屬為活性組分的固體催化劑具有重要價值。一些過渡金屬(如Ni,V,Cu,Mn等)已吸引了國內外許多研究組的關注[5-14]。其中,以Mn為主要活性組分的固體催化劑被認為是最具發展潛力的研究方向[8]。Suib等[8]報道,一種具有隱鉀錳礦型結構的Mn復合氧化物(OMS-2)能高選擇性催化氣相氧分子與芐醇、烯丙基醇及脂肪醇的液相選擇氧化反應。MnOx也常用做催化苯甲醇選擇氧化反應的活性組分[12-14]。
本工作研究了非晶態Mn-Zr-O催化劑的制備及其在苯甲醇氧化反應中的催化性能,并采用XRD、N2物理吸附、XANES及H2-TPR等方法對催化劑進行了表征。
1 實驗部分
1.1 催化劑的制備
采用氧化還原沉淀法[15]制備Mn-Zr-O催化劑。按照不同n(Mn)∶n(Zr)稱取50%(w)的硝酸錳溶液(AR,北京化工廠)和五水合硝酸鋯(AR,國藥集團上海化學試劑有限公司)溶于去離子水中,配成Mn-Zr混合溶液A;再按比例稱取高錳酸鉀(AR,天津市東麗區天大化學試劑廠)溶于去離子水中配成溶液B;在60 ℃、劇烈攪拌下,將溶液A逐滴加入溶液B中,并用氫氧化鉀(AR,天津市化學試劑三廠)溶液(0.2 mol/L)調節溶液的pH≈8.0。待滴加完畢后,繼續攪拌1 h。經過濾、洗滌、110 ℃下干燥12 h,制得Mn-Zr-O催化劑試樣,記為MaZb。其中,M表示Mn元素,Z表示Zr元素,n(Mn)∶n(Zr)=a∶b。為便于比較,采用傳統共沉淀法制備了n(Mn)∶n(Zr)=3∶1、110 ℃下干燥的Mn-Zr-O催化劑試樣,記為M3Z1-CP。
1.2 催化劑的表征
N2物理吸附實驗采用Quantachrome公司AAuuu---tosorb 6型物理吸附儀。將試樣預先在110 ℃下真空脫氣3 h,試樣的比表面積由標準BET法計算。XRD表征采用Bruker公司D8 Advance型粉末X射線衍射儀,CuKα射線,管電壓40 kV,管電流40 mA。XANES表征采用新加坡同步離子加速光束線上的XAS實驗工作站,以雙晶Si(111) 為單色器,儲存環電子能量約為700 MeV,平均環電流為200 mA,采用透射模式測定粉末試樣的K邊吸收譜。H2-TPR實驗在配有熱導檢測器的流動系統中進行。稱取100 mg試樣置于石英反應管中,在110℃的20%(φ)O2-80%(φ)N2氣流中處理3 h后通入純N2,當溫度降至低于50 ℃時切換為5%(φ)H2-95%(φ)Ar混合氣(30 mL/min),待基線平穩后進行TPR測試,升溫速率為8 ℃/min。
1.3 催化劑的活性評價
苯甲醇氧化反應在常壓浴式反應器中進行。將2 mmol苯甲醇(AR,上海試劑一廠)裝入三頸燒瓶(50 mL)中,再加入一定量的催化劑。反應開始時,將O2由導氣管通入反應液液面以下,通過穩流閥控制O2流量,使O2以鼓泡方式進入反應液中。反應溫度由油浴控制,溫度波動范圍為±1 ℃。液體反應產物由上海海欣色譜儀器有限公司GC-920型氣相色譜儀分析,DB-5毛細管柱,FID檢測。
反應結束后,離心除去液體,回收催化劑,并依次用丙酮(AR,天津市德恩化學試劑有限公司)、氫氧化鉀溶液(0.2 mol/L)及去離子水洗滌,再經110 ℃干燥12 h后重復使用。
2 結果與討論
2.1 催化劑的表征結果
不同試樣的XRD譜圖見圖1。由圖1可看出,ZrO2試樣在2θ=32°處出現較寬的非晶態ZrO2的特征衍射峰;MnOx試樣在2θ=12°,25°,37°,66°處出現Mn7O13·5H2O的特征衍射峰,這表明MnOx以非晶態形式存在。對于M3Z1和M1Z1試樣,除呈現類似于非晶態MnOx和ZrO2的特征衍射峰外,未發現晶態MnOx和ZrO2的特征衍射峰,這說明Mn-Zr-O試樣中的MnOx和ZrO2均以非晶態形式存在。但傳統沉淀法制備的M3Z1-CP試樣的XRD譜圖中,能明顯觀察到Mn3O4的特征衍射峰,這表明該試樣中存在大量聚集態的Mn3O4。
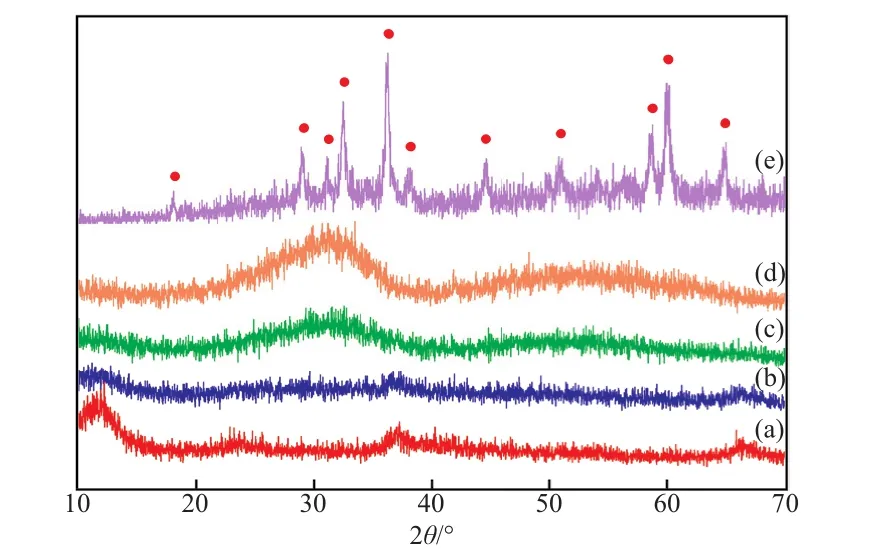
圖1 不同試樣的XRD譜圖Fig.1 XRD patterns of different samples.
表1為不同試樣的比表面積。從表1可看出,MnOx試樣的比表面積僅為73 m2/g,M15Z2試樣的比表面積為94 m2/g,這說明添加Zr能顯著提高Mn-Zr-O試樣的比表面積。隨n(Mn)∶n(Zr)的減小,Mn-Zr-O試樣的比表面積先逐漸增大而后有所減小,當n(Mn)∶n(Zr)=1∶1時,達到最大值262 m2/g。從表1還可看出,與氧化還原沉淀法制備的相同n(Mn)∶n(Zr)的試樣相比,采用傳統共沉淀法制備的M3Z1-CP試樣的比表面積明顯偏低。
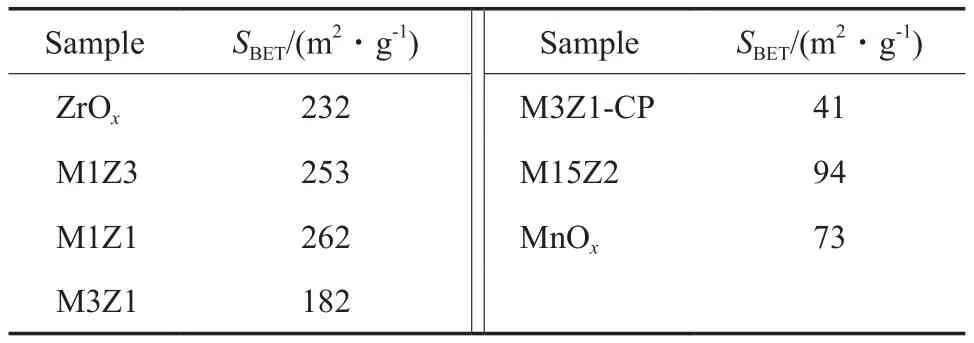
表1 不同試樣的比表面積Table 1 Specific surface areas(SBET) of different samples
圖2是Mn-Zr-O試樣及參比試樣的MnK邊XANES譜圖。根據圖2和文獻[16]報道的方法可求得相應試樣的MnK邊界能及其對應的價態(見圖3)。

圖2 不同試樣的Mn K邊XANES譜圖Fig.2 Mn K-edge XANES spectra of different samples.
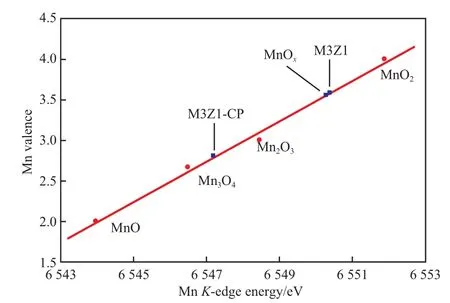
圖3 試樣的Mn K邊界能與其對應的價態Fig.3 Mn valance as a function of Mn K-edge energy.
由圖3可看出,MnOx和M3Z1試樣中Mn的平均價態分別為3.56和3.60,說明兩試樣中的Mn均以Mn3+和Mn4+共存形式存在;M3Z1-CP試樣中Mn的平均價態為2.81,說明試樣中的Mn主要以Mn2+和Mn3+共存形式存在,這與XRD表征結果相吻合。
圖4為不同試樣的H2-TPR譜圖。從圖4可看出,在ZrO2試樣的H2-TPR譜圖中未出現明顯的還原峰,說明ZrO2試樣在700 ℃以下不能被還原。MnOx試樣的還原發生在151~346 ℃之間,主還原峰位于303 ℃附近。在Mn中添加Zr后,M3Z1試樣的還原峰明顯變寬,主還原峰(295 ℃)明顯向低溫方向移動,這說明Mn與Zr之間存在較強的相互作用,添加Zr能促使MnOx的還原。采用傳統共沉淀法制備的M3Z1-CP試樣的還原主要發生在375 ℃附近,在初始還原階段還出現一個小肩峰。
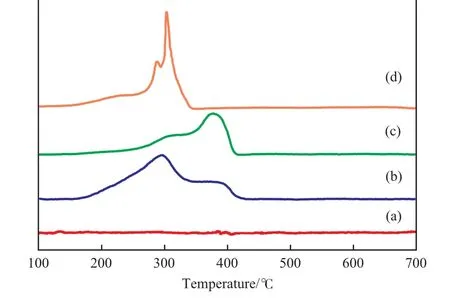
圖4 不同試樣的H2-TPR譜圖Fig.4 H2-TPR profiles of different samples.
當Mn2+在堿性溶液中發生水解時,首先生成的是乳白色的無定形Mn(OH)2沉淀(見式(1)),該沉淀會被空氣逐漸氧化為棕色的MnOOH沉淀(見式(2))。因此,Mn2+在空氣中沉淀時將形成Mn(OH)2和MnOOH的混合物。在陳化過程中,這一混合物將在空氣中進一步氧化形成結晶Mn3O4(見式(3))。
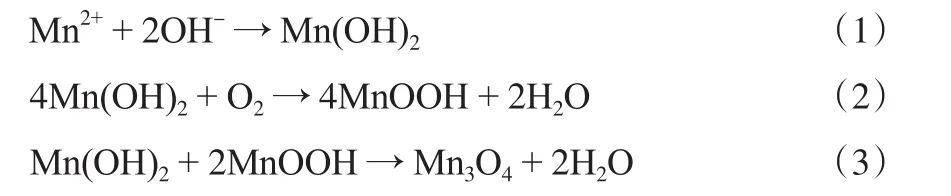
結合XRD和XANES表征結果,推測M3Z1-CP試樣在375 ℃處的還原峰可能對應于試樣中聚集態Mn3O4的還原,而在310 ℃附近的肩峰則可能對應于試樣中少量MnOOH的還原。
2.2 催化苯甲醇氧化反應的性能
表2為不同催化劑對苯甲醇氧化反應的催化性能。由表2可看出,單純的ZrO2幾乎無活性;隨n(Mn)∶n(Zr)的增加,苯甲醇的轉化率和催化劑的質量比活性(單位質量催化劑上單位時間內的苯甲醇轉化量)均呈先增加而后降低的趨勢。當n(Mn)∶n(Zr)=3∶1時,苯甲醇的轉化率和催化劑的質量比活性達到最大值。由此可見,適當n(Mn)∶n(Zr)的復合氧化物比任一單純氧化物具有更好的催化性能。與氧化還原沉淀法制備的相同n(Mn)∶n(Zr)的M3C1催化劑相比,采用共沉淀法制備的M3C1-CP催化劑的活性明顯降低。XRD,XANES,H2-TPR表征結果顯示,在M3C1-CP催化劑中存在大量聚集態Mn3O4,聚集態Mn3O4的低活性是導致該催化劑活性低的主要原因。在相似的反應條件下,MnOx-110和OMS-2催化劑的質量比活性分別為9.7,5.9 mmol/(g·h)[12]。由此可見,M3Z1催化劑具有更高的活性。
Mn氧化物是一種應用廣泛的化學計量比氧化劑,根據Mn氧化物催化劑上醇氧化反應遵循的氧化-還原機理[17],Mn-Zr-O催化劑中的晶格氧也能化學計量地與苯甲醇反應生成苯甲醛。在Ar氣氛中的空白實驗結果表明,每克M3Z1催化劑能化學計量地與4.1 mmol的苯甲醇反應。這一數值遠小于在O2氣氛中反應時的17.7 mmol/g,說明M3Z1催化劑是醇氧化反應的催化劑而不是化學計量比氧化劑。此外,在不同O2分壓下的苯甲醇氧化反應結果(見圖5)表明,當O2分壓由0.02 MPa提高到0.10 MPa時,苯甲醇氧化反應的質量比活性從11.6 mmol/(g·h)提高到17.7 mmol/(g·h),這進一步說明M3Z1催化劑催化了氣相分子氧與苯甲醇的氧化反應。
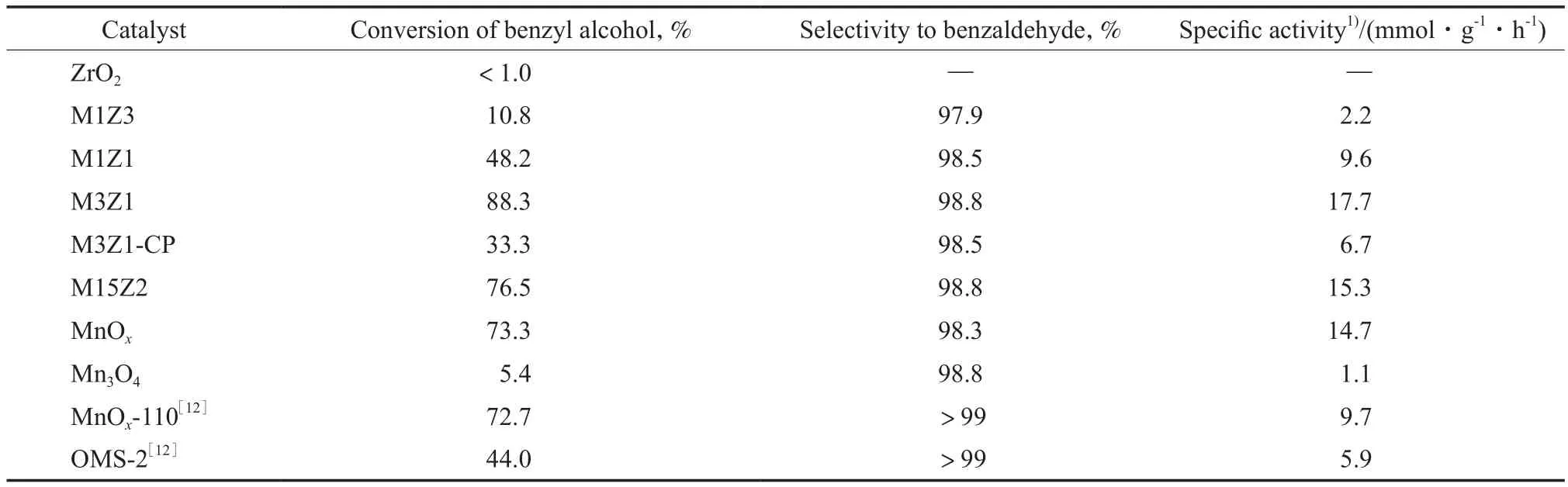
表2 不同催化劑對苯甲醇氧化反應的催化性能Table 2 Oxidation of benzyl alcohol with O2 catalyzed by different catalysts
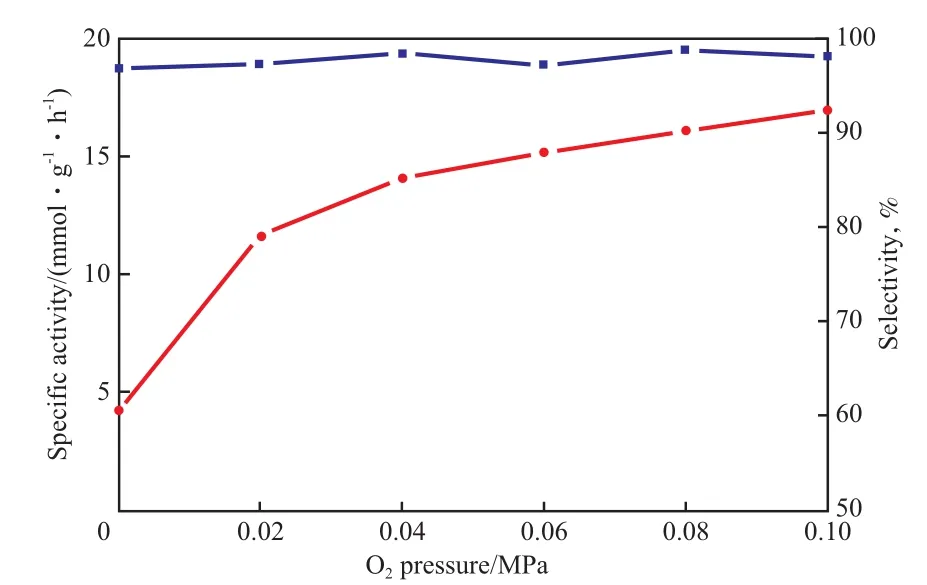
圖5 O2分壓對M3Z1催化劑上苯甲醇氧化反應性能的影響Fig.5 Effects of O2 pressure on catalytic performances of M3Z1 catalyst for the oxidation of benzyl alcohol.
2.3 催化劑的穩定性
對反應后經過濾得到的溶液進行分析,未檢測到Mn和Zr,說明在反應過程中Mn-Zr-O催化劑未發生溶解。對反應后經離心、洗滌和干燥后回收的試樣中的Mn和Zr含量進行測定,發現與新鮮催化劑中的Mn和Zr含量基本相同,說明反應過程中活性組分未發生流失。將反應后的濾液作為催化劑代替固體催化劑繼續反應,苯甲醇的轉化率沒有明顯增加。這些結果說明氧化反應是在固體催化劑表面進行的。
圖6是M3Z1催化劑的循環使用實驗結果。從圖6可看出,催化劑第一次使用時,苯甲醇的轉化率為88.3%,苯甲醛的選擇性為98.8%;當第二次使用時,苯甲醇的轉化率下降到67.6%,苯甲醛的選擇性保持不變。繼續循環使用時,苯甲醇的轉化率和苯甲醛的選擇性基本保持不變。這一結果說明Mn-Zr-O催化劑在該氧化體系中起催化和氧化的雙重作用。在O2氣氛下,大部分Mn作為催化劑活化了O2后實現了Mn的催化循環,還有一小部分Mn氧化物充當了氧化劑,被還原為較穩定的低價Mn。
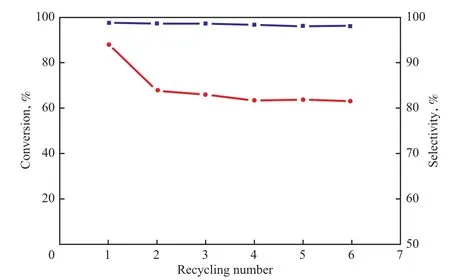
圖6 M3Z1催化劑的重復使用性能Fig.6 Reusability of M3Z1 catalyst.
3 結論
(1)氧化還原沉淀法制備的非晶態Mn-Zr-O催化劑能有效催化以分子氧為氧化劑的苯甲醇氧化反應,產物以苯甲醛為主,且該催化劑能多次重復使用。當n(Mn)∶n(Zr)=3∶1時,催化活性最高,在100 ℃下反應1 h,苯甲醇的轉化率為88.3%,催化劑的質量比活性達到17.7 mmol/(g·h)。
(2)XRD、N2物理吸附、XANES及H2-TPR表征結果顯示,以+3和+4價共存的非晶態Mn氧化物是活化分子氧氧化苯甲醇的高活性物種;添加Zr不改變Mn的氧化態,但能顯著增加催化劑的比表面積,改善Mn氧化物的氧化還原性能,從而顯著提高了催化劑在苯甲醇氧化反應中的活性。
[1] Mallat T,Baiker A. Oxidation of Alcohols with Molecular Oxygen on Solid Catalysts[J].Chem Rev,2004,104(6):3037 -3058.
[2] Hou W,Dehm N A,Robert S W J. Alcohol Oxidations in Aqueous Solutions Using Au,Pd,and Bimetallic AuPd Nanoparticle Catalysts[J].J Catal,2008,253(1):22 - 27.
[3] Hutchings G J. Nanocrystallne Gold and Gold Palladium Alloy Catalysts for Chemical Synthesis[J].Chem Commun,2008(10):1148 - 1164.
[4] 張昕,吳偉偉,黃啟權,等. 苯甲醇液相氧化制苯甲醛催化劑的研究進展[J]. 石油化工,2010,39(2):215 - 223.
[5] 吳功德,王曉麗,劉卓,等. CuNiAl類水滑石的合成及其在催化氧化苯甲醇中的應用[J]. 2009,38(9):945 - 950.
[6] Kawabata T,Shinozuka Y,Ohishi Y,et al. Nickel Containing Mg-Al Hydrotalcite-Type Anionic Clay Catalyst for the Oxidation of Alcohols with Molecular Oxygen[J].J Mol Catal A:Chem,2005,236(1/2):206 - 215.
[7] Velusamy S,Punniyamurthy T. Novel Vanadium-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones Under Atmospheric Oxygen[J].Org Lett,2005,6(2):217 - 219.
[8] Suib S L. Porous Manganese Oxide Octahedral Molecular Sieves and Octahedral Layered Materials[J].Acc Chem Res,2008,41(4):479 - 487.
[9] Choudhary V R,Chaudhari P A,Narkhede V S. Solvent-Free Liquid Phase Oxidation of Benzyl Alcohol to Benzaldehyde by Molecular Oxygen Using Non-Noble Transition Metal Containing Hydrotalcite-Like Solid Catalysts[J].Catal Commun,2003,4(4):171 - 175.
[10] Tang Qinghu,Huang Xiaonan,Wu Chengming,et a1. Structure and Catalytic Properties of K-Doped Manganese Oxide Supported on Alumina[J].J Mol Catal A:Chem,2009,306(1/2):48 - 53.
[11] Tang Qinghu,Gong Xiaonan,Wu Chengming,et a1. Insights into the Nature of Alumina-Supported MnOOH and Its Catalytic Performance in the Aerobic Oxidation of Benzyl Alcohol[J].Catal Commum,2009,10(7):1122 - l126.
[12] 胡敬,孫科強,何代平,等. 催化苯甲醇液相氧化反應的高效無定形氧化錳催化劑[J]. 催化學報,2007,28(12):1025 - 1027.
[13] Su Yang,Wang Lucun,Liu Yongmei,et al. Microwave-Accelerated Solvent-Free Selective Oxidation of Benzyl Alcohol over Efficient and Reusable Manganese Oxides[J].Catal Commun,2007,8(12):2181 - 2185.
[14] 劉鋼,張秀艷,徐躍,等. 納米孔炭負載MnOx催化劑上苯甲醇氧化反應性能[J]. 催化學報,2010,31(8):1025 - 1030.
[15] Arena F,Trunfio G,Negro J,et al. Basic Evidence of the Molecular Dispersion of MnCeOxCatalysts Synthesized via a Novel“Redox-Precipitation”Route[J].Chem Mater,2007,19(9):2269 - 2276.
[16] Ressler T,Brock S L,Wong J,et al. Structural Studies on Colloidal Tetraalkylammonium Manganese Oxides[J].J Synchrotron Rad,1999,6:728 - 730.
[17] Makwana V D,Son Y C,Howell A R,et al. The Role of Lattice Oxygen in Selective Benzyl Alcohol Oxidation Using OMS-2 Catalyst:A Kinetic and Isotope-Labeling Study[J].J Catal,2002,210(1):46 - 52.
Preparation of Mn-Zr-O Catalyst and Its Catalytic Activity in Benzyl Alcohol Oxidation
Tang Qinghu,Liu Tingting,Wu Chengming,Pei Xiaoyan,Zhao Peizheng
(College of Chemistry and Chemical Engineering,Key Laboratory of Green Chemical Media and Reactions,
Ministry of Education,Henan Normal University,Xinxiang Henan 453007,China)
A series of mixed manganese-zirconium oxide catalysts with differentn(Mn)∶n(Zr) were prepared by a redox-precipitation method. The prepared catalysts could efficiently catalyze the oxidation of benzyl alcohol with molecular oxygen to benzaldehyde as a main product. The highest activity was achieved by using a catalyst withn(Mn)∶n(Zr) of 3∶1,the conversion of benzyl alcohol and the mass specific activity were 88.3% and 17.7 mmol/(g·h) under the conditions of 1 h and 100℃,respectively. The characterization results of XRD,nitrogen physisorption,XANES and H2-TPR suggested that the key active component for the O2activation was the amorphous manganese oxide with the coexistence of Mn3+and Mn4+. The addition of zirconium to the amorphous manganese oxide can increase the BET surface areas of the catalysts and promote the reduction of the manganese oxides,so the catalytic activity is enhanced.
manganese-zirconium-oxygen catalyst;benzyl alcohol;oxidation;molecular oxygen;benzaldehyde
1000 - 8144(2012)11 - 1253 - 05
TQ 426.8
A
2012 - 05 - 08;[修改稿日期]2012 - 09 - 04。
湯清虎(1970—),男,河南省新野縣人,博士,教授,電話 0373 - 3326335,電郵 qinghutang@sina.com.cn。
河南省高校科技創新人才支持計劃項目(2010HAST IT028);國家大學生創新性實驗計劃項目(101047621)。
(編輯 安 靜)

