慢性牙周炎齦組織中Smac和Bax的表達及其對細胞凋亡的作用
馮 利,董跟喜,孫曉瑋
(甘肅蘭州730000:1.蘭州大學基礎醫學院;2.蘭州大學口腔醫學院)
線粒體(mitochondria,Mi)作為凋亡的中心環節,已在許多凋亡系統中被證實。Smac(second mitochondria-derived activator of Caspase Smac)是一種由線粒體釋放的凋亡相關蛋白,Smac表達可增加細胞對凋亡刺激的敏感性。當Mi接受凋亡信號后,Smac蛋白的Mi定位信號肽被切除,形成有活性的Smac蛋白釋放到細胞質中,可與所有凋亡抑制蛋白IAPs結合,使其喪失抑制Caspase活性的作用,從而促進凋亡[1]。Bax為促凋亡蛋白并具有多功能,主要定位于細胞質,一旦細胞受到凋亡因子的誘導后,便會從胞質移位而伸入到Mi膜中,通過寡聚化在 Mi外膜形成 Bax通道[2],促進Cyt-C、Smac/Diablo、AIF 等釋放并進入胞質,使 bcl-2與Apaf-1分離,后者可激活 Caspase,從而誘導細胞凋亡[3-4]。Smac、Bax 蛋白是細胞凋亡過程中的重要誘導基因,本文旨在探討Smac、Bax在慢性牙周炎(Chronic Periodontitis,CP)齦組織的表達及其分布的意義。
1 材料和方法
1.1 病例篩選和樣本采集
27例CP標本來自蘭州大學口腔醫學院門診病人因患牙不能保留的齦組織,其中男14例,女13例,年齡39~57歲。口內每個區有2個以上的牙牙周附著喪失≥4 mm,牙周袋﹥5 mm,X線片顯示牙槽骨吸收超過根長的1/2,牙松動。另外再從門診病人中選擇牙周健康,所有牙附著喪失≤2 mm,因阻生或錯位而拔除牙的牙齦組織作為正常對照組,共27例,男12例,女15例,年齡37~55歲。所有病例均無全身性疾病,就診前3個月內未服用抗生素和半年內未做過牙周系統治療。在病人知情同意下拔除牙齒,CP組和健康組各12例取4 mm×4 mm×4 mm牙齦組織分成3份,40 g/L多聚甲醛固定,分別用作HE染色(核實病理診斷)和免疫組化染色;另取2組各12例標本用25 mL/L戊二醛前固定,用作電鏡超薄切片處理;剩余2組各3例用于流式細胞儀檢測。
1.2 主要試劑
Smac-Diablo測定試劑盒(北京奧博森生物技術有限公司);Bax測定試劑盒(即用型)、SP-9000試劑盒(即用型)、DAB顯色劑(北京中衫金橋生物技術有限公司);羅丹明 123(RH123,Sigma)。
1.3 方法
1.3.1 HE 染色觀察
牙齦組織常規石蠟包埋,制作4 μm切片,HE染色,光鏡觀察。
1.3.2 免疫組織化學檢測Smac、Bax蛋白的表達
組織切片脫蠟水化,微波修復,蒸餾水洗,30 mL/L過氧化氫液中和內源性過氧化氫酶,PBS漂洗,滴加一抗(兔抗小鼠Smac、Bax)4℃過夜,PBS洗滌,再加生物素化二抗,37℃ 20 min,PBS洗滌,滴加SABC 37℃ 20 min,DAB顯色,蘇木素復染,鹽酸乙醇分化,脫水、透明,封片,鏡檢。以PBS代替一抗做陰性對照。
1.3.3 牙齦組織超微結構觀察
固定的牙齦組織用1/15 M PBS沖洗,10 g/L過氧化鋨液后固定,PBS漂洗,梯度乙醇脫水,浸透,EPON812包埋,熱聚合,制作超薄切片,枸櫞酸鉛和醋酸鈾染色,透射電鏡觀察。
1.3.4 流式細胞儀檢測線粒體膜電位
將新鮮牙齦組織剪碎,2.5 g/L胰蛋白酶消化(37℃),PBS終止消化,200目和400目銅篩網分別過濾,離心,收集細胞,PBS洗滌,加入終濃度為15 μg/mL 的Rh123,37℃避光孵育30 min,PBS洗滌2次,加500 μL PBS,上機檢測線粒體膜電位(△Ψm)熒光強度變化。
1.4 統計學分析
采用SPSS 17.0統計軟件進行統計分析,組間比較采用t檢驗,并對Smac、Bax兩者之間的相互關系進行linear regression分析,P<0.05為差異有統計學意義。
2 結果
2.1 牙齦組織HE染色觀察
牙周炎齦組織中上皮釘突呈網狀突起伸入結締組織中,并可見凋亡的上皮細胞(圖1);結締組織水腫,有大量炎性細胞浸潤,其中有凋亡細胞,表現為細胞核呈藍黑色,核染色質致密濃縮,核碎裂等,胞漿呈淡紅色,并分散于組織中(圖2)。膠原纖維排列紊亂,部分纖維發生斷裂。而健康牙齦組織上皮釘突較長,伸入結締組織中,炎性細胞較少,未見凋亡細胞。
2.2 牙齦組織超微結構觀察
CP齦上皮細胞、結締組織中的漿細胞、巨噬細胞和成纖維細胞有凋亡發生,膠原原纖維破壞。上皮基底凋亡細胞核固縮,核膜部分突起,線粒體有形態結構改變,粗面內質網(RER)呈空泡;凋亡的漿細胞有核染色質凝集、核周間隙寬窄不等、線粒體腫脹,空泡變等一些非特異性改變,細胞質中可見多泡體和自噬體(圖3)。凋亡的成纖維細胞核固縮,凝集成塊,聚集在核膜周邊,RER變性,形成空泡,并有RER腔擴張,壁向腔內呈乳突狀增生,形成腔內隔離;Mi內外膜融合,嵴減少且紊亂(圖4)。凋亡的巨噬細胞可見核膜突出,染色質凝集,Mi腫大,溶酶體增多等特異形態。健康齦上皮細胞、結締組織細胞的形態和結構未見凋亡現象。
2.3 牙齦組織細胞線粒體膜電位(△Ψm)
CP組織細胞△Ψm平均熒光強度(MFI=11.6±0.82),明顯低于正常組織細胞△Ψm(MFI=14.5 ±0.98),差異有統計學意義(P <0.05)。
2.4 免疫組化檢測Smac、Bax蛋白的表達
Smac、Bax蛋白的表達以細胞核不著色,胞質被染成棕黃色或淺黃色者為陽性細胞。每張切片在高倍鏡下隨機選擇5個視野進行圖像分析(BI-2000圖像分析系統)。結果顯示:正常齦組織和CP齦組織均有Smac、Bax陽性表達。在CP組織中Smac、Bax陽性表達主要位于上皮的棘細胞層和基底細胞層,炎性結締組織中可見漿細胞、巨噬細胞和成纖維細胞有陽性表達,淋巴細胞未見陽性表達(圖5~8)。CP齦組織中Smac、Bax在上皮組織、結締組織的表達增加,與正常齦組織相比差異均有顯著意義(P<0.05)(表1)。
2.5 Smac、Bax蛋白表達的相關性分析
根據平均光密度采用linear regression分析,以Bax為自變量X,Smac為應變量Y,根據散點圖的形式,經統計學處理對正常齦組織、CP齦組織的Bax、Smac指標建立linear regression模型。結果表明,在 CP組中兩者的表達具有正相關性(P <0.05)(表2)。
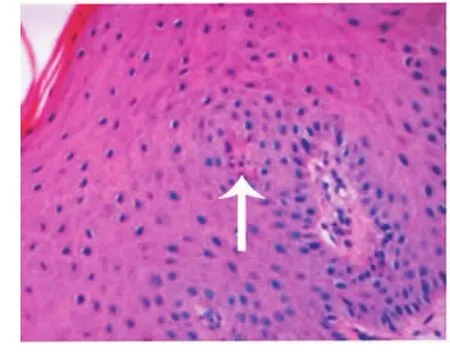
圖1 牙周炎上皮組織區凋亡的細胞(箭頭示)(HE,400×)
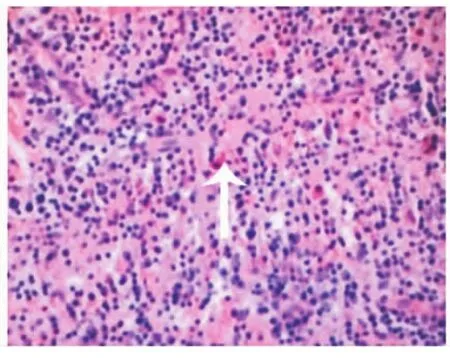
圖2 牙周炎結締組織區凋亡的細胞(箭頭示)(HE,400×)
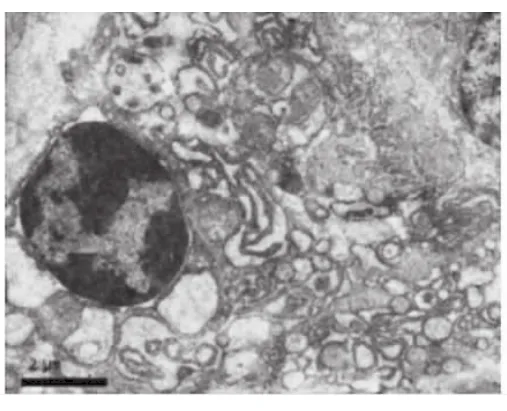
圖3 凋亡的漿細胞 染色質凝集,RER形成空泡,Mi腫脹,細胞質中可見自噬體及多泡體(8000×)
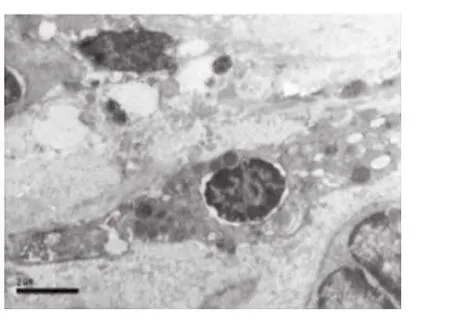
圖4 凋亡的成纖維細胞 染色質固縮,RER變性,Mi內、外膜融合,嵴減少且紊亂(10000×)
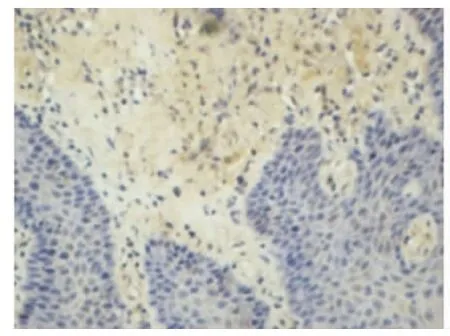
圖5 Smac在正常牙齦組織中的表達(DAB,400×)
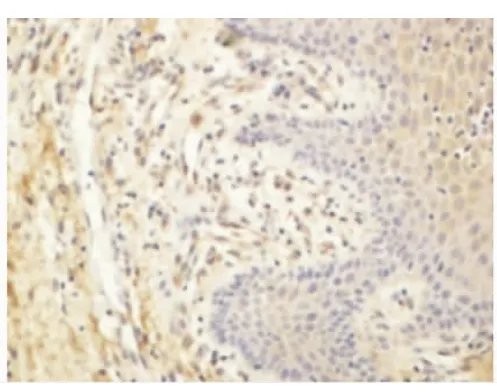
圖6 Smac在CP牙齦組織中的表達(DAB,400×)
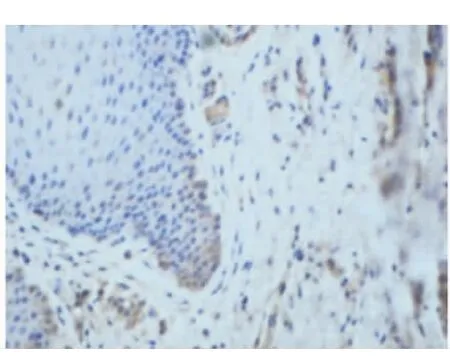
圖7 Bax在正常牙齦組織中的表達(DAB,400×)
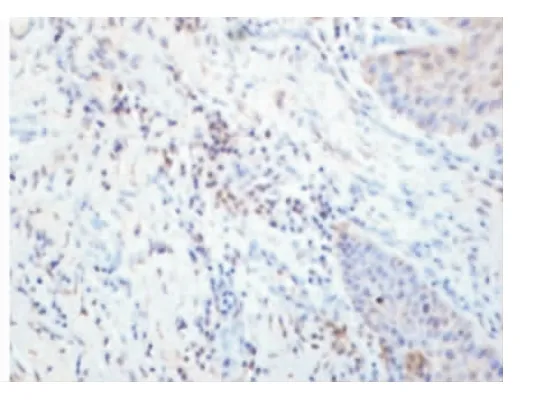
圖8 Bax在CP牙齦組織中的表達(DAB,400×)
表1 牙周組織中各測試區Smac、Bax蛋白表達的平均光密度比較(n=12,)
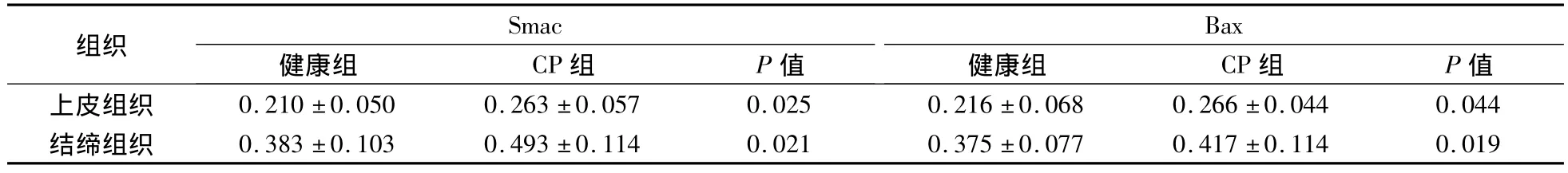
表1 牙周組織中各測試區Smac、Bax蛋白表達的平均光密度比較(n=12,)
組織Smac健康組 CP組 P值Bax健康組 CP組 P值上皮組織 0.210 ±0.050 0.263 ±0.057 0.025 0.216 ±0.068 0.266 ±0.044 0.044結締組織 0.383 ±0.103 0.493 ±0.114 0.021 0.375 ±0.077 0.417 ±0.114 0.019
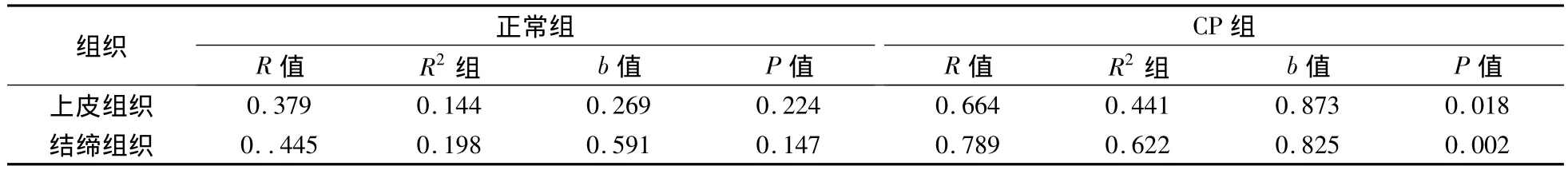
表2 牙周組織中各測試區Bax、Smac蛋白表達的平均光密度regression分析
3 討論
CP是菌斑微生物與宿主免疫反應相互作用所致的牙周組織破壞的炎癥性疾病,臨床觀察及動物實驗研究發現:牙周組織的細胞凋亡與牙周組織的炎癥反應和破壞程度呈正相關,凋亡細胞多見于炎癥細胞浸潤部位,即表淺的結合上皮和其下的結締組織[5-6],據此,本研究在光鏡下選定測試區,以便觀察牙周組織表達Smac、Bax的全貌,了解病理變化的程度。
Mi形態改變與其功能改變和細胞活力降低密切相關。①細胞凋亡早期出現△Ψm降低,這種變化早于細胞凋亡的其他特征性變化,如核DNA片段出現,所以△Ψm的正常與否可作為凋亡的特征性標志,而△Ψm的改變亦與Mi通透性變化相關;②Mi內外膜通透性的變化:△Ψm的降低提示Bax與ANT或VDAC相互作用促使MPTP(Mi permea bility transition pore,MPTP)開放,形成 Bax 通道,但當細胞凋亡時,MPTP能將Bax集中到自身周圍,使通道持續開放,跨內膜梯度消失,使呼吸鏈解耦聯,引起基質高滲腔加大,Mi空泡化,Bax與BaK在外膜形成聚集灶,引起Cyt-C、Smac等促凋亡因子的釋放,進而引起細胞凋亡[7]。本結果顯示:牙周炎組的△Ψm明顯低于健康組,而且電鏡觀察可見凋亡細胞的Mi管狀結構破壞,區室化消失,也表明Mi的功能變化(圖3~4)。
本研究免疫組化法檢測結果顯示:無論是橫向或縱向分析,CP組Smac、Bax陽性表達在上皮組織、結締組織均明顯高于健康對照組,差異有顯著統計學意義(P﹤0.05),提示在損傷組織表達明顯。CP組織中Smac與Bax的表達呈顯著正相關性(P﹤0.05)。說明Smac、Bax二者在線粒體內源性凋亡途徑中發揮促凋亡的重要作用。但R2值比較低,可能由于樣本量少和其他因素的影響,今后有待進一步探討。
根據慢性牙周炎齦組織的光鏡和電鏡觀察所見,上皮組織中凋亡細胞多位于基底層和棘細胞層,致使基底細胞不能進行正常分化,引起上皮細胞的凋亡,結果造成牙周組織的損傷。結締組織中漿細胞的凋亡,降低宿主局部體液免疫功能,從而促進牙周炎的發展。巨噬細胞根據其凋亡特異形態學變化,具有發揮完成吞噬凋亡細胞的利他作用,也通過凋亡發揮生理作用[8]。本研究認為激活巨噬細胞的凋亡,是機體限制巨噬細胞的有害炎癥介質對局部組織損傷的一種方式。成纖維細胞的凋亡,膠原纖維松散且斷裂無序,造成牙周膜的破壞,影響基質形成細胞增殖、分化降低細胞的活性,其臨床意義在于引起牙周組織的喪失,牙周袋的形成,促進牙周組織病變的發展。
[1]Chai J,Du C,Wu J,et al.Structeral and biochemical basis of apoptotic activation by SMAC/DIABLO[J].Nature,2000,406(6798):855-862.
[2]Shoshan Barmatz V,Kein N,Abu-Hamad S,et al.Apoptosis is regulatedby the VDAC N-terminal region and by VDAC oligomerization:release of cytochrome C AIF and Smac/Diablo[J].Biochim Biophys Acta,2010,1797:1281 -1291.
[3]Li P,Nijhawan D,Budihardjo J,et al.Cytochroma and dATP-dependent formation of Apaf-1/Caspase-9 complex initiates an apoptotic protease cascade[J].Cell,1997,91(4):479 -89.
[4]Pan G,O’Rourke K,Dixit M.Caspase-9 bcl-x and apaf-1 form fermary complex[J].Biol Chem,1998,273(10):5841 -5845.
[5]Leone CW,Bokhadhoor H,Kuo D,et al.Immunization enhance inflammation and tissue destruction in response to Porphyromonas gingivlis Infect[J].Infect Immun,2006,74(4):2286-2292.
[6]梁敏,凌均棨.牙周炎發病過程中的細胞凋亡[J].中華口腔醫學雜志,2010,45(9):573 -576.
[7]Nechushtan A,Smith CL,Lamensdorf I,et al.Bax and Bak coalesce into novel Mi- associated clusters during apoptosis[J].Cell Biol,2001,153:1265.
[8]黃行許,黃肖國.巨噬細胞凋亡及其調控[J].生物化學與生物物理進展,2000,27(2):140-141.

