食物營養與機體健康的關系
——腸胃始動論
阮 征,鄧澤元,伍國耀,印遇龍,3,*
(1.南昌大學生命科學與食品工程學院,江西 南昌 330031;2.德克薩斯農工大學農業與生命科學學院,美國 德克薩斯州77843-2471;3.中國科學院亞熱帶農業生態研究所,湖南 長沙 410125)
食物營養與機體健康的關系
——腸胃始動論
阮 征1,鄧澤元1,伍國耀2,印遇龍1,3,*
(1.南昌大學生命科學與食品工程學院,江西 南昌 330031;2.德克薩斯農工大學農業與生命科學學院,美國 德克薩斯州77843-2471;3.中國科學院亞熱帶農業生態研究所,湖南 長沙 410125)
隨著飲食結構與環境的改變,健康問題將成為21世紀人們面臨的最大挑戰之一。通過食物來促進身體健康,逆轉亞健康狀態,甚至干預或改善慢性病是調整健康狀態的一條重要途徑。本文綜述近10年來食物成分、微生物及其代謝物、腸道結構功能三者的相互作用,以及食物與腸胃對機體其他系統的影響。認為腸胃在承載食物成分對機體健康的調控方面具有非常重要的作用:一是起始階段的橋梁與引發作用,二是中間過程中的雙向調節作用。
食品;營養;健康;腸胃
據WHO統計,目前全世界20歲及以上的成年人中有15億人超重,其中2億多男性和近3億女性為肥胖。中國同樣也面臨著嚴重的健康問題。Reynolds等[1]在2000—2001年對15540名中國人進行流行病調查,以WHO標準判斷男性超重率為24.1%,肥胖率為2.8%,女性超重率26.1%,肥胖率為5%[1]。肥胖成為影響健康的重大隱患,以及肥胖等因素引起的代謝綜合征,如高血壓與糖尿病,嚴重威脅人類的健康。據統計,目前我國已成為僅次于印度的全球第二大糖尿病國家,預測至2025年中國的糖尿病患者將超過3700萬[2]。這些亞健康或疾病的發生不僅僅嚴重影響患者的身體健康和生活質量,同時也給各國造成了沉重的經濟負擔,因此預防或治療慢性疾病已經成為21世紀全世界面臨的最大公共衛生挑戰之一,健康問題已經在全球范圍內引起了廣泛關注。
亞健康狀態或疾病發生的機理復雜,通常認為與環境、遺傳和飲食密切相關。在眾多因素中,通過食物干預或改善亞健康或慢性病正逐漸引起了人們的重視。2010年,比利時科學家Szic等[3]提出食物可調節慢性病的觀點。Zhao Liping等[4]提出“慢性病的腸源性假說”,認為腸道菌群是人體的第二基因組,通過改善腸道菌群,有利于慢性炎癥的消除并使宿主的代謝機能逐步恢復。
消化系統(主要是腸胃)是與食物直接接觸人體的第一個系統,是連接機體內環境和外部環境的橋梁,具有消化吸收功能、屏障功能、以及免疫與信號轉導功能[5-7]。當前食物成分調節腸道結構和功能(如腸上皮細胞屏障[8]與黏膜免疫[9])、調節腸道微生物[10]的作用機制方面的研究較少。
本文對食物成分、微生物及其代謝物,以及腸道結構功能的三者之間的聯系作用(圖1),以及對機體其他組織與器官造成的影響進行總結歸納,試圖找出其中的內在聯系。對全面地認識食物成分、微生物和腸道對健康的影響,對食物調節與促進人體健康,逆轉亞健康狀態以及干預慢性病具有重要借鑒意義。
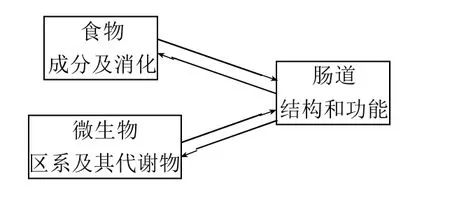
圖1 腸腔內的食物、微生物和腸道三者的相互聯系與作用Fig.1 Interactions of intestinal structure and function with food ingredients, microbes or their metabolites
1 食物對消化系統(腸胃)的影響
消化系統由消化道和消化腺兩部分組成[11]。消化道是一條起自口腔延續為咽、食道、胃、小腸(十二指腸、空腸、回腸)、大腸(盲腸、結腸、直腸),止于肛門的一段很長的肌性管道,其中腸道是物質消化和吸收的主要場所。消化腺包括唾液腺、胰腺、肝臟、胃腺、腸腺,其主要功能是分泌消化液。
1.1 腸道的基本結構和功能
1.1.1 腸道的基本結構
典型的腸道組織結構分為黏膜層、黏膜下層、肌肉層以及外膜。黏膜層主要由上皮層、固有層和黏膜基層組成[12]。上皮層由單層柱狀細胞組成(腸上皮細胞),主要包括吸收細胞、杯狀細胞、潘氏細胞、內分泌細胞及未分化細胞。吸收細胞數量最多,它是由密集而規則排列的微絨毛構成,每個細胞上微絨毛約有1000根,使細胞游離面面積擴大了約20倍;杯狀細胞散布于吸收細胞間,能分泌黏液,具有潤滑和保護作用,從十二指腸至回腸末端其數量逐漸增多;潘氏細胞位于絨毛底部,內含溶菌酶,同時具有分泌α-防御素的能力,具有一定的滅菌作用;內分泌細胞多集中在十二指腸上部,能分泌多種激素,如L細胞廣泛分布于各腸段,分泌腸高血糖素;I細胞分布多見于十二指腸和空腸,分泌縮膽囊素-促胰酶素等;未分化細胞也稱隱窩干細胞,胞體較小,細胞不斷的增殖、分化、向上遷移,以補充絨毛頂端脫落的吸收細胞和杯狀細胞,同時也具有分化成潘氏細胞和內分泌細胞的能力;固有層中富含免疫細胞,如T細胞、B細胞、巨噬細胞,除了含有大量分散的淋巴細胞外,還含有淋巴小結,在十二指腸和空腸多為孤立淋巴小結,回腸多為集合淋巴小結。黏膜基層由內環行和外縱行兩層平滑肌組成。
黏膜下層為疏松結締組織,含有較多的血管和淋巴管;肌肉層包含內環行和外縱行兩層平滑肌;外膜除十二指腸厚壁為纖維膜外,小腸其余部分的外膜均為漿膜。
1.1.2 腸道功能
腸道功能主要包括消化吸收功能、屏障和免疫作用,如圖2所示[13]。目前,對腸上皮細胞的消化轉運功能研究較早也較為清楚,后兩者逐漸成為研究熱點。腸道屏障功能和免疫作用對維持腸道穩態具有重要的意義,腸道功能正常與否與腸道黏膜層密切相關,尤其是上皮層和固有層。
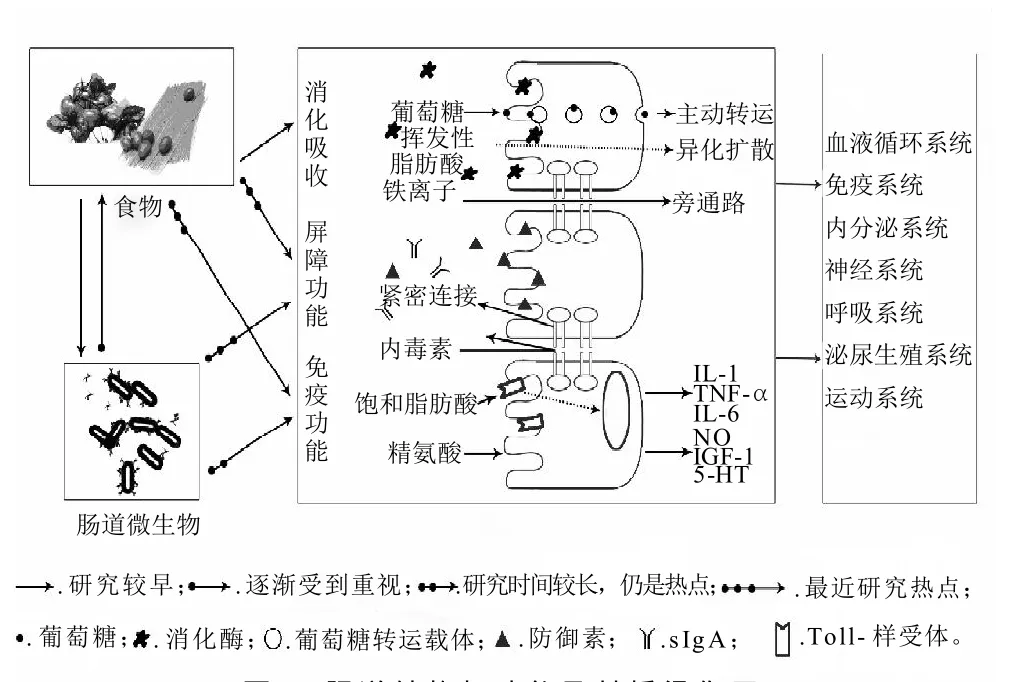
圖2 腸道結構與功能及其橋梁作用Fig.2 The role of intestinal structure and function
腸道消化與吸收功能,腸上皮細胞在發揮這一功能中起著主要作用。在腸上皮細胞表面微絨毛的刷狀緣上分布著大量的酶,如α-糊精酶、麥芽糖酶、蔗糖酶以及寡肽酶。胰淀粉酶的消化產物麥芽寡糖、麥芽糖以及從食物中攝入的蔗糖、乳糖等進一步在這些酶的作用下水解生成單糖,包括葡萄糖、果糖和半乳糖[14]。腸上皮細胞對營養物質的吸收可以通過多種途徑:主動轉運,單純擴散,易化作用,胞吞作用[15]。
腸道的屏障功能,主要包括機械屏障、生物屏障和免疫屏障功能[16]。機械屏障主要由腸上皮細胞及其緊密連接蛋白構成,機械屏障可阻止腸腔中的大分子物質(如微生物、抗原)進入機體內部[17]。生物屏障是指與腸道相互依賴又相互作用的微生態系統平衡。腸道免疫屏障功能主要由分泌型IgA和腸上皮內淋巴細胞免疫監視構成。它能抵抗外來和自身抗原誘導免疫應答反應。這三者一起構成一個完整的腸道屏障,保護腸道免受外來的抗原和免遭異常的免疫應答反應[18]。
腸道的免疫功能由腸道黏膜免疫系統體現,它主要包括腸道黏膜上皮及固有層內呈彌散分布的淋巴細胞,以及組織化的淋巴組織(如派氏結、腸系膜淋巴結及較小的孤立淋巴濾泡)[19]。成人腸道黏膜面積至少有200m2,腸道內環境非常復雜,使腸道黏膜免疫系統長期曝露于各種病原體、食物和腸道共生菌群,因此腸道黏膜免疫系統形成了一套嚴格的調節機制區分各種抗原刺激并進行分類并迅速做出反應:對無害抗原(食物營養成分和有益菌種)能下調免疫應答,具有免疫耐受特性;而對有害抗原則產生體液和細胞免疫并排除抗原[20]。腸道黏膜免疫在調節腸道免疫耐受和免疫反應平衡扮演重要角色。
此外,腸上皮細胞還具有信號識別與轉導的功能,部分參與免疫作用。腸上皮細胞表面表達Toll樣受體(TLRs),識別腸腔內的抗原[21]。在正常情況下,細胞表面TLRs低水平表達,只有在疾病狀態(炎癥性腸病)下其表達顯著增加,這在一定程度上增加了對腸道共棲微生物的耐受性。同時腸上皮細胞通過分泌的胸腺基質淋巴細胞生成素(TSLP)與T細胞上相應的受體結合來調節輔助型T細胞的分化,TSLP還能通過影響VA的代謝調節DCs細胞的功能[22],揭示腸上皮細胞可參與腸道黏膜免疫的調控[23]。
1.2 食物成分與腸道結構和功能的相互作用
1.2.1 食物成分對腸道結構和功能的影響
食物成分及其代謝物可影響腸道消化和吸收功能。日糧中添加谷氨酰胺可以緩解腸道中乳糖酶的下降,顯著增加回腸中亮氨酰氨基肽酶,降低十二指腸中堿性磷酸酶[24],提高腸道對木糖的吸收功能[25]。丁酸鹽能提高回腸蔗糖酶的活性[26]。
食物成分及其代謝物亦可影響腸道屏障功能。1)膳食成分可調節腸道屏障。Li Nan等[27]研究成果表明谷氨酰胺可通過活化磷酸肌醇3激酶(phosphatidylinositol 3-kinase,PI3K),增加腸上皮細胞Caco-2屏障功能。精氨酸是哺乳期的一種必需氨基酸,在維持和保護腸道黏膜、促進腸道損傷修復等方面發揮重要作用,精氨酸干預LPS誘導的豬腸上皮細胞損傷,發現精氨酸能促進豬腸上皮細胞的增殖,揭示精氨酸能促進腸道損傷的修復[28]。2)食物成分轉化物及其消化吸收過程影響腸道屏障功能的完整。在營養物質的消化吸收過程中伴隨著能量代謝,能量代謝過程產生的自由基能損傷腸道屏障。王艷艷[29]研究顯示高脂膳食喂養的小鼠回腸自由基增加了1倍,同時伴隨抗氧化酶活力的降低。自由基誘導酪氨酸的磷酸化能降低緊密連接蛋白的表達,增加腸道通透性[30]。3)參與物質代謝的酶可調節腸道屏障功能。腺苷酸活化蛋白激酶(AMP-kinase,AMPK)在脂質代謝,能量代謝及葡萄糖代謝中發揮著重要作用,近年研究顯示AMPK的活化能調節腸上皮細胞緊密連接蛋白的分布,增強腸上皮細胞屏障功能[31]。
食物成分及其代謝物可調控腸道免疫功能。Lindsay等[32]對中度結腸炎患者給予低聚果糖干預3周,患者結腸中IL-10陽性樹突狀細胞的比例由30%增加到53%,同時表達TLR2和TLR4樹突細胞顯著增加。多糖類物質在腸道菌群的作用下代謝產物丁酸對腸道具有免疫調節作用,Segain等[33]用丁酸與來自結腸炎患者腸道固有層淋巴細胞和外周血單核細胞共同培養,發現丁酸能顯著抑制NF-κB的活化和IκBα的降解,抑制腫瘤壞死因子-α,白介素-6、白介素-1β促炎基因表達以及腫瘤壞死因子-α的分泌。VA代謝產物維甲酸可通過T淋巴細胞表面得維甲酸孤兒素受體調節T淋巴細胞的分化[34]。
除此之外,食物成分及其代謝物對腸道的抗氧化系統也造成影響。Lee等[35]將大豆皂苷干預結腸炎小鼠發現,大豆皂苷I能顯著提高結腸谷胱甘肽的含量和超氧化物歧化酶、過氧化氫酶的活力,并降低丙二醛的含量。Jaganath等[36]將蘆丁與人糞便在厭氧條件下共同孵育,經過腸道菌群代謝作用后,發現蘆丁的代謝產物的抗氧化能力和發酵時間和代謝物的積累量相關,同時不同個體來源的糞便顯示的對蘆丁的代謝能力不同,抗氧化性也不同,其代謝產物槲皮素和3,4-二羥基苯乙酸對抗氧化能力顯著強于蘆丁,而3-羥基苯乙酸、4-羥基苯甲酸抗氧化能力幾乎為零。這表明不同個體間菌群的差異能導致營養成分代謝的差異,同時營養成分在腸道內代謝物的種類影響腸道內抗氧化能力。
綜上,食物成分及其代謝物對腸道結構和功能具有重要的影響,對腸道形態、腸道消化酶的活力、腸上皮細胞間的緊密連接、腸道免疫功能和抗氧化能力均能產生影響。
1.2.2 腸道功能和結構對食物成分及其代謝物的影響
腸上皮細胞表面含有豐富的酶類以及轉運載體參與營養物質的消化和吸收。機體對葡萄糖的吸收可以通過腸上皮細胞膜上葡萄糖轉運載體(GLUT)[37];黃酮苷元 (如槲皮素) 可通過轉運載體如鈉離子依賴葡萄糖轉運載體而以原型形式被吸收[38];鈣、鐵等一些礦物質主要通過腸黏膜上的鈣結合蛋白而主動轉運,部分通過上皮細胞間緊密連接而被吸收[39]。
1.3 食物成分和微生物的相互作用
成人腸道內定殖的細菌細胞數量多達1014個,種類約500~1000種,其數量約為人體細胞的10倍,所編碼的基因數至少是人體自身基因的100倍[40]。這些種類與數量繁多的微生物組成一個復雜的微生態系統,直接參與人體的消化、物質代謝以及免疫調節。同時食物成分對微生物菌群具有調節作用。
1.3.1 食物成分對微生物菌群的影響
由于食物成分是腸道細菌發酵的主要底物,因此膳食結構和食物的成分和含量在很大程度上能影響腸道菌群的組成及其代謝。Finegold等[41]比較傳統日式飲食和西方飲食的日裔美國人腸道菌群的組成時發現,雖然他們具有相似的遺傳背景,但腸道菌群組成卻顯著差異,日式飲食下除腸桿菌以外的兼性厭氧菌和需氧菌的數量較西方組顯著增多。喂養高脂的小鼠腸道內產丁酸鹽的細菌增多,小鼠容易肥胖[42]。Cani等[43]發現高脂飲食使革蘭氏陰性菌的數目增加,雙歧桿菌減少。Bouhnik等[44]對20個健康人每天分別用12.5g果寡糖和蔗糖(每組10人),果寡糖組中人腸道雙歧桿菌明顯提高。殼聚糖干預糖尿病大鼠能顯著降低大腸肝菌和腸球菌的數量,對雙歧桿菌和乳酸桿菌的增殖作用具有顯著增殖作用[45]。Lee等[46]對腸道菌群代謝茶多酚研究發現,茶多酚及其代謝物對致病菌的生長具有抑制作用,如3-甲氧基沒食子酸和沒食子酸對產氣莢膜梭菌的生長,而對有益菌的生長影響不大。
1.3.2 微生物對食物成分的代謝作用的影響
腸道菌群是人體不可分割的組成部分,它通過自身的酶直接參與宿主的代謝過程。腸道細菌可以代謝機體自身不能代謝的化合物。研究表明至少能產生的156種碳水化合物活化酶,其中77種糖苷水解酶、35種糖基轉移酶、12種多糖裂解酶、11種糖酯酶。它們降解機體自身不能降解的多糖,比如木聚糖、果膠、阿拉伯糖等,其代謝終產物為短鏈脂肪酸[47]。1)微生物作用于不同食物成分產生的短鏈脂肪酸的種類不同。支鏈氨基酸(如纈氨酸、亮氨酸)發酵產生支異丁酸、異戊酸等之鏈脂肪酸[48],而芳香族氨基酸(如苯丙氨酸、色氨酸)發酵則產生酚類和吲哚類物質[49]。2)微生物作用于不同的食物成分產生短鏈脂肪酸的量不同。抗性淀粉比淀粉產生的乙酸多,而淀粉發酵則產生較多的丁酸[50]。Moreau等[51]用低聚乳果糖和抗性淀粉分別喂葡聚糖硫酸鈉誘導結腸炎小鼠,低聚乳果糖組丁酸的產量要優于抗性淀粉。此外,腸道菌群還參與宿主的代謝,在腸道細菌的作用下將牛磺酸和甘氨酸結合的結合型膽汁酸降解,釋放出膽汁酸以及牛磺酸[52]。
同時腸道細菌對食物營養成分的轉化作用將影響到其生物功能的發揮,既能發揮有益作用又能產生有害影響。越來越多的研究表明食物成分經過腸道菌群后的代謝產物是其發揮生理活性的主要物質。無菌小鼠體內不能正常代謝多酚類物質,表明腸道菌群在黃酮類物質的代謝過程中起著重要的作用[53]。Rwoland等[54]將大豆黃酮與人糞便在厭氧環境下共同發酵培養,結果發現大豆黃酮被人體腸道細菌轉化為生物活性更高的牛尿酚。人參皂苷被認為是人參的主要活性成分,研究發現人體腸道內菌群轉化人參皂苷的代謝產物Compound K 是非天然的人參皂苷(由二醇型人參皂苷轉化而來),被認為是真正被人體吸收和發揮活性作用的實體[55]。Tsuchihashi等[56]將葛花苷與人腸道內中的不同菌株共同培養后發現葛花苷的代謝物不同,與鏈狀雙歧桿菌和假鏈狀雙歧桿菌菌株共同培養后,主要代謝產物為尼泊爾鶯尾異黃酮;而與消化鏈球菌屬菌株共同培養后,主要代謝產物則為6-羥基鷹嘴豆素A。白雪[57]發現葛花苷在大鼠體內代謝產物尼泊爾鶯尾異黃酮對降低小鼠醉酒率和延長睡眠潛伏期時間優于野葛花水提物和葛花苷。與之相反,腸道微生物對食物成分的代謝作用還可能不利于宿主健康,如糖精(cyclamate,環己氨基磺酸鹽)本身對人體無害,可在尿液中卻發現了一種可能的潛在致癌物環己胺(cyclohexylamine),研究發現宿主細胞不能實現這種轉化,當其與糞便共同孵育時即可發生這種轉化[58]。合成維生素也是腸道菌群對物質代謝的影響之一。研究表明腸道菌群可以合成多種人體所需的維生素,包括VB1、VB2、VB12、VK、尼克酸和葉酸等[59-60]。
綜上所述,腸道微生物在機體的代謝過程中發揮著重要作用,首先它能代謝機體(腸胃)不能代謝的食物成分進行輔助機體代謝。其次還可參與機體代謝,其對營養物質的轉化作用對宿主將產生有益或有害的作用,比如Nicholson等[61]認為人體的代謝是由自身基因和腸道共生的微生物共同作用的結果。
1.4 微生物對腸道結構和功能的影響
腸道菌群結構失衡會影響腸道機械屏障的變化。抗生素能破壞腸道菌群平衡,機會致病菌C.difficile相對比例升高,而其產生的毒素增加腸上皮細胞通透性而導致腸道細菌移位[62]。Brun等[63]發現肥胖小鼠腸道通透性比正常小鼠高,且血液中炎癥因子顯著增高,并認為腸道通透性的增加導致內毒素血癥,最終發生炎癥性損傷。與此相反,有益菌的增加對腸道屏障功能具有保護作用。Cani等[43]給高脂膳食誘導的糖尿病小鼠飼喂果聚糖,腸道雙歧桿菌的數量增加,血中內毒素降低,通過對腸道菌群與血內毒素進行相關性分析發現雙歧桿菌與內毒素的含量呈現顯著負相關,因此揭示雙歧桿菌數量的增加能保護腸道的通透性。將益生菌用于結腸炎動物模型與結腸炎患者,發現益生菌對促進疾病的改善有較好的效果[64-66],Zocco等[67]用Lactobacillus GG干預潰瘍性結腸炎患者,通過臨床觀察,內窺鏡以及腸道組織學觀察發現該乳酸菌對疾病的緩解具有顯著作用,與臨床用藥5-氨基水楊酸效果無顯著差異。
腸道菌群不僅僅能影響腸道的屏障功能,同時還被認為是腸道免疫功能的“塑造者”[68]。在無菌動物體內腸道免疫功能受到嚴重影響,如腸相關淋巴組織發育受損,派伊爾淋巴結和腸系膜淋巴結數量減少,孤立的淋巴濾泡的成熟受阻,同時免疫細胞(如C D 4、 CD8 T淋巴細胞數量減少,免疫細胞表達的受體減少(MHC-Ⅱ、TLR9)表達減少,抗菌活性物質(如IgA)分泌減少,這揭示了腸道菌群對腸道免疫功能的形成產生重要的影響[69-71]。Toll樣受體是一類重要的細胞表面模式識別受體,能廣泛的識別腸道菌群不管是有益菌還是有害菌攜帶的病原體相關分子模式,因此Abreu[72]認為腸道功能的建立與腸上皮細胞表達的TLRs對腸道菌群的識別有關。
在宿主腸上皮細胞的黏膜上有黏附素受體,其中大部分受體具有脂肪酸結合位點的蛋白質或糖脂;同時在腸道細菌表面有不同黏附結構的配體,這為腸道細菌在腸上皮細胞黏膜上黏附和定殖提供條件。研究表明雙歧桿菌菌體表面的脂磷壁酸是一種黏附素,能介導雙歧桿菌在腸上皮細胞的黏膜上黏附[73]。一般認為只有活菌才具有黏附能力,Fourniat等[74]發現死乳桿菌也具有黏附能力。有益菌在腸道的定殖具有重要的意義,定殖有助于形成穩定的膜菌群,抑制有害菌在腸上皮細胞表面的黏附。
綜上所述,腸道中食物成分、微生物以及腸道三者間的相互影響,共同維持著腸道健康。食物成分可直接影響腸道結構和功能,也可影響腸道微生物區系及其代謝產物,并可經由腸道菌群來調控腸道結構和功能,因而食物在這三者中的地位顯得尤為重要。近年來隨著對腸道功能研究的不斷深入,腸-肝軸、腸-胰島軸、腸-腦軸等概念的相繼提出,對腸道功能的認識有了進一步的認識,同時它在維持人體健康方面起到的重要作用引起了廣泛的關注和研究熱情。本文將進一步探討食物成分對機體各個系統的影響,如圖3所示,旨在揭示腸胃結構功能在維持機體健康中所起的重要作用。
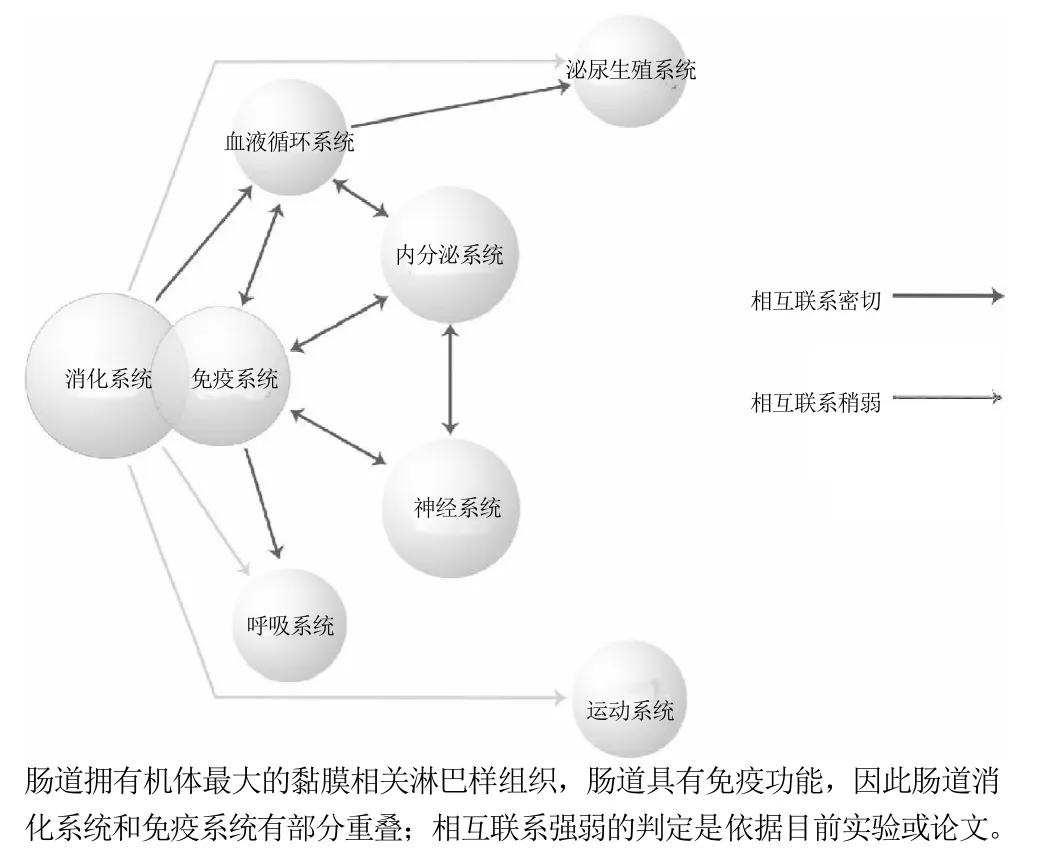
圖3 消化系統與其他系統的影響Fig.3 Effect of gastrointestine (digestive system) on other organs and tissues
2 腸胃與免疫的相互作用
在肥胖,糖尿病與高血壓等慢性疾病的患者體內發現一個共同特征[75-76]:體內持續的、低水平的慢性炎癥,因此近年來,機體的代謝與免疫的關系受到廣泛的關注,《Trends in Immunology》[77]、《Nature Reviews immunology》[78]、《Nature》[79-80]等雜志上均發表多篇文章[81-82],試圖理清兩者之間的關系。
食物中的膳食成分如脂質(脂肪酸、膽固醇、脂溶性維生素等)、葡萄糖、微量元素(鋅、銅、鐵等)都對免疫系統有重大的影響。同時參與免疫過程的模式識別受體和細胞因子等又能影響食物成分的吸收代謝過程[78,81]。深入了解兩者之間的關系為通過膳食干預調理人體生理狀態,維持內環境的穩定,提高免疫力提供理論支持。
2.1 食物成分及其代謝物對免疫的調控
食物過敏是食物引起免疫反應最典型的癥狀之一。如花生、牛奶引起由IgE介導的免疫反應;小麥、黑麥等谷物能引起對醇溶谷蛋白及其相關蛋白不耐受的個體產生乳糜瀉,當患者進食這些致敏性谷物或蛋白后引起小腸黏膜的損傷,阻礙營養物質的吸收并產生炎癥[83]。
脂肪是人體的六大營養素之一,近年研究表明它還參與到免疫調節的過程。高脂膳食引起腸上皮細胞通透性增加,從而導致血內毒素含量的增加[30,43,84],而內毒素在血液循環過程中的增加是導致系統性的慢性炎癥的重要原因,也是引起肥胖及相關的代謝綜合征產生的主要因素[85]。Ghanim等[86]研究發現食用高脂高碳水化合物的膳食相對于高碳水化合物的膳食能顯著增加血單核細胞TLR4、TLR2的表達以及核轉錄因子κB(NF-κB)的活化,提示高脂是導致TLRs在單核細胞表面增加的原因。同時研究表明,飽和脂肪酸能誘導TLR4、TLR2基因的表達,并可通過Myd88依賴途徑和非依賴途徑活化NF-κB,從而分泌大量的炎性因子;而不飽和脂肪酸卻能抑制TLRs基因的表達及其信號通路的活化[87]。
氨基酸也同樣被認為具有免疫調節作用。其中對精氨酸的研究比較多,精氨酸是幼年動物必須氨基酸之一,對維持腸道健康具有重要作用。研究表明,補充精氨酸能調節T淋巴細胞活性、增加自然殺傷細胞和巨噬細胞的活力,從而增強機體免疫力功能[88]。對斷奶仔豬灌喂精氨酸,能增加血清IgM、IgG的含量,增強脾臟IL-8、TNF-α基因的表達,從而增強了仔豬的免疫力[89]。
VA的代謝物維甲酸對免疫系統的具有重要的影響[34,90],它不僅對T淋巴細胞和B淋巴細胞的功能具有調節作用,同時還影響樹突狀細胞的功能。Mucida等[91]揭示維甲酸能抑制T細胞上的維甲酸孤兒素受體的表達,有利于誘導Th0細胞向Treg細胞極化。維甲酸還能通過DCs表面相應的受體途徑調節細胞因子的產生,能促進Th2型細胞因子:IL-4、IL-5、IL-6[92]。Hsu等[93]將大豆和綠茶聯合使用干預患有前列腺癌的大鼠,實驗結果表明它們的聯合使用能抑制前列腺組織NF-κB的活化,降低炎性因子浸潤和促炎因子的分泌,同時實驗結果還表明,綠茶和大豆蛋白單獨使用效果不明顯。
2.2 免疫對食物吸收和代謝的影響
免疫細胞的活化及其功能的維持需要大量的能量,而葡萄糖是主要的能量來源。免疫細胞被抗原激活后,對葡萄糖的需求量激增,此時可通過兩個途徑增加對葡萄糖的吸收。首先,增加免疫細胞細胞膜上葡萄糖轉運載體蛋白(GLUT)的表達;其次,免疫細胞激活后引起的信號通路也能增加對葡萄糖的攝入,如T細胞活化后,其表面的協同刺激分子受體CD28刺激PI3K-AKT信號通路的活化,增加對葡萄糖的攝入[77,94]。Healy等[95]認為胞內增加葡萄糖濃度可以抑制白細胞凋亡,這種保護性作用與細胞利用葡萄糖的程度有關。CD28被認為是具有免疫和代謝雙重作用的代表性分子之一。
除此之外,免疫過程中分泌的細胞因子也參與到了物質的代謝過程。高水平的IL-6增加血清甘油三酯以及血糖的濃度,而IL-6基因缺失的小鼠對葡萄糖的耐受下降[96];Plomgaard等[97]研究顯示TNF-α在血液中的激增,使脂解作用增強,同時增加游了離脂肪酸的含量。然而細胞因子對代謝的具體作用機制還不明確。除細胞因子外,黏附因子也被認為參與到機體的代謝過程。Dong等[98]通過對ICAM-1基因缺失的小鼠研究發現,在正常飲食的情況下ICAM-1基因缺失的小鼠體質量顯著高于正常小鼠,白色脂肪(P<0.01)與褐色脂肪(P<0.05)占體質量比例顯著升高;在高脂膳食飼喂2周后,基因缺失小鼠與正常小鼠采食量無顯著差異,但體質量卻顯著高于正常小鼠,同時也影響到脂肪沉積。
3 腸胃與血液循環系統的相互作用
由于小腸是食物消化和營養物質吸收的主要場所,因此小腸腸腔內物質的組分以及腸上皮細胞完整性將直接影響到血液循環系統。
3.1 食物成分及其代謝物對血液生物化學組分的影響
Toufektsian等[99]發現花青苷增加大鼠血清中n-3多不飽和脂肪酸(如EPA與DHA)的含量。苦瓜具有多種生物活性物質,其中苦瓜多糖被稱為植物胰島素,董英等[100]通過對糖尿病小鼠飼喂水提取和堿提取的苦瓜多糖,實驗結果表明苦瓜多糖能顯著降低血中葡萄糖的含量。
當腸上皮細胞的屏障功能受到損害時,血液中脂多糖的含量的顯著升高[76],而脂多糖是革蘭氏陰性菌細胞壁的主要成分,能刺激免疫細胞活化并引起促炎因子分泌增加,促炎因子通過循環在全身蔓延將引起全身性的炎癥[85],因此腸道屏障功能完善與否與糖尿病等慢性疾病密切相關[101]。由脂多糖入血引起的疾病最典型的是膿毒素血癥,張晗等[102]對膿毒血癥大鼠研究中發現血堿性磷酸酶的含量與疾病的嚴重程度負相關。大量研究表明高脂膳食是增加腸道通透性的主要原因之一。Cani等[43]用高脂膳食喂養小鼠,腸道的通透性顯著增加,導致血液中脂多糖的濃度顯著升高,同時血液中促炎因子IL-1α、IL-1β、IL-6的含量也顯著高于普通小鼠。Li Qiurong等[103]也證實,n-3多不飽和脂肪酸在促炎因子誘導的通透性缺陷和上皮屏障功能紊亂中,能通過調整緊密連接的膜微觀區域,增加腸道上皮細胞的緊密性。劉玉江等[104]用膳食纖維干預乙酸灌腸法制作大鼠炎癥性腸病疾病模型時也證實,添加膳食纖維的腸內營養能降低門靜脈血中的脂多糖水平、促進腸道黏膜的修復、加強腸黏膜屏障的保護作用。
3.2 食物成分及其代謝物對血管壁的影響
大豆中含有豐富的大豆肽,經酶解后能產生血管緊張素轉化酶抑制劑(ACEⅠ),能夠降低血壓。湯健等[105]發現大豆肽對自發性高血壓降壓效果明顯。丁志山等[106]對姜黃素抗腫瘤的研究過程中,發現姜黃素能抑制血管生成。增加膳食中脂肪的攝入量,容易引起脂肪在血管壁上沉積,引起動脈粥樣硬化等疾病。大量證據表明炎癥在動脈粥樣硬化發生、發展和演變過程中起著重要作用,炎癥是動脈粥樣硬化性疾病的基本特征,同時亦是動脈粥樣硬化性疾病的始動因子。
4 腸胃對呼吸系統的影響
通過對炎癥性腸病的研究發現,約超過50%的腸炎患者有不同程度的呼吸系統癥狀,如支氣管炎、支氣管擴張、肺炎等[107-108],對于腸炎患者會患呼吸系統疾病的原因知之甚少。腸缺血再灌注損傷啟動炎癥應答可導致遠隔器官的損害,甚至多器官功能衰竭,其中以急性肺損傷(acute lung injury,ALI)引起的呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)最為突出。發病機制錯綜復雜,迄今尚未完全闡明,但本質是炎癥反應的失控[109]。
劉輝[110]用VA干預難治性哮喘取得了一定的效果,其對疾病的緩解作用可能依賴于VA代謝產物維甲酸對免疫的調控作用。姜黃素是廣泛存在于香辛料中了多酚類物質,在小腸黏膜中被代謝,具有多種生理功能,如提高抗氧化能力,抑制NF-κB的活化等,同時還可以通過調節組蛋白去酰基化酶調控肺上皮細胞促炎因子基因的活化[111]。芬蘭的一項對超過10000人群調查,發現多酚的攝入量與哮喘的發病率呈負相關[112],Walda等[113]一項超過13000個志愿者對慢性梗阻性肺疾發病率的研究結果也顯示出相關的變化。
5 腸胃對神經-內分泌系統的影響
食物成分及其代謝產物對神經-內分泌系統的影響主要有兩條途徑:一是直接影響,另一個是通過免疫系統間接影響。大豆是一種優良的植物蛋白,動物實驗研究結果表明,飼喂大豆蛋白后能改變動物體內激素濃度,特別是甲狀腺素、胰島素、升血糖激素等激素與膽固醇的代謝密切相關。Meja等[114]研究認為姜黃素通過上調組蛋白去酰基化酶的表達來恢復糖皮質激素的功能。胃腸道黏膜中的嗜鉻細胞,在進食或者病理性刺激的時候刺激嗜鉻細胞分泌5-羥色胺,5-羥色胺是一種神經遞質,在腸至腦的信息傳遞過程中起著重要作用[115]。
同時鑒于食物成分對免疫的重要調節作用,免疫-神經-內分泌系統間的緊密的相互聯系與作用,因此,腸胃結構與功能對維持正常的生理功能和內環境穩定起著重要作用。IL-1是由免疫細胞分泌的細胞因子,研究表明,它能刺激神經肽的分泌,比如促進促腎上腺激素釋放激素(CRH)、黑皮質素[116]。TNF-α在眾多疾病中均發現顯著增加,它在肥胖誘導的糖尿病的發展過程中起著重要作用,研究顯示它能降低胰島素受體對胰島素的敏感性[117-118]。α-黑素細胞刺激素(α-MSH)由下丘腦神經元前阿片黑素細胞皮質激素產生,與黑皮質素4受體(MC4R)結合后,抑制食欲,增加基礎代謝率[119]。
6 腸道始動論
近幾十年來隨著生活環境、生活方式與食物結構的改變,全球肥胖、Ⅱ-型糖尿病、心血管疾病的發病率呈現急劇上升趨勢。美國華盛頓大學Gordon研究組提出將“腸道菌群作為一種環境因素條件脂肪貯存”的觀點[120],提倡人們應該關注腸道,關注腸道微生物。英國帝國大學Nicholson教授研究組對中國、美國、日本和英國的17個不同地區的4360名志愿者尿液代謝組學分析,發現高血壓與腸道菌群的組成有密切關系[121]。揭示腸道在亞健康或疾病的發生與發展過程中具有舉足輕重的地位。
腸胃不僅作為機體對外來營養物質消化和吸收的主要場所,還具有屏蔽或清除外來有害物質與微生物的功能。腸胃為機體的健康輸送有益的物質,體現了作為食物與機體健康之間的橋梁作用,也體現了作為機體系統中的起始位置,謂之始。食物對腸道微生物的調節作用、腸道菌群對食物成分的代謝作用、食物與腸道微生物調節腸道結構與功能以及腸道屏障功能是否完整、腸道黏膜免疫是否平衡等均能影響機體的健康。腸胃在調節機體健康過程中體現了推動(正向調節)與拉動(負向調節)的作用,謂之動。
腸道始動論的提出旨在更加關注在腸胃空間中食物成分、微生物和腸道結構功能三者之間的作用機制和物質基礎變化,以及腸道結構功能調控機體健康的作用途經。多角度、多層次的深入研究將為通過食物干預調控亞健康狀態和預防疾病供理論依據,將對人類健康與生活質量產生重要影響。
[1]REYNOLDS K, GU D F, WHELTON P K, et al. Prevalence and risk factors of overweight and obesity in China[J]. Obesity(Silver Spring), 2007, 15(1): 10-18.
[2]KING H, AUBERT R E, HERMAN W H. Global burden of diabetes, 1995—2025: prevalence, numerical estimates, and projections[J]. Diabetes Care, 1998, 21(9): 1414-1431.
[3]SZIC K S V, NDLOVU N M, HAEGEMAN G, et al. Nature or nurture: let food be your epigenetic medicine in chronic inflammatory disorders [J]. Biochemical Pharmacology, 2010, 80(12): 1816-1832.
[4]ZHAO Liping, SHEN Jian. Whole-body systems approaches for gut microbiota-targeted, preventive healthcare[J]. J Biotechnology, 2010, 149(3): 183-190.
[5]BRANDTZAEG P. Development and basic mechanisms of human gut immunity[J]. Nutrition Reviews, 1998, 56(Suppl 1): 5-18.
[6]GROSCHWITZ K R, HOGAN S P. Intestinal barrier function: molecular regulation and disease pathogenesis[J]. J Allergy Clin Immunol, 2009, 124(1): 3-20.
[7]UEMATSU S, FUJIMOTO K, JANG M H, et al. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5[J]. Nature Immunology, 2008, 9(7): 769-776.
[8]劉琳娜. 大黃多糖對腸上皮細胞損傷的修復作用及其機制研究[D].西安: 第四軍醫大學, 2005.
[9]HINO K, KUROSE M, SAKURAI T, et al. Effect of dietary lactosucrose (4G-β-D-galactosylsucrose) on the intestinal immune functions in mice [J]. Journal of Applied Glycoscience, 2007, 54(3): 169-172.
[10]LAPARRA J M, SANZ Y. Interactions of gut microbiota with functional food components and nutraceuticals[J]. Pharmacological Research, 2010, 61(3): 219-225.
[11]王芬, 左明雪. 人體及動物生理學[M]. 2版. 北京: 高等教育出版社, 2001: 277-314.
[12]王興鵬. 腸道屏障功能障礙: 基礎與臨床[M]. 上海: 第二軍醫大學出版社, 2006: 8-11
[13]SHIMIZU M. Interaction between food substances and the intestinal epithelium[J]. Biosci Biotechnol Biochem, 2010, 74(2): 232-241.
[14]秦環龍. 腸道屏障功能的基礎與臨床[M]. 上海: 上海交通大學出版社, 2007: 9-10.
[15]WOUDSTRA T, THOMSON A B R. Nutrient absorption and intestinal adaptation with aging[J]. Beat Practice &Research Clinical Gastroenterology, 2002, 16(1): 1-25.
[16]段建華, 晏春根. 腸黏膜屏障研究進展[J]. 實用醫學雜志, 2004, 20 (2): 212-214.
[17]TSUKITA S, FURUSE M, ITOH M. Multifunctional strands in tight junctions[J]. Molecular Cell Biology, 2001, 2: 285-293.
[18]李偉, 陳慶森. 腸道黏膜免疫屏障及其菌群與機體健康關系的研究進展[J]. 食品科學, 2008, 29(10): 649-655.
[19]艾國平. 腸道粘膜免疫的構成與功能[J]. 免疫學雜志, 2000, 16(增刊4): 82-84.
[20]MOWAT A M. Anatomical basis of tolerance and immunity to intestinal antigens[J]. Nature Reviews Immunology, 2003, 3(4): 331-341.
[21]LEE J, MO J H, SHEN C, et al. Toll-like receptor signaling in intestinal epithelial cells contributes to colonic homoeostasis[J]. Current Opinion in Gastroenterology, 2007, 23(1): 27-31
[22]ARTIS D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut[J]. Nature Reviews Immunology, 2008, 8(6): 411-420.
[23]RIMOLDI M, CHIEPPA M, SALUCCI V, et al. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells[J]. Nature Immunology, 2005, 6(5): 507-514.
[24]張軍民. 谷氨酰胺對早期斷奶仔豬腸道的保護作用及其機理研究[D].北京: 中國農業科學院, 2000.
[25]HSU C B, HUANG H J, WANG C H, et al. The effect of glutamine supplement on small intestinal morphology and xylose absorptive ability of weaned piglets[J]. African Journal of Biotechnology, 2010, 9(41): 7003-7008.
[26]LAUS R, GUNTHNER D, LETZGU H. Effects of feeding fat-coated butyrate on mucosal morphology and function in the small intestine of the pig[J]. J of Animal Physiology and Animal Nutrition, 2007, 91(7/8): 312-318.
[27]LI Nan, NEU J. Glutamine deprivation alters intestinal tight junctions via a PI3-K/Akt mediated pathway in Caco-2 Cells[J]. Journal of Nutrition, 2009, 139(4): 710-714.
[28]TAN Bie, YIN Yulong, KONG Xiangfeng, et al. L-arginine stimulates proliferation and prevents endotoxin-induced death of intestinal cells[J]. Amino Acids, 2010, 38(4): 1227-1235.
[29]王艷艷. 高脂膳食誘導小鼠氧化應激及脂代謝相關基因表達的影響[D]. 無錫: 江南大學, 2008.
[30]RAO R K, BASUROY S, RAO V U, KARNAKY K J, et al. Tyrosine phosphorylation and dissociation of occludin-ZO-1 and E-cadherin-βcatenin complexes from the cytoskeleton by oxidative stress[J]. Biochemistry Journal, 2002, 368(Pt2): 471-481.
[31]ZHENG Bin, CANTLEY L C. Regulation of epithelial tight junction assembly and disassembly by AMP-activated protein kinase[J]. PNAS, 2007, 104(3): 819-822.
[32]LINDSAY J O, WHELAN K, STAGG A J, et al. Clinical, microbiological, and immunological effects of fructo-oligosaccharide in patients with Crohn,s disease[J]. Gut, 2006, 55(3): 348-355.
[33]SEGAIN J P, de la BLETIERE D R, BOURREILLE A, et al. Butyrate inhibits inflammatory responses through NF-κB inhibition: implications for Crohn,s disease[J]. Gut, 2000, 47(3): 397-403.
[34]MORA J R, IWATA M, von ANDRIAN H U. Vitamin effects on the immune system: vitamins A and D take centre stage[J]. Nature Reviews Immunology, 2008, 8(9): 685-698.
[35]LEE I A, PARK Y J, YEO H K, et al. Soyasaponin I attenuates TNBS-induced colitis in mice by inhibiting NF-κB pathway[J]. J Agric Food Chem, 2010, 58(20): 10929-10934.
[36]JAGANATH I B, WILLIAM M, LEAN M E J, et al. in vitro catabolism of rutin by human fecal bacteria and the antioxidant capacity of its catabolites[J]. Free Radical Biology & Medicine, 2009, 47(8): 1180-1189.
[37]高磊, 劉絳光. 對葡萄糖轉運蛋白的討論[J]. 國外醫學: 臨床生物化學與檢驗學分冊, 1999(6): 274-275.
[38]WOLFFRAM S, BLO..CK M, ADER P. Quercetin-3-glucoside is transported by the glucose carrier SGLT1 across the brush border membrane of rat small intestine[J]. J Nutr, 2002, 132(4): 630-635.
[39]KARBACH U. Paracellular calcium transport across the small intestine [J]. J Nutr, 1992, 122(Suppl 3): 672-677.
[40]GILL S R, POP M, DEBOY R T, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312: 1355-1359.
[41]FINEGOLD S M, ATTEBERY H R, SUTTER V L. Effect of diet on human fecal flora: comparison of Japanese and American diets[J]. Am J Clin Nutr, 1974, 27(12): 1456-1469.
[42]TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesityassociated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444: 1027-1031.
[43]CANI P D, NEYRINCK A M, FAVA F, et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia[J]. Diabetologia, 2007, 50(11): 2374-2383.
[44]BOUHNIK Y, de la FLOURIE B, RIOTTO M, et al, Effects of fructooligosaccharides ingestion on fecal bifidobacteria and selected metabolic indexes of colon carcinogenesis in healthy humans[J]. Nutr Cancer, 1996, 26(1): 21-29.
[45]閻春玲, 劉兵, 劉萬順. 殼寡糖及其衍生物對糖尿病大鼠糖耐量及腸道微生態平衡的影響[J]. 世界華人消化雜志, 2007, 15(11): 1202-1207.
[46]LEE H C, JENNER A M, LOW C S, et al. Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota[J]. Research in Microbiology, 2006, 157(9): 876-884.
[47]TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457: 480-484.
[48]MACHFARLANE G T, GIBSON G R, BEATTY E, et al. Estimation of short-chain fatty acid production from protein by human intestinal bacteria based on branched-chain fatty acid measurements[J]. FEMS Microbiology Letters, 1992, 101(2): 81-88.
[49]MACHFARLANE G T, ALLISON C. Utilisation of protein by human gut bacteria[J]. FEMS Microbiol Ecol, 1986, 38(1): 19-24.
[50]CASTERLINE J L J, OLES C J, KU Y. in vitro fermentation of various food fiber fractions[J]. Journal of Agricultural and Food Chemistry, 1997, 45(7): 2463-2467.
[51]MOREAU N M, MARTIN L J, TOQUET C S, et al. Restoration of the integrity of rat caeco-colonic mucosa by resistant starch, but not by fructo-oligosaccharides, in dextran sulfate sodium: induced experimental colitis[J]. British Journal of Nutrition, 2003, 90(1): 75-85.
[52]MATRIN F P, DUMAS M E, WANG Yulan, et al. A top-down systems biology view of microbiome-mammalian metabolic interactions in a mouse model[J]. Mol Syst Biol, 2007, 3(112): 112.
[53]GRIFFITHS L A, BARROW A. Metabolism of flavonoids compounds in germ-free rats[J]. Biochem J, 1972, 130(4): 1161-1162.
[54]ROWLAND I R, H WISEMAN H, SANDERS T A B, et al. Interindividual variation in metabolism of soy isoflavones and lignans: influence of habitual diet on equol production by the gut microflora[J]. Nutr Cancer, 2000, 36(1): 27-32.
[55]KARIKURA M, MIYASE T, TANIZAWA H, et al. Studies on absorption, distribution, excretion and metabolism of ginseng saponinis. Ⅶ. Comparison of decomposition models of ginsenoside-Rbl and -Rb2 in the digestive tract of rats[J]. Chem Pharm Bull, 1991, 39(9): 2357-2361.
[56]TSUCHIHASHI R, KONDERA M, SAKAMOTO S, et al. Microbial transformation and bioaetivation of isoflavones from pueraria flowers by human intestinal bacterial strains[J]. J Nat Med, 2009, 63(3): 254-260.
[57]白雪. 葛花苷大鼠體內代謝的研究[D]. 沈陽: 沈陽藥科大學, 2010.
[58]DRASAR B S, RENWICK A G, WILLIAMS R T. The role of the gut flora in the metabolism of cyclamate[J]. Biochem J, 1972, 129(4): 881-890.
[59]HILL M J. Intestinal flora and endogenous vitamin synthesis[J]. Eur J Cancer Prev, 1997, 6(Suppl 2): 43-45.
[60]BHATTACHARYYA D K, KWON O, MEGANATHAN R. Vitamin K2(menaquinone) biosynthesis in Escherichia coli: evidence for the presence of an essential histidine residuein O-succinylbenzoyl coenzyme a synthetase[J]. J Bacteriol, 1997, 179(19): 6061-6065.
[61]NICHOLSON J K, HOLMES E, WILSON I D. Gut microorganisms, mammalian metabolism and personalized health care[J]. Nat Rev Microbiol, 2005, 3(5): 431-438.
[62]HEYMAN M, CORTHIER G, LUCAS F, et al, Evolution of the caecal epithelial barrier during Clostridium difficile infection in the mouse[J]. Gut, 1989, 30(8): 1087-1093.
[63]BRUN P, CASTAGLIUOLO I, LEO V D, et al. Increased intestinal permeability in obese mice: new evidence in the pathogenesis of nonalcoholic steatohepatitis[J]. Am J Physiol Gastrointest Liver Physio, 2007, 292(2): G518-G525.
[64]LEE I A, BAE E A, LEE J H, et al. Bifidobacterium longum HY8004 attenuates TNBS-induced colitis by inhibiting lipid peroxidation in mice[J]. Inflammation Research, 2010, 59(5): 359-368.
[65]MATSUMOTO S, HARA T, HORI T, et al. Probiotic Lactobacillusinduced improvement in murine chronic inflammatory bowel disease is associated with the down: regulation of pro-inflammatory cytokines in lamina propria mononuclear cells[J]. Clinical and Experimental Immunology, 2005,140(3): 417-426.
[66]DIELEMAN L A, GOERRES M S, ARENDS A, et al. Lactobacillus GG prevents recurrence of colitis in HLA-B27 transgenic rats after antibiotic treatment[J]. Gut, 2003, 52(3): 370-376.
[67]ZOCCO M A, dal VERME L Z, CREMONINI F, et al. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis[J]. Aliment Pharmacol Ther, 2006, 23(11): 1567-1574.
[68]ROUND J L, MAZMANIAN S K. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nat Rev Immunol, 2009, 9(5): 313-324.
[69]MACPHERSON A J, HARRIS N L. Interactions between commensal intestinal bacteria and the immune system[J]. Nature Rev Immunol, 2004, 4(6): 478-485.
[70]FALK P G, HOOPER L V, MIDTVEDT T, et al. Creating and maintaining the gastrointestinal ecosystem: what we know and need to know from gnotobiology[J]. Microbiol Mol Biol Rev, 1998, 62(4): 1157-1170.
[71]BOUSKRA D, BRZILLON C, BRARD M, et al. Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis[J]. Nature, 2008, 456: 507-510.
[72]ABREU M T. Toll-like receptor signaling in the intestinal epithelium: how bacterial recognition shapes intestinal function[J]. Nat Rev Immunol, 2010, 10(2): 131-143.
[73]BEMET M F, BRASSART D, NEESER J R, et al. Adhesion of human bifidobacterial strains to cultured hurnan intestinal epithelial cells and inhibition of enteropathogen-cell interactions[J]. Appl Euviron Mierobiol, 1993, 59(12): 4124-4128.
[74]FOURNIAT J, COLOMBAN C, LIME C, et al. Heat-killed Lactobacillus acidophilus inhibits adhesion of Eseherichia coli B41 to HeLa cells [J]. Ann Rech Vet, 1992, 23(4): 361-370.
[75]NISKANEN L, LAAKSONEN D E, KRISTIINA NYYSSONEN K, et al. Inflammation, abdominal obesity and smoking as predictors of hypertension[J]. Hypertension, 2004, 44(6): 859.
[76]MONTEIRO R, AZEVEDO I. Chronic inflammation in obesity and the metabolic syndrome[J]. Mediators of Inflammation, 2010, 2010: 1-10.
[77]MATARESE G, CAVA L A. The Intricate Interface between immune system and metabolism[J]. Trends in Immunology, 2004, 25(4): 193-200.
[78]HOTAMISLIGIl G S, ERBAY E. Nutrient sensing and inflammation in metabolic diseases[J]. Nat Rev Immunol, 2008, 8(12): 923.
[79]BENSINGER S J, TONTONOZ P. Integration of metabolism and inflammation by lipid-activated nuclear receptors[J]. Nature, 2008, 454: 470-477.
[80]HOTAMISLIGIl G S. Inflammation and metabolic disorders[J]. Nature, 2006, 444: 860-867.
[81]KONNER A C, BRUNING J C. Toll-like receptors: linking inflammation to metabolism[J]. Trends in Endocrinology and Metabolism, 2011, 22(1): 16-23.
[82]WOLOWCZUK I, VERWAERDE C, VILTART O. Feeding our immune system: impact on metabolism[J]. Clinical and Developmental Immunology, 2008, 2008: 639803.
[83]毛煒翔, 高金燕, 陳紅兵. 小麥過敏研究進展[J]. 食品科學, 2007, 28 (8): 559-562.
[84]de la SERRE C B, ELLIS C L, LEE J, et al. Propensity to high-fat dietinduced obesity in rats is associated with changes in the gut microbiota and gut inflammation[J]. American Journal of Physiology Gastrointest Liver Physiology, 2010, 299(2): G440-G448.
[85]ANDREASEN A S, KRABBE K S, KROGH-MADSEN R, et al. Human endotoxemia as a model of systemic inflammation[J]. Current Medicinal Chemistry, 2008, 15(17): 1697-1705.
[86]GHANIM H, ABUAYSHEH S, SIA C L, et al. Increase in plasma endotoxin concentrations and the expression of Toll-like receptors and suppressor of cytokine signaling-3 in mononuclear cells after a high-fat, high-carbohydrate meal[J]. Diabetes Care, 2009, 32(12): 2281-2287.
[87]LEEL J Y, HWANG D H. The modulation of inflammatory egne expression by lipids: mediation through Toll-like receptors[J]. Mol Cells, 21, 21(2): 174-185.
[88]TAN Bie, LI Xinguo, KONG Xiangfeng, et al. Dietary L-arginine supplementation enhances the immune status in early-weaned piglets[J]. Amino Acids, 2009, 37(2): 323-331.
[89]LI Peng, YIN Yulong, LI Defa, et al. Amino acids and immune function [J]. British Journal of Nutrition, 2007, 98(2): 237-252.
[90]鄭麗坤, 張磊, 陳乃耀. 維甲酸和腸道免疫穩態[J]. 世界華人消化雜志, 2008, 16(8): 885-891.
[91]MUCIDA D, PARK Y, KIM G, et al. Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid[J]. Science, 2007, 317: 256-260.
[92]陶月紅. 維生素A對樹突狀細胞的調節及其在黏膜免疫中的作用[D].上海: 復旦大學, 2006.
[93]HSU A, BRUNO S R, LO..HR C V, et al. Dietary soy and tea mitigate chronic inflammation and prostate cancer via NF-κB pathway in the noble rat model[J]. Journal of Nutritional Biochemistry, 2010, 22(5): 502-510.
[94]FRAUWIRTH K A, RILEY J L, HARRIS M H, et al. The CD28 signaling pathway regulates glucose metabolism[J]. Immunity, 2002, 16(6): 769-777.
[95]HEALY D A, WATSON R W, NEWSHOLME P. Glucose, but not glutamine, protects against spontaneous and anti-fasantibody-induced apoptosis in human neutrophils[J]. Clinical Science, 2002, 103(2): 179-189.
[96]NOWELL M A, RICHARDS P J, HORIUCHI S, et al. Soluble IL-6 receptor governs IL-6 activity in experimental arthritis: blockade of arthritis severity by soluble glycoprotein 130[J]. Journal of Immunology, 2003, 171(6): 3202-3209.
[97]PLOMGAARD P, FISCHER C P, IBFELT T, et al. Tumor necrosis factor-α modulates human in vivo lipolysis[J]. Journal of Clinical Endocrinology & Metabolism, 2008, 93(2): 543-549.
[98]DONG Z M, GUTIERREZRAMOS J C, COXON A, et al. A new class of obesity genes encodes leukocyte adhesion receptors[J]. Proc Natl Acad Sci USA, 1997, 94(14): 7526-7530.
[99]TOUFEKTSIAN M C, SALEN P, LAPORTE F, et al. Dietary flavonoids increase plasma very long-chain (n-3) fatty acids in rats[J]. The Journal of Nutrition, 2010, 11(3): 1-5.
[100]董英, 張慧慧. 苦瓜多糖降血糖活性成分的研究[J]. 營養學報, 2008, 30(1): 54-56.
[101]BOSI E, MOLTENI L, RADAELLI M G, et al. Increased intestinal permeability precedes clinical onset of type 1 diabetes[J]. Diabetologia, 2006, 49(12): 2824-2827.
[102]張晗, 壽松濤, 崔書章. 堿性磷酸酶在膿毒癥中的臨床意義[J]. 世界急危重病醫學雜志, 2007, 4(5): 2071-2073.
[103]LI Qiurong, ZHANG Qiang, WANG Meng, et al. n-3 polyunsaturated fatty acids prevent disruption of epithelial barrier function induced by proinflammatory cytokines[J]. Molecular Immunology, 2008, 45(5): 1356-1365
[104]劉玉江. 膳食纖維對實驗性結腸炎大鼠腸黏膜屏障的影響[D]. 太原:山西醫科大學, 2010.
[105]湯健, 溫紹君, 王佐廣, 等. 動物與臨床試驗: 評價大豆低聚肽的降血壓效果[J]. 食品與發酵工業, 2006, 32(3): 11-13.
[106]丁志山, 高承賢, 陳鈮鈹, 等. 姜黃素具有抑制血管生成與誘導腫瘤細胞凋亡雙重作用[J]. 中國藥理學通報, 2003, 19(2): 171-173.
[107]SIVAGNANAM P, KOUTSOUMPAS A, FORBES A. Respiratory symptoms in patients with inflammatory bowel disease and the impact of dietary salicylates[J]. Digestive and Liver Disease, 2007, 39(3): 232-239.
[108]MAHADEVA R, WALSH G, FLOWER C D, et al. Clinical and radiological characteristics of lung disease in inflammatory bowel disease[J]. Eur Respir, 2000, 15(1): 41-48.
[109]TARHAN O R, CEYLAN B G, KAPUCUOGLU N, et al. Activated protein C and normal saline infusion might prevent deleterious effects of remote acute lung injury caused by intestinal ischemia-reperfusion: an experimental study in the rat model[J]. Journal of Surgical Research. 2011, 168(1): e81-e86.
[110]劉輝. 吸入維生素A與布地奈德對難治性哮喘大鼠肺部病理及TSLP表達的影響[D]. 合肥: 安徽醫科大學, 2008.
[111]BISWAS S, RAHMAN I. Modulation of steroid activity in chronic inflammation: a novel anti-inflammatory role for curcumin[J]. Mol Nutr Food Res, 2008, 52(9): 987-994.
[112]KNEKT P, KUMPULAINEN J, JARVINEN R, et al. Flavonoid intake and risk of chronic diseases[J]. Am J Clin Nutr, 2002, 76(3): 560-568.
[113]WALDA I C, TABAK C, SMIT H A, et al. Diet and 20-year chronic obstructive pulmonary disease mortality in middle-aged men from three european countries[J]. Eur J Clin Nutr, 2002, 56(7): 638-643.
[114]MEJA K K, RAJENDRASOZHAN S, ADENUGA D, et al. Curcumin restores corticosteroid function in monocytes exposed to oxidants by maintaining HDAC2[J]. Respir Cell Mol Biol, 2008, 39(3): 312-323.
[115]GRIDER J R, KUEMMERLE J F, JIN J G. 5-HT released by mucosal stimuli initiates peristalsis by activating 5-HT4/5-HT1p receptors on sensory CGRP neurons[J]. Am J Physiol, 1996, 270(5 Pt 1): G778-G782.
[116]SCHMIDT E D, JANSZEN A W, WOUTERLOOD F G, et al. Interleukin-1-induced long-lasting changes in hypothalamic corticotropinreleasing hormone (CRH): neurons and hyperresponsiveness of the hypothalamus-pituitary-adrenal axis[J]. J Neurosci, 1995, 15(11): 7417-7426.
[117]UYSAL K T, WIESBROCK S M, MARINO M W, et al. Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function [J]. Nature, 1997, 389: 610-614.
[118]PLOMGAARD P, NIELSEN R A, FISCHER P C, et al. Associations between insulin resistance and TNF-α in plasma, skeletal muscle and adipose tissue in humans with and without type 2 diabetes[J]. Diabetologia, 2007, 50(12): 2562-2571.
[119]FAROOQI I S, KEOGH J M, GSH Y, et al. Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene[J]. N Engl J Med, 2003, 348(12): 1085-1095.
[120]BACKHED F, DING Hao, WANG Ting, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101 (44): 15718-15723.
[121]HOLMES E, LOO R L, STAMLER J, et al. Human metabolic phenotype diversity and its association with diet and blood pressure[J]. Nature, 2008, 453: 396-401.
The Role of the Gastrointestinal Tract: A Bridge between Food Nutrition and Health
RUAN Zheng1,DENG Ze-yuan1,WU Guo-yao2,YIN Yu-long1,3,*
(1. College of Life Science and Food Engineering, Nanchang University, Nanchang 330031, China;
2. College of Agriculture and Life Sciences, Texas A&M University, Texas 77843-2471, USA;
3. Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China)
Health improvement will become one of the most important challenges for countries in the 21st century. The consumption of healthy foods is the best way for people to prevent chronic disease. In this paper, the interactions among food compositions, microbes and their metabolites in the intestine as well as intestinal structure and functions are summarized. The gastrointestinal tract plays a vital role in whole-body homeostasis, whereas foods can provide nutrients and regulate biological activity to affect the initial events of a phenomenon and the mid-term bidirectional effects.
food;nutrition;health;gastrointestinal tract
TS201.4
A
1002-6630(2012)11-0273-10
2011-05-26
阮征(1978—),男,副教授,博士,研究方向為功能食品與營養代謝調控。E-mail:ezruan@yahoo.com
*通信作者:印遇龍(1956—),男,教授,博士,研究方向為分子營養。E-mail:yyulong2003@yahoo.com.cn

