基于六西格瑪管理的藥品生產內控標準制定方法研究
北京市藥品監督管理局昌平分局(102200)徐立民 張來俊 梁建貞 董磊
根據休哈特控制圖原理和六西格瑪管理理論[1],在藥品生產過程中,在嚴格控制生產過程的前提下,影響藥品質量屬性的工藝參數在控制范圍之內有微小波動屬于正常現象。為防止波動過大導致過程失控而出現非預期的偏差,藥品生產質量管理規范(2010年修訂)(以下簡稱新版GMP)管理提出質量風險管理,提出警戒限度與糾偏限度的管理理念,企業內控標準中的這些限度值如何設定才能達到理想效果?
筆者通過調查研究轄區14家藥品生產企業的質量管理水平,發現部分企業制定的內控標準不合理,沒有根據產品質量年度回顧分析結果,確認工藝穩定可靠性,沒有確認原輔料、成品現行質量標準的適用性。本文基于六西格瑪管理相關理論,討論如何結合實際生產的歷史數據制定科學合理的企業內控標準。
1 內控標準的理解
1.1 企業內控標準
藥品生產企業內控標準是生產企業制定的工藝參數控制標準和嚴于國家藥品標準的產品質量檢驗標準。內控標準包括原輔料、包材、中間體、半成品和成品的質量內控標準,工藝參數的上、下控制限度。在新版GMP中提出的警戒限度與糾偏限度,也應該是企業內控標準的一部分。
1.2 新版GMP的要求
新版GMP規定,如果系統的關鍵參數超出了“可接受標準”(法定標準或企業制定的內控標準),就需要啟動偏差處理程序。按照GMP產品質量回顧分析的要求,藥品生產企業必須對過去的批生產記錄、批檢驗記錄進行回顧性分析。以此修改完善工藝規程和標準操作規程。
1.3 企業內控標準設定的目的及意義
在法定標準的基礎上制定更加嚴格的企業內控標準,是加強藥品生產過程的質量控制,確保藥品安全、有效的重要舉措。制定科學合理的內控標準,才能持續穩定地生產出符合預定用途和注冊要求的藥品。
2 基本概念和原理
2.1 基本概念
警戒限度是系統的關鍵參數超出“正常范圍”,但是未達到糾偏限度,需要引起警覺,可能需要采取糾正措施的限度標準[2]。
糾偏限度是系統的關鍵參數超出“可接受標準”,需要進行調查并采取糾正措施的限度標準[2]。
規格限度是六西格瑪管理理論提及的概念,它是過程能力分析時必須使用的參數。規格限度由國家法定標準、客戶的合同要求以及企業制定的內控標準確定。控制限度是休哈特控制圖原理中提到的概念,用以區分偶然波動與異常波動,并用以考察過程是否穩定受控。常用±3σ來求得上、下控制限,σ為標準差。
嚴格受控的過程通常是在上下控制限度內波動,上、下控制限確定的范圍應該就是警戒限度概念中提及的“正常范圍”。規格限度與糾偏限度形式上雖是兩個不同的概念,但本質上屬于同一個概念。
以葡萄糖注射液的含量為例,《中國藥典》(2010版)二部規定,葡萄糖注射液含葡萄糖應為標示量的95.0%~105.0%。法定標準規定的規格限度就是95.0%~105.0%,容差T=10%;目標值M與有效成分標示量相關,M=100.0%。見下圖所示:
在新版GMP中,對制藥用水微生物總數,潔凈車間內塵埃粒子數及微生物總數,提出了制定警戒限度與糾偏限度的要求。對于其他需要嚴格控制的關鍵生產工序,可參照執行。
2.2 從嚴制定企業內控標準,過程能力應滿足的前提條件
基于休哈特控制圖原理和六西格瑪管理理論,生產過程控制能力務必要達到四西格瑪質量水平。按法定標準規定的規格限度計算過程能力指數,CPK值務必大于或等于1.33。否則,過程控制能力不足,就要改進過程控制。對于某些關鍵工序的工藝參數,如果沒有法定標準要求,其過程能力也要充分滿足研發設計的要求,CPK值也要務必大于或等于1.33。

注釋:控制點1處設置警戒限度;在控制點2處設置糾偏限度
按法定標準判定過程能力充裕前提下,才能從嚴制定企業內控標準。基于六西格瑪管理理論,在顧及糾偏概率的基礎上,設置警戒限度和糾偏限度。
2.3 利用控制圖原理判斷過程的穩定性
根據控制圖判異的“八原則”判斷過程的穩定性[3]。若違背控制圖的任何一條原則,則過程不穩定,企業應采取糾正措施,調查原因,消除影響質量波動的因素,確保過程能力指數CPK值能達到要求。
2.4 在過程穩定的基礎上,根據CPK的大小設定企業內控標準

其中,USL為規格上限;LSL為規格下限;T為容差,即規格上限(USL)減去規格下限(LSL)的差值;ε為實際分布中心μ值與目標值M的偏移量,即ε=∣M-μ∣;σ為過程分布的標準差;CPU為上單側過程能力指數;CPL為下單側過程能力指數。
有雙側規格限度的過程,才有中心目標值M。對于成品質量指標,目標值M由國家藥品標準規定;對于生產工藝參數的控制標準,如果國家藥品標準中沒有明確規定的,企業應在研發設計階段設定上、下控制限度和中心目標值M。
以法定標準或企業研發設計的工藝參數控制標準,作為規格限度,計算過程能力指數。按過程能力指數的大小分類,有下述三種情形。
2.4.1 當CPK>2時,過程控制能力過度充裕
說明法定標準或研發設計的工藝參數控制標準過于寬松,要從嚴制定企業內控標準。具體計算方法與過程能力充裕時的情形相同。
2.4.2 當1.33≦CPK≦2時,過程能力充裕
按過程能力指數計算公式,可推出T=6σ×CPK+2ε,根據六西格瑪設計原理,令過程能力指數CPK=1,求得T=6σ+2ε。T值確定之后,建立如下一元二次方程:

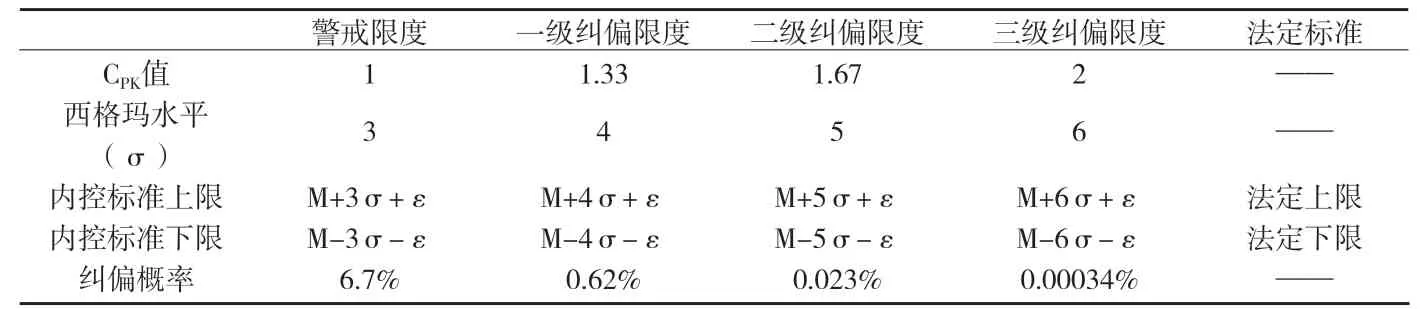
附表1 警戒限度及各級內控標準設定的范圍和糾偏概率表

附表2 XX化學藥膠囊劑24批的成品主成分相對百分含量
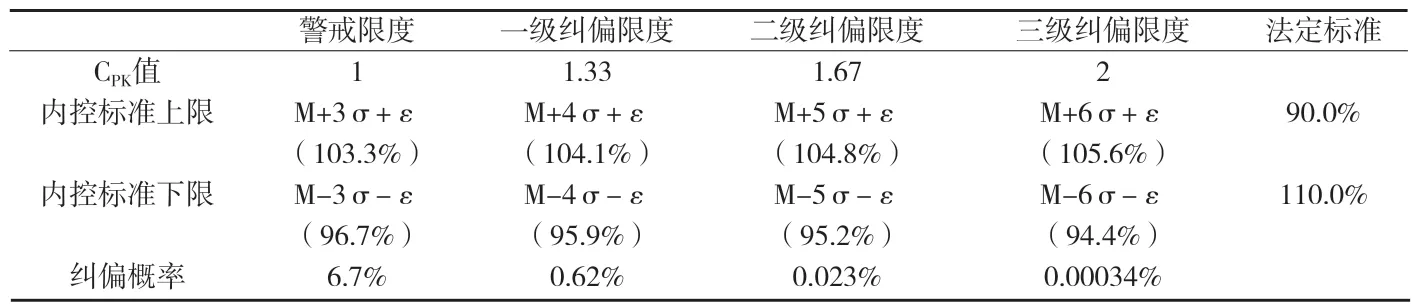
附表3 XX化學藥膠囊劑警戒限度與糾偏限度計算結果
可求出USL=M+3σ+ε和LSL=M-3σ-ε。求得的USL作為警戒上限;求得的LSL作為警戒下限。
采用同樣的方法計算糾偏限度,分別令過程能力指數CPK=1.33;CPK=1.66;CPK=2,分別求得USL和LSL。CPK=1.33,對應一級糾偏限度;CPK=1.66,對應二級糾偏限度;CPK=2,對應三級糾偏限度。
企業可根據實際生產情況,選擇合理的限度作為糾偏限度。按上述辦法,不同的糾偏限度,糾偏概率也不一樣,其關系見附表1。
2.4.3 當CPK<1.33時,過程能力不足過程能力指數計算公式

從過程能力指數計算公式可以看出,影響過程能力指數CPK大小有三個因素:容差T值、過程漂移量ε值、過程控制標準差σ值。
如果CPK<1.33,但CP≥1.33,此時優先考慮減小ε值。讓實際過程分布中心μ值盡可能接近規格中心M值。如西藥有效成分的相對百分含量的平均值μ小于目標值100.0%,可采用追加投料的方法,提高平均含量μ值。
如果CPK<1.33,同時CP<1.33,此時優先考慮減小σ值。減小σ的措施,應分析人、機、法、料、環、測六要素對過程的影響,加強過程控制。
特別注意,一定要謹慎選擇擴大T值的辦法。采取上述兩項措施后,過程能力仍然不足,說明容差T值過小。容差T值如果是企業制定的內控規格限度,相對法定標準還有放寬的余地,可增加T值,但不得比法定標準更寬松。如果T值就是法律法規設定的規格限度,企業就不可放大T值,應該考慮和分析過程設計是否存在重大缺陷。
3 案例分析
3.1 有雙側控制限的實例
以某企業的XX膠囊劑成品的含量為例,按《中國藥典》(2010年版)二部規定,本品含X X 應為標示量的90.0%~110.0%。企業制定的內控標準為93.0%~107.0%。
第一步:收集該產品連續的24批成品的含量,見附表2。
第二步:判斷過程能力是否滿足6σ管理要求,用Minitab軟件做出該組數據的六合圖,見上圖。
從右上方的能力直方圖和右中方的正態概率圖可看出該過程是呈正態分布的,P值為0.888(P>0.05);從左上方的單值控制圖、左中方的移動極差控制圖和最后25個觀測值的散點圖可看出無異常點出現,該過程是穩定的;從右下方的能力圖可看出,該過程的過程能力指數CP值為4.43,CPK值為3.96,CP值與CPK值都大于2。以法定標準90.0%~110.0%作為規格限度,判定過程能力非常充裕,遠遠地超出了六西格瑪管理的目標。
第三步:在過程穩定的前提下,計算警戒限度與糾偏限度。
分析六合圖,可得到μ和σ二個重要參數的估計值。其中,用估計μ的大小,由單值控制圖得=98.929%,即μ≈98.929%。用組內標準差估計σ的大小,σ≈0.7516%。有效成分含量目標值M=100.0%,實際過程漂移量=∣Mμ∣=∣100.0%-98.929%∣=1.071%。計算結果見附表3。
第四步:判斷現行企業內控標準的適用性。
根據計算結果,當采用三級糾偏限度94.4%~105.6%作為企業內控標準時,糾偏的可能性有0.00034%。如按此標準判斷,生產一百萬批次的產品,約有3.4批產品需要采取糾偏措施。企業現行的內控標準93.0%~107.0%,與三級糾偏限度相比,過于寬松,可將內控標準修訂為94.4%~105.6%。

XX化學藥膠囊劑24批的成品主成分含量的六合圖
3.2 只有單側規格限度的情形
對只有單側控制限的情形,因為沒有目標值,就沒有過程漂移。內控標準的計算過程要比有雙側控制限的計算過程簡單,只是在最后的計算公式上稍有區別。
3.2.1 只有上側規格限度的情況
3.2.2 只有下側規格限度的情況
4 展望
4.1 本方法的適用性
藥品生產企業按照新版GMP的要求,開展年度質量回顧分析工作,必須基于統計學原理,才能對企業制定的內控標準的適用性做出科學合理的評價。要進行統計學分析,就必須有大量的歷史數據。因此,此方法僅適用于已經上市且生產批次較多(建議30批以上)的產品。對于新上市或年生產批次很少的產品,企業可積累數據,按GMP的要求,適時開展年度質量回顧工作或趨勢分析,加強質量監控。
4.2 關于警戒限度與糾偏限度
在新版GMP中,對制藥用水的微生物限度,藥品生產潔凈環境的塵埃粒子數和微生物個數,提出了制定警戒限度與糾偏限度的要求。塵埃粒子數、微生物總數屬于計數型數據。因此,不能用正態分布規律去估計總體分布的均值和標準差。這兩項計數型質量指標服從于泊松(Poisson)分布,應使用泊松分布規律去估計總體分布的均值和標準差。
4.3 關于中藥制劑
新版GMP要求中藥制劑企業,制定中藥提取物的收率限度范圍。中藥材作為中藥制劑生產原料,其提取物的收率波動范圍也很大。但無論有多大,理論上也應服從正態分布。但實際有待結合具體案例進行分析研究。
4.4 其他方面當前,醫療器械生產企業正在實施GMP,保健食品生產企業GMP正在制定過程中。

