阿魏酸、根皮素和水溶性VE的抗氧化協同效應及其配方優化
孫 玥,余燕影,*,曹樹穩,2
(1. 南昌大學理學院,江西 南昌 330031; 2.南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
阿魏酸、根皮素和水溶性VE的抗氧化協同效應及其配方優化
孫 玥1,余燕影1,*,曹樹穩1,2
(1. 南昌大學理學院,江西 南昌 330031; 2.南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
采用等效面分析法對抗氧化劑配方阿魏酸、根皮素和水溶性VE清除DPPH自由基能力、還原Fe3+能力及清除ABTS+·能力進行協同性分析,結果表明:隨配方中各成分含量不同則呈現出協同、拮抗和相加效應;以歸一值(OD值)作為整體效應評價指標并采用響應面優化法(RSM法)進行配方優化,優化模型顯示,綜合效應最優配方為:阿魏酸34.9%、根皮素35.1%、水溶性VE 30%。
阿魏酸;根皮素;水溶性VE;抗氧化;等效面分析;響應面
食用抗氧化功效因子是食品中含有的天然和合成的可食用且具有抗氧化功效的化合物總稱,其在體內一般通過清除自由基、絡合屏蔽催化氧化的金屬離子、使催化氧化反應的酶失活、影響基因表達和保護DNA、蛋白質和不飽和脂肪酸等生物分子免受損傷等途徑發揮作用[1],阿魏酸、根皮素和水溶性VE(結構見圖1)是3種天然抗氧化功效因子,目前廣泛應用于醫藥、食品、化妝品等領域。阿魏酸既是藥食兩用植物川芎,當歸中的主要有效成分,又在咖啡、香蘭豆、谷殼、蔗渣、甜菜粕、麥麩和米糠及中藥阿魏、升麻、木賊中有廣泛的分布。阿魏酸是公認的強抗氧化功效因子,具有抗氧化、清除自由基、保護細胞、調節中樞神經、改善血液和心血管系統功能、抗癌抗突變功效[2];根皮素是近年來國外研究較多的一種具有明顯生物活性的新型天然食用抗氧化功效因子,具有抗氧化[3]、抗突變[4]、抗炎及免疫抑制作用[5]。VE具有抗氧化、延緩衰老、免疫調節、預防糖尿病并發癥和動脈粥樣硬化、輔助治療癌癥及抗不育功能,目前國內外廣泛將之用于配方食品(含保健食品)、藥品及化妝品領域[6]。許多研究發現,多種抗氧化功效因子聯合使用比單一組分有更好的抗氧化效果[7],即呈現協同作用。其作用可能源于其相互之間構成了氧化還原循環系統的不同作用部位,或其不同作用機制之間存在明顯的互補作用或相互修復作用[8-11]。目前有關抗氧化功效因子之間的協同增效作用研究主要局限于兩組分單指標評價模式[12-13],三組分以上抗氧化功效因子間協同增效作用評價模型僅見Liu Donghong等[14]報道。本工作擬采用等效面分析法對阿魏酸、根皮素和水溶性VE 3組分復合抗氧化劑在抗氧化體外模型中聯合作用效果進行研究,并在此基礎上對其配方進行優化,為進一步研究復合抗氧化劑的協同作用和配方優化提供一種新方法。
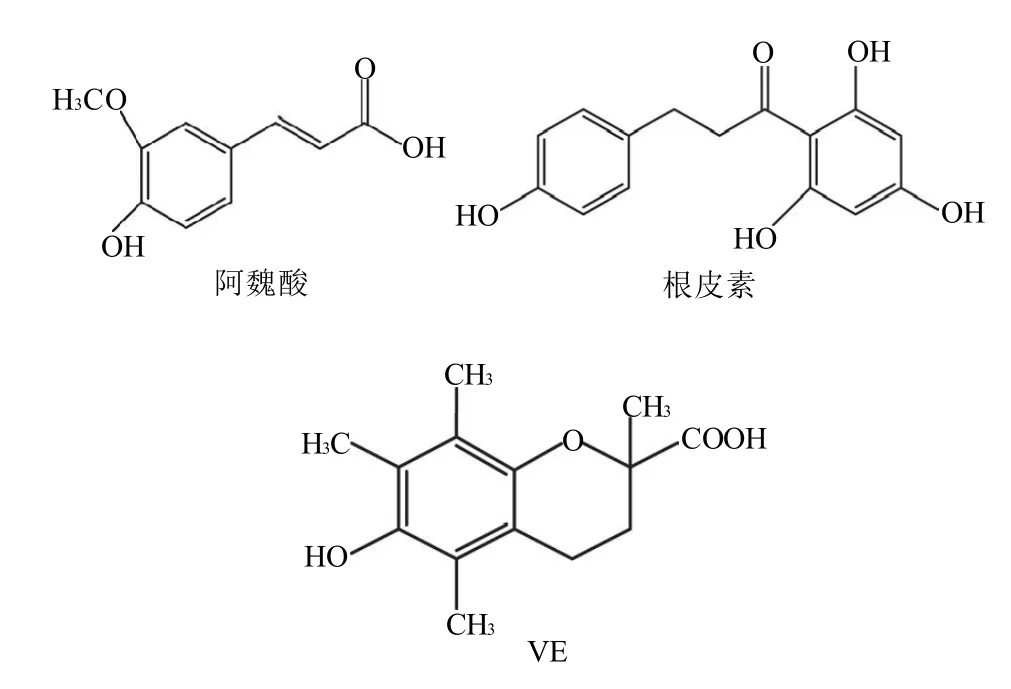
圖1 阿魏酸、根皮素和Trolox的結構Fig.1 Chemical structures of ferulic acid, phloretin and soluble vitamin E
1 材料與方法
1.1 材料與儀器
阿魏酸(Fer)、根皮素(Phl)、水溶性VE(Tro)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-聯氮基雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(ABTS) 美國Sigma公司;鐵氰化鉀(分析純) 廣州化學試劑廠;磷酸二氫鈉、三氯化鐵、磷酸氫二鈉(分析純)、三氯乙酸(分析純) 廣東西隴化工廠;90%乙醇;超純水。
UV-2450 紫外-可見分光光度計 日本島津公司;PHS-3C 精密酸度計 上海虹益儀器儀表有限公司;HH-1恒溫水浴鍋 國華電器有限公司。
1.2 方法
1.2.1 試劑配制
將阿魏酸、根皮素、水溶性VE減壓干燥(40℃)2h,取所需用量,用乙醇溶解成終濃度為1μmol/L的儲備液,由儲備液配制成所需的比例,冷藏。
ABTS儲備液的配制:將常溫、避光靜置過夜(16h)的5mL 7mmol/L的ABTS陽離子/ K2S2O8儲備液用80%乙醇溶液稀釋成工作液,要求在常溫下 734nm波長處吸光度為0.7±0.02。
1.2.2 抗氧化模型
1.2.2.1 DPPH 模型
DPPH自由基是一種穩定的自由基,依靠整個分子上備用電子的離域作用而保持穩定,以致不能形成二聚體。當DPPH溶液與能提供氫原子的抗氧化劑混合時,被還原,顏色發生變化,由深紫色變為淡黃色,常用紫外可見分光光度法測定其吸光度[15]。改進Maisuthisakul等[16]方法,DPPH配制成6×10-5mol/L,0.5mL DPPH與不同濃度的受試物混合,用無水乙醇定容到5mL,充分搖勻。室溫暗光下反應30min,在波長517nm處測定其吸光度,平行3次。DPPH自由基清除能力由式(1)計算。
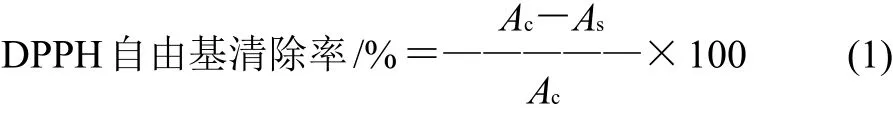
式中:Ac為未加受試物的吸光度;As為加受試物的吸光度。
1.2.2.2 Fe3+還原模型
參照Lee 等[17]方法,取2.5mL不同濃度的受試物與2.5mL的PBS(pH6.6)緩沖溶液混合后,加2.5mL質量分數為 1%的鐵氰化鉀溶液于50℃水浴20min,然后加入2.5mL三氯乙酸(質量分數10%),混勻。降到室溫后,取2.5mL上清液,加入0.5mL三氯化鐵(質量分數0.1%)溶液,用蒸餾水定容至5mL,完全顯色后以試劑空白做參比,于波長700nm處測吸光度,吸光度越強,還原能力越強。
1.2.2.3 ABTS模型
ABTS經氧化后生成穩定的藍色陽離子自由基ABTS+·,抗氧化物質與ABTS+·發生反應而使反應體系褪色。參照Ozgen等[18]的方法,經改進,4.5mL的ABTS+·工作液與不同濃度受試物混合,無水乙醇定容至5mL,常溫避光靜置6min,在734nm波長處測吸光度,平行3次。
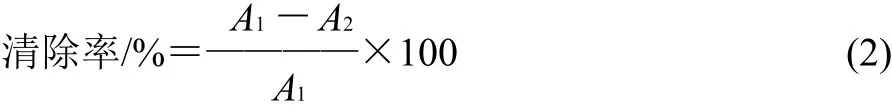
式中:A1為不加樣品,加入ABTS的吸光度;A2為加入樣品和ABTS的吸光度。
1.2.3 協同作用分析模型
采用IC50值(半數抑制率值)為評估抗氧化能力大小的指標。協同效果的評價采用等效面分析法分析。
等效面分析法:本研究按 Luszczki等[19]報道的等輻射法并略加改進,研究3組分抗氧化劑協同作用,具體步驟如下:
1)選擇合適的指標。首先采用Probit 回歸分析[20]做各樣品的劑量-效應曲線,并計算IC50,平行3次。
2)采用“centroid simplex”[21]設計,設計7個比例配方,根據Loewe[22]的方法,由相加等效公式分別計算它們的理論值IC50add±s。
3)依權重計算實驗值IC50mix中各組分實際產生的抗氧化能力數值。
4)采用非配對t檢驗來檢驗理論值與實驗值之間的顯著性。
5)判斷。將3種藥物的實驗值IC50mix及95%置信區間分別繪制在三維坐標軸上,兩兩相連成等效相加面及上置信面和下置信面,將7個比例測得的IC50mix標繪在坐標軸上,點的位置由以下公式判定:設Ferc/Fers,Phlc/Phls,Troc/Tros為配方中阿魏酸,根皮素和水溶性VE占各自IC50的分數,當Ferc/Fers+ Phlc/Phls+Troc/Tros=1時,則點在平面上;當Ferc/Fers+ Phlc/Phls+Troc/Tros<1時點在平面下;當Ferc/ Fers+ Phlc/Phls+Troc/Tros>1時點在平面上,如果點落在下置信面下方則為協同,在上置信面上方為拮抗,落在中間置信區間區域內為相加作用。
1.2.4 配方優化模型
響應面(RSM)是將數學與統計學結合起來,在響應指標與因素之間建立起某種經驗模型的一種技術,主要通過多元回歸分析法分析實驗設計所獲得的定量數據同時解決多元方程,常用來研究交互關系及優化實驗條件[23]。比例優化采用“centroid simplex”設計,選擇線性、二項式或立方模型去擬合數據,失擬程度(lack-of-fit)顯著性差異采用P<0.05[24-25],模型質量采用單因素方差分析,優化方法依據Derringer等[26]的方法,優化方程如下:

1.2.5 統計學處理
2 結果與分析
2.1 協同分析

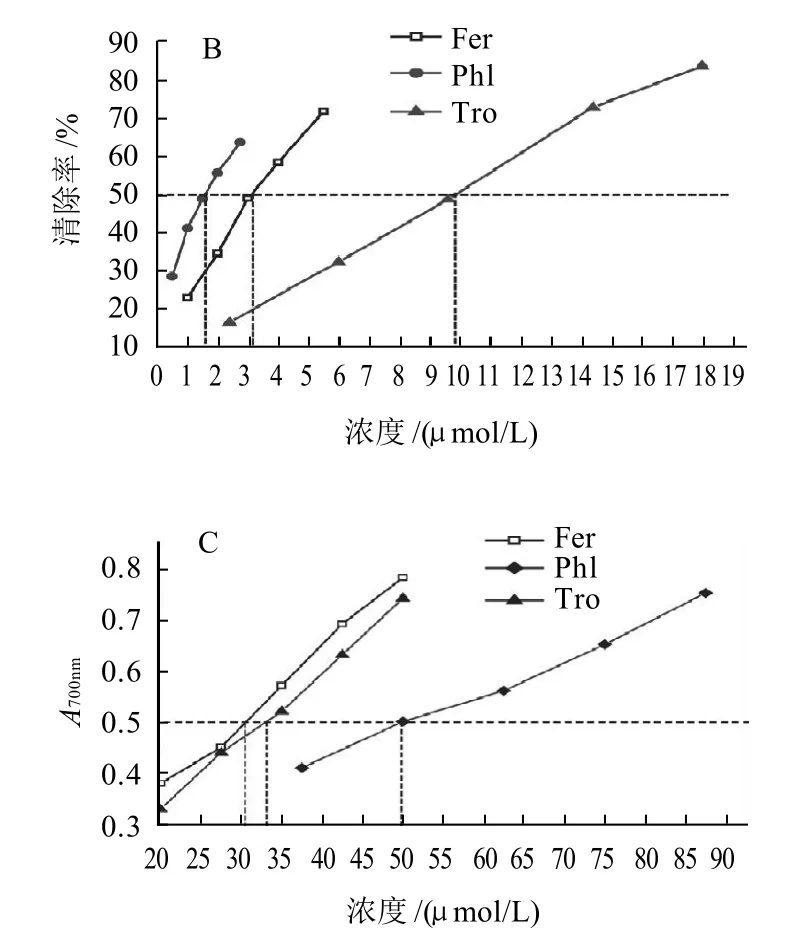
A.清除DPPH自由基能力;B.清除ABTS+·能力;C.還原Fe3+能力。
由圖2可知,受試樣品在3種抗氧化模型中均有良好的抗氧化效果,抗氧化能力隨著樣品濃度的增加而增強,呈現一定的量效關系,且在同種模型中,任意同等濃度3種樣品抗氧化活性大小順序一致。3種物質在3種抗氧化模型中抗氧化能力大小順序不同。在DPPH模型中,3種抗氧化劑的抗氧化能力大小是水溶性VE>阿魏酸>根皮素,其IC50mix(95%置信區間)分別為阿魏酸22.746(20.335~25.156)μmol/L、根皮素46.980(42.983~50.976)μmol/L、水溶性VE 10.348(9.312~11.384)μmol/L。DPPH模型機理是自由基接受抗氧化劑的活潑氫或電子而褪色,其抗氧化活性大小與酚羥基官能團的數目有關[27-28],可能與3種樣品的分子結構及失去活性后半醌式自由基穩定性及溶劑的極性和物質在溶劑中的溶解度有關[29]。在Fe3+還原模型中,同等濃度下,3種抗氧化劑的活性大小為阿魏酸>水溶性VE>根皮素,其抗氧化強度IC50mix(95%置信區間)分別為阿魏酸30.080(28.952~31.207)μmol/L、根皮素51.278(49.318~53.239)μmol/L、水溶性VE 32.672(31.160~34.185)μmol/L。在此模型中Fe3+獲得由抗氧化劑提供的電子,進而被還原成Fe2+,用于測定抗氧化物質基于電子轉移的總的抗氧化能力的大小。樣品清除ABTS+·的能力與清除DPPH自由基的能力順序相反,根皮素最強,阿魏酸次之,水溶性VE最弱,其IC50mix(95%置信區間)分別為1.502(1.460~1.544)μmol/L、3.360(3.006~3.715)μmol/L、9.712(9.244~10.180)μmol/L。3種抗氧化劑在3種體外化學模型中協同作用分析分別見表1~3。

表1 3種抗氧化劑在DPPH模型中協同作用效果分析Table 1 Synergistic DPPH free radical scavenging activity of three antioxidants

表2 3種抗氧化劑在Fe3+還原模型中協同作用效果分析Table 2 Synergistic Fe3+ reducing power of three antioxidants
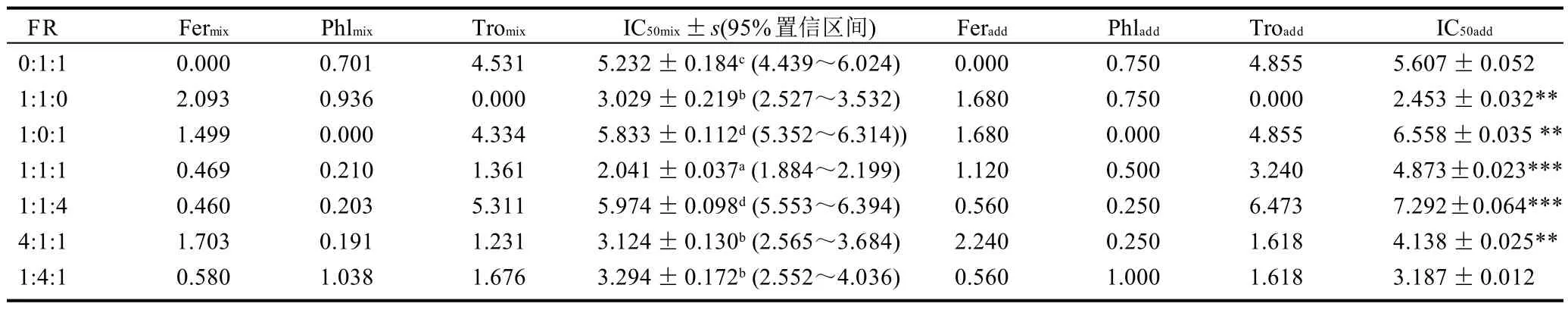
表3 3種抗氧化劑在ABTS+·模型中協同作用效果分析Table 3 Synergistic ABTS free radical scavenging activity of three antioxidants
由表1~3可知,在清除DPPH模型中7種配方的IC50mix值中單種物質所占的比重均低于理論上所占的比重,且實際產生的效應均低于理論上所產生的效應。Fer∶Phl∶Tro 為 1∶1∶4 時有最強的抗氧化效果,IC50mix為(13.837 ± 0.754)μmol/L;在還原 Fe3+模型中 Fer∶Phl∶Tro 4∶1∶1 的 IC50mix值(33.371± 0.258)μmol/L 低于理論值(34.045±0.206)μmol/L,且低于其他配方的IC50mix值;由此可見當配方中抗氧化活性較強的組分含量較大時其抗氧化效果越強,說明在DPPH模型和還原Fe3+模型中活性較強的抗氧化劑在配方中占主導作用。在ABTS模型中,根皮素是抗氧化活性較強的組分,但半數抑制率值IC50mix最小的配方不是根皮素含量高的配方Fer∶Phl∶Tro為1∶1∶4,而是Fer∶Phl∶Tro 為 1∶1∶1 配方,這說明協同作用占主導地位。
3種模型中非配對t檢驗結果顯示實驗測得配方的IC50mix值與由相加等效公式得到的理論值IC50add有顯著差異。one-way ANOVA(P<0.05)分析結果顯示不同比例的IC50mix之間有顯著性差異。協同分析結果見表4。
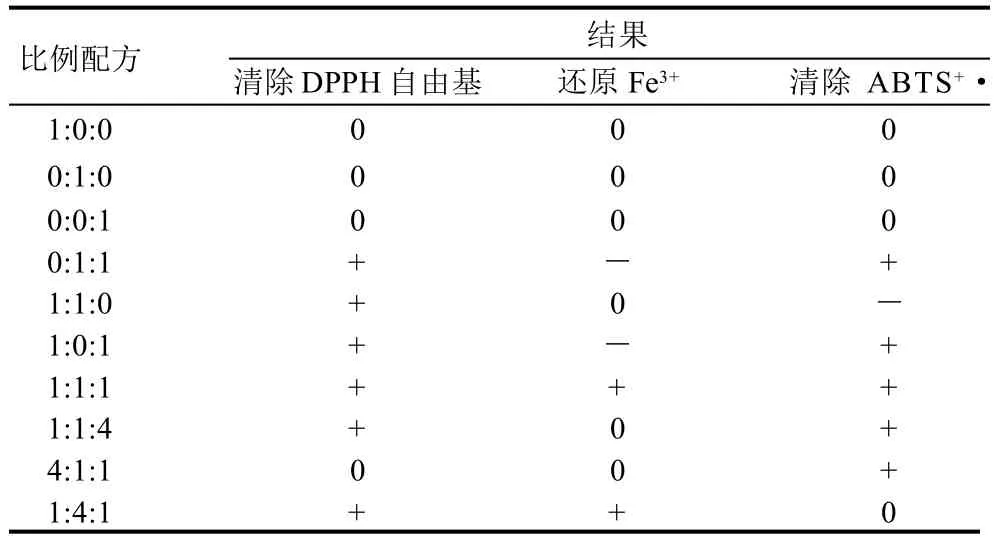
表4 3種模型中不同比例的藥物協同效應分析結果Table 4 Synergistic antioxidant effects of mixtures of three antioxidants at different ratios
由表4可知,隨組分含量的不同呈現的協同性不同,組合配方的IC50值低并不一定其協同作用就高,例如在還原Fe3+模型中4∶1∶1配方的IC50mix值比1∶4∶1配方的IC50mix值要小,然而后者具有協同作用而前者呈現相加作用。
2.2 配方優化
抗氧化功效因子的食用安全性在食品配方中是必須要考慮的因素,一是發展新型的天然可食用抗氧化功效因子,二是對已有的食用抗氧化功效因子進行配方優化。介于開發新型抗氧化功效因子的成本問題,更多趨向于配方優化。出于安全性考慮,人類在配方食品(特別是保健食品)的配方設計中總是希望在有限添加抗氧化功效因子前提下,實現目標健康效應最大化。借助抗氧化功效因子間的協同增效作用來合理設計配方有可能是實現這一目標的較好方法之一。而等效面分析結果表明在不同的模型中7種比例的IC50mix點相對于等效相加面位置不同,呈現出一定的協同、相加和拮抗作用,說明利用其協同程度的不同進行配方優化是可行的。
本實驗擬選用協同系數R為指標[30],總評“歸一值”(OD)表達整體效應[31],建立響應面數學模型進行配方優化。配方協同系數和總評歸一值見表5,響應面分析見圖3,3個模型及總評歸一中配方優化擬合方程見表6。
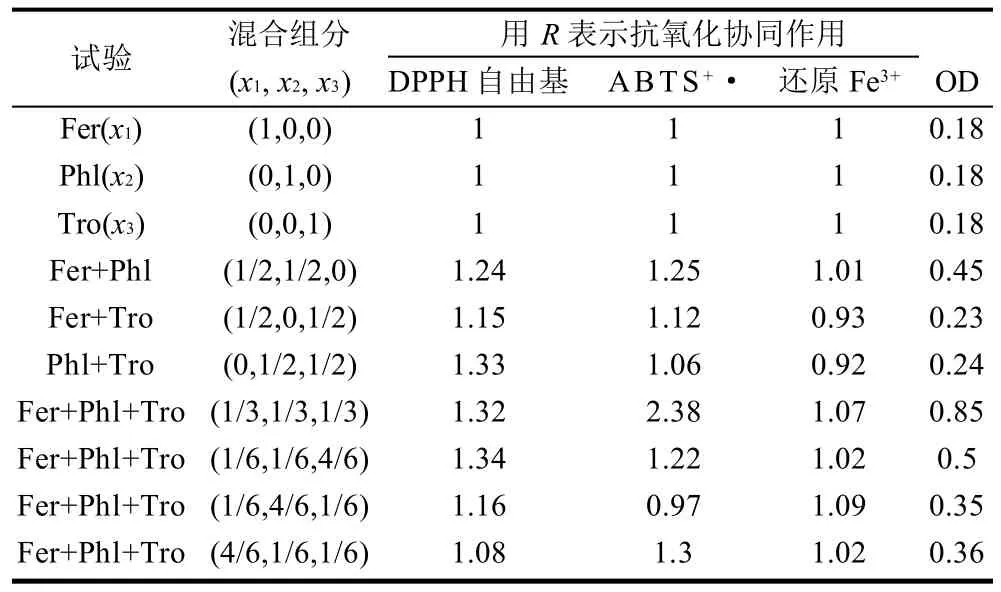
表5 配方的協同系數R及OD值Table 5 Synergistic coefficients and OD values of mixtures of three antioxidants at different ratios
在DPPH模型中采用二次項交互(quadradic)模型,模型中采用增加交互項來減小失擬程度,提高了方程的擬合效果。結果顯示P<0.0001,失擬程度為0.0096,校正擬合度(R2Adj=0.9357)與預測擬合度(R2pre= 0.8910)很接近,說明響應面方程無需做進一步優化,信噪比為13.505,模型可用于預測。優化結果顯示當x1=0.174,x2=0.306,x3=0.520,R有最高值1.36,優化方程中βPhl<βFer<βTro,說明各因素對符合抗氧化劑活性影響程度為根皮素<阿魏酸<水溶性VE,配方中水溶性VE對復合配方中的協同效應占主導地位,兩兩組分相互作用系數為正,說明兩種組分的混合對協同效果有正效應,反之則有負效應,這與前面的協同分析結果相一致。
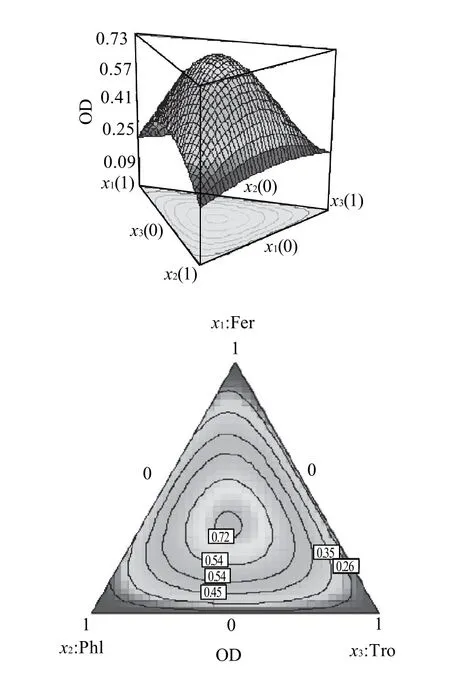
圖3 以阿魏酸,根皮素和Trolox 為變量使用擬合方程預測OD值的響應面和等高線圖Fig.3 Response surface and contour plots showing the effects of ferulic acid, phloretin and soluble vitamin E on OD value
采用Special Cubic 模型來分析ABTS模型和Fe3+還原模型,ABTS模型配方優化結果x1=0.326,x2=0.311,x3=0.363時有最大協同度(R=1.96),優化方程中根皮素與阿魏酸的擬合系數為-1.07043,說明對協同度有負貢獻,這與協同判定1∶1∶0成拮抗效應相符。Fe3+還原模型配方優化結果x1=0.366,x2=0.377,x3=0.257時有最大協同程度(R=1.10),優化方程中根皮素與水溶性VE的擬合系數為-0.31718,阿魏酸與水溶性VE的擬合系數為-0.32252,說明對協同度有負貢獻,這與協同判定1∶0∶1 和 0∶1∶1 成拮抗效應相符。

表6 在不同模型中的擬合方程Table 6 Polynomial regression equations for DPPH radical scavenging activity, Fe3+ reducing power, ABTS radical scavenging activity and OD value
采用Special Cubic 模型擬合方程來優化OD值,經過優化綜合效應模型發現當配方組成為阿魏酸34.9%、根皮素35.1%、水溶性VE 30%時OD值最大。據此,進行驗證實驗,測得其協同系數在3個模型中分別為1.31、2.12和1.10,OD值為0.84。
3 結 論
本實驗采用等效面分析法考察阿魏酸、根皮素及水溶性VE 3種抗氧化劑協同作用效果,實驗結果顯示3種物質聯合使用其抗氧化活性具有一定的協同作用,且協同度受配方比例的影響,即取相同用量不同比例的配方抗氧化劑所產生的抗氧化效果不同。
通過選用協同度R為指標,以總評“歸一值”(OD)表達整體效應建立的響應面數學模型進行配方優化,獲得最佳綜合效應配方為:阿魏酸34.9%、根皮素35.1%、水溶性VE 30%。配方組分之間的協同作用可能與3種物質的不同作用機制之間存在明顯的互補作用有關。由于抗氧化劑在不同抗氧化模型中作用機理不同,因而同一配方在不同抗氧化模型中協同效果也就不同,因此,建立一種科學客觀評價多組分食品添加劑之間協同作用效果和配方優化模型對研究食品、化妝品等體系的配方優化具有一定的理論指導意義。
[1] PACKER L, CLMAN C. The antioxidant miracle∶ your complete plant for total health and healing[M]. New York∶ Wiley, 1999∶ 14-28.
[2] 胡益勇, 徐曉玉. 阿魏酸的化學和藥理研究進展[J]. 中成藥, 2006,28(2)∶ 253-255.
[3] REZK B M, HAENEN G R, BAST A, et al. The antioxidant activity of phloretin∶ the disclosure of a new antioxidant pharmacophore in flavonoids[J]. Biochem Biophys Res Commun, 2002, 295(1)∶ 9-13.
[4] ZHANG Kai, DAS N P. Inhibitory effects of natural plant polyphenols on rat liver glutathione S-transferases[J]. Biochem Pharmacol, 1994, 47(11)∶ 2063-2068.
[5] LU Xiaoyu, ZENG Yaoying, YE Yanxia, et al. Anti-inflammatory and immunosuppressive effect of phloretin[J]. Acta Pharmaceutica Sinica,2009, 44(5)∶ 480-485.
[6] 凌關庭. 保健食品原料手冊[M]. 北京∶ 化學工業出版社, 2002∶ 213.
[7] LIU Ruihai. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals[J]. Am J Chin Nutr, 2003,78(3)∶ 517S-520S.
[8] DAI Fang, CHEN Weifeng, ZHOU Bo. Antioxidant synergism of green tea polyphenols withα-tocopherol andL-ascorbic acid in SDS micelles[J]. Biochimie, 2008, 90(10)∶ 1499-1505.
[9] ROMANO S C, ABADI K, REPETTO V, et al. Synergistic antioxidant and antibacterial activity of rosemary plus butylated derivatives[J]. Food Chemistry, 2009, 115(2)∶ 456-461.
[10] BECKER E M, NTOUMA G, SKIBSTED L H. Synergism and antagonism between quercetin and other chain-breaking antioxidants in lipid systems of increasing structural organisation[J]. Food Chemistry, 2007,103(4)∶ 1288-1296.
[11] SHROEDER M T, BECKER E M, SKIBSTED L H. Molecular mechanism of antioxidant synergism of tocotrienols and carotenoids in palm oil[J]. Journal of Agricultural and Food Chemistry, 2006, 54(9)∶ 3445-3453.
[12] CAPITANI C D, CARVALHO A C L, BOTELHO P B, et al. Synergism on antioxidant activity between natural compounds optimized by response surface methodology[J]. European Journal of Lipid Science and Technology, 2009, 111(11)∶ 1100-1110.
[13] DU Guorong, LI Mingjun, MA Fengwang, et al. Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits[J]. Food Chem, 2009, 113(2)∶ 557-562
[14] LIU Donghong, SHI J, IBARRA C I, et al. The scavenging capacity and synergistic effects of lycopene, vitamin E,vitamin C, andβ-carotene mixtures on the DPPH free radical[J]. LWT, 2008, 41(7)∶ 1344-1349.
[15] MOLYNEUX P. The use of the stable free radical diphenylpicrylhydrazyl(DPPH) for estimating antioxidant activity[J]. Songklanakarin J Sci Technol, 2006, 26(2)∶ 211-219.
[16] MAISUTHISAKUL P, PONGSAWATMANIT R, SUTTAJIT M. Assessment of phenolic content and free-radical scavenging capacity of some Thai indigenous plants[J]. Food Chem, 2007, 100(4)∶ 1409-1418.
[17] LEE Y L, YANG J H, MAU J L. Antioxidant properties of water extracts from Monascus fermented soybeans[J]. Food Chem, 2008, 106(3)∶ 1127-1137.
[18] OZGEN M, REESE R N, TULIO J A Z, et al. Modified 2, 2’-azino-bis-3-ethylbenzo thiazoline -6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2, 2 -Diphenyl-1-picrylhydrazyl(DPPH) methods[J]. Journal of Agricultural and Food Chemistry, 2006,54(4)∶ 1151-1157.
[19] LUSZCZKI J J, ANTKIEWICZ-MICHALUK L, CZUCZWAR S J.Isobolographic analysis of interactions between 1-methyl-1,2,3,4-tetrahydroisoquinoline and four conventional antiepileptic drugs in the mouse maximal electroshock-induced seizure model[J]. European Journal of Pharmacology, 2009, 602(2/3)∶ 298-305.
[20] LITCHFIELD J T, WILCOXON F. A simplified method of evaluzting dose-effect experiments[J]. J Pharmacol Exp Ther, 1949, 96(2)∶ 99-113.
[21] CHEN Rongzhi, ZHANG Zhenya, FENG Chuanping, et al. Application of simplex-centroid mixture design in developing and optimizing ceramic adsorbent for As(V) removal from water solution[J] . Microporous and Mesoporous Materials, 2010, 131(1/3)∶ 115-121.
[22] LOEWE S. The problem of synergism and antagonism of combined drugs[J]. Arzneimittel Forschung, 1953, 3(6)∶ 285-290.
[23] MONTGOMERY D C. Design and analysis of experiments[M]. 3rd ed.New York∶ Wiley, 1991.
[24] HASAN S H, SRIVASTAVA P, TALAT M. Biosorption of Pb(II) from water using biomass ofAeromonas hydrophila∶ central composite design for optimization of process variables[J]. J Hazard Mater, 2009, 168(2/3)∶ 1155-1162.
[25] ZULKALI M M D, AHMAD A L, NORULAKMAL N H.Oryza sativaL. husk as heavy metal adsorbent∶ optimization with lead as model solution[J]. Bioresource Technol, 2006, 97(1)∶ 21-25.
[26] DERRINGER G, SUICH R. Simultaneous optimization of several response variables[J]. J Qual Technol, 1980, 12(4)∶ 214-219.
[27] TURAN B, GULSEN A, MAKRIS D P, et al. Interactions between quercetin and catechin in a model matrix∶ effects on thein vitroantioxidant behavior[J]. Food Res Int, 2007, 40(7)∶ 819-826.
[28] CHAIYASI T W, McCLEMENTS D J, DECKER E A. The relationship between the physicochemical properties of antioxidants and their ability to inhibit lipid oxidation in bulk oil and oil-in-water emulsions[J]. J Agric Food Chem, 2005, 53(12)∶ 4982-4988.
[29] 王蘭芬. 抗氧化劑清除自由基的機理與結構-活性關系的理論研究[D]. 濟南∶ 山東師范大學, 2004.
[30] SHORT T G, PLUNNNER J L, CHUI P T. Hypnotic and anaesthetic interactions between midazolam, propofol and alfentanil[J].Br J Anaesth,1992, 69(2)∶ 162-167.
[31] 吳偉, 崔光華, 陸彬. 實驗設計中多指標的優化∶ 星點設計和總評“歸一值”的應用[J]. 中國藥學雜志, 2000, 35(8)∶ 530-533.
Synergistic Effect and Formulation Optimization of Three Antioxidant Food Factors
SUN Yue1,YU Yan-ying1,* ,CAO Shu-wen1,2
(1. School of Science, Nanchang University, Nanchang 330031, China;2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In this work, equivalent surface analysis was used to evaluate the synergistic effect of a new antioxidant formula containing ferulic acid, phloretin and soluble vitamin E on DPPH radical scavenging activity, Fe3+reducing power and ABTS radical scavenging activity. The results indicated different mixing ratios of the antioxidant factors exhibited a synergistic,antagonistic, or additive effect to some extent. In this study, response surface methodology (RSM) was adopted for optimizing the formulation of the antioxidant factors to achieve the highest OD (overall desirability) value. The optimal formulation consisted of 34.9% ferulic acid, 35.1% phloretin and 30% soluble vitamin E.
ferulic acid;phloretin;soluble vitamin E;antioxidant;equivalent surface analysis;RSM
TS202.3
A
1002-6630(2012)03-0033-06
2011-03-08
食品科學與技術國家重點實驗室自由探索項目(SKLF-TS-200914)
孫玥(1987—),女,碩士,主要從事天然產物開發與研究。E-mail:sunyue@ncu.edu.cn
*通信作者:余燕影(1963—),女,教授,碩士,主要從事天然產物開發與研究。E-mail:yuyanying@ncu.edu.cn

