缺氧/復氧后星形膠質細胞AQP5表達的變化及亞低溫的干預效應
劉 君 董瑞國 李曉賓 張冠群 崔 曉
水通道蛋白(aquaporin,AQP)是一種對水具有選擇性通透功能的膜通道蛋白家族,目前越來越多的證據顯示腦水腫的發生與AQP有著密切的關系。亞低溫(31~35℃)具有顯著的腦保護作用,但其具體的作用機制尚未完全清楚。既往有關腦水腫的研究主要為AQP4,AQP5的表達與腦水腫的關系報道較少。星形膠質細胞的缺氧、復氧過程與腦缺血再灌注損傷的病理過程相似,因此研究缺氧/復氧條件下星形膠質細胞AQP5表達的特點及亞低溫干預效應,對于探討缺血再灌注腦水腫的形成及亞低溫的作用機制可以有著更深一步的認識。
1 材料與方法
1.1 試劑
DMEM培養基(美國Hyclone),一抗山羊來源AQP5多克隆抗體(美國Santa Cruz公司),二抗兔抗山羊二步法免疫組化試劑(北京中山公司),多聚賴氨酸(美國Sigma)
1.2 動物來源
新生24 h內SD大鼠由徐州醫學院實驗動物中心提供。
1.3 方法
1.3.1 星形膠質細胞的體外培養和鑒定
參照文獻[1]創立的方法并加以改進。新生24 h內的SD大鼠斷頭取腦,分離出大腦皮質,經機械分離及化學消化,制成單細胞懸液,調整細胞密度種植于含血清DMEM培養基中;接種后每隔3 d換液,7~10 d后進行傳代培養;在細胞傳至第4代時制備細胞爬片,對細胞進行GFAP鑒定及進一步實驗。
1.3.2 缺氧/復氧模型的建立
將第4代的細胞置入無菌培養皿中,3~5 d左右細胞生長至約80%以上融合后,棄去培養基,用無血清DMEM清洗2遍,置入通以缺氧混合氣體(95%N2+5%CO2)約0.5 h左右徹底驅除其中所溶解的氧,放入37℃及32℃持續通以缺氧混合氣的培養箱內進行缺氧,并開始記時,缺氧8 h后即刻將接入95%N2的接口斷開,重新接入95%的空氣復氧。對照組除用95%N2+5%CO2代替缺氧混合氣體外,余方法完全同上。
1.3.3 分組
實驗分為3組,即對照組:吸取舊的培養基換完全培養基放入通以37℃、5%CO2、95%空氣的培養箱中培養,20h后取樣測定相關指標;常溫組:吸取舊的培養基換完全培養基放入37℃通以缺氧混合氣體(95%N2+5%CO2)的培養箱內進行缺氧,于缺氧8 h后即刻將接入95%N2的接口斷開,重新接入95%的空氣復氧,按缺氧/復氧(H/R)的時間不同分為缺氧4h(H4/R0組)、缺氧8 h(H8/R0組)、缺氧8h/復氧后4、6、8、10、12 h(H8/R4、H8/R6、H8/R8、H8/R10和 H8/R12組),在相應時間點取樣測定相關指標;亞低溫組:吸取舊的培養基換完全培養基放入32℃通以缺氧混合氣體的培養箱內進行缺氧,余操作、分組同前。
1.3.4 細胞存活能力的鑒定
從培養皿中取出一蓋玻片,用巴氏吸管吸取0.4%臺盼藍溶液,直接滴于蓋玻片,3 min后于鏡下計算同一視野下著藍色及不著色數量(著藍色為死亡細胞,不著色為活細胞),按10倍鏡下每個視野著色細胞數,共計5個視野,計算平均值。
1.3.5 用免疫細胞化學檢測AQP5蛋白的表達水平
將各組的蓋玻片在相應時間點按PowerVisionTM二步法進行免疫組化染色,用3%過氧化氫溶液孵育5 min,以阻斷內源性過氧化物酶,一抗(濃度為1∶100)為山羊AQP5多克隆抗體 (美國Santa Cruz公司)室溫下孵育60 min,按二步法免疫組化試劑盒(北京中山公司)說明書進行操作;DAB顯色時間統一為3 min,顯色后光鏡觀察。陰性對照用PBS代替一抗進行孵育。免疫組化的形態半定量方法:顯微鏡下(40×)細胞計數,選取中央視野及上下左右一個相鄰視野,計陽性細胞數(總數不少于400個細胞);以平均每100個陽性中的強陽性細胞數作為每張蓋玻片的數值。
1.3.6 統計學處理
應用SPSS13.0統計軟件。所有數據均以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD法,P<0.05有顯著性差異。
2 結 果
2.1 星形膠質細胞培養的形態學觀察與鑒定
分離的大鼠大腦皮層膠質細胞在種植后分散均勻,3~5 h后貼壁,光暈明顯,4~5 d時細胞體積明顯增大,長出胞突的細胞明顯增多,8 d時已長滿培養瓶瓶底,星形膠質細胞在底層互相連接成網狀,傳代培養的星形膠質細胞初級胞突較多較長,呈放射狀多分枝;經原代培養傳3代后GFAP免疫細胞化學染色鑒定星形膠質細胞胞,黃褐色為陽性反應;GFAP主要位于星形膠質細胞的胞漿和突起內,GFAP染色陽性的細胞形態不規則,突起粗大。本實驗中95%以上為反應陽性的星形膠質細胞,符合實驗要求。
2.2 不同缺氧/復氧時間點細胞形態學觀察
缺氧4及8 h細胞形態學變化尚不明顯,個別細胞變圓腫脹感,部分細胞邊緣皺縮,復氧后隨著時間的延長細胞變化逐漸明顯,表現為細胞腫脹、變圓,突起增粗縮短,細胞間連接斷裂,有的細胞呈纖維樣改變,輪廓不清,甚至細胞脫落成懸浮狀,大多數細胞出現分離現象。亞低溫組在缺氧及復氧時各時間的病變程度要輕于常溫組。
2.3 星形膠質細胞的生存力
缺氧/復氧模型組星形膠質細胞隨缺氧/復氧時間的延長死亡細胞數逐漸增多,各時間點均明顯高于對照組(P<0.05或0.01);亞低溫組在各時間點的死亡細胞數均明顯低于對照組(P<0.05或0.01)(表1)。
表1 不同缺氧/復氧時間點死亡細胞數(±s,個/每個100倍視野)

表1 不同缺氧/復氧時間點死亡細胞數(±s,個/每個100倍視野)
注:與常溫組比較,*P<0.05,**P<0.01
組別 n死亡細胞數H4R0 H8R0 H8R4 H8R6 H8R8 H8R10 H8R12 33常溫組 5 4.03±1.10 6.37±0.99 8.09±1.16 10.90±1.13 16.92±1.43 22.21±1.40 32.37±4.48亞低溫組 5 2.94±0.33* 3.10±.71** 5.03±.65** 7.87±.32** 13.56±1.12** 18.64±4.43* 26.49±2.69對照組 5 - - - - - - 2.94±0.**
2.4 AQP5免疫細胞化學染色
各組AQP5蛋白在星形膠質細胞的胞漿及胞膜都有黃染的陽性細胞表達,缺氧/復氧模型組隨缺氧時間的延長表達呈下降趨勢,持續至復氧4 h后至最低,從復氧6 h開始增強,在復氧≤8 h兩組缺氧/復氧模型組的表達水平均明顯低于對照組(P<0.05或0.01),而至復氧后10、12 h兩組AQP5蛋白表達水平均明顯高于對照組(P<0.05或0.01),亞低溫組在各時間點的表達水平均要明顯低于常溫組(P<0.05或0.01)(圖1~6,表2)。

圖1 常溫組缺氧8 h(×100倍)
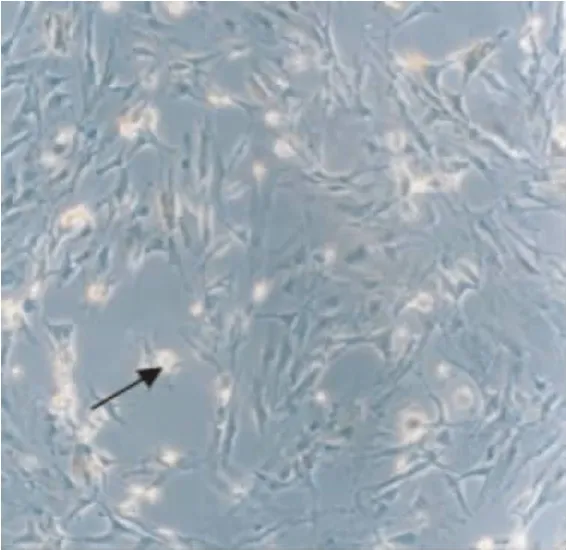
圖2 常溫組復氧8 h(×100倍)

圖3 常溫組復氧12 h(×100倍)

圖4 亞低溫組缺氧8 h(×100倍)

圖5 亞低溫組復氧8 h(×100倍)

圖6 亞低溫組復氧12 h(×100倍)
3 討 論
水通道蛋白(aquaporin,AQP)是一種對水具有選擇性通透功能的膜通道蛋白家族,與晶狀體的主體內在蛋白(MIP)具有同源性。目前已發現有13種水通道蛋白,即AQP0~AQP12,它們的分布具有相對的組織特異性。大腦中主要含有AQP1、AQP4和AQP5,AQP1分布于腦脈絡叢上皮細胞,而AQP4、AQP5和AQP9在星形膠質細胞和室管膜細胞上表達豐富[2]。目前已有大量研究認為AQP4與腦水腫的形成發展密切相關。目前有關AQP5與腦水腫形成的關系報道較少,Yamamoto等發現在缺氧情況下培養的星形膠質細胞上AQP5的表達降低,而在復氧后AQP5的表達升高達3倍,復氧20h后其表達又趨于下降[3],提示AQP5參與了缺血性腦水腫的形成。
表2 不同缺氧/復氧時間點Aqp5染色陽性細胞數(±s,個/每個100倍視野)

表2 不同缺氧/復氧時間點Aqp5染色陽性細胞數(±s,個/每個100倍視野)
注:與常溫組比較,*P<0.05,**P<0.01
組別 n Aqp5染色陽性細胞數H4R0 H8R0 H8R4 H8R6 H8R8 H8R10 H8R12 89常溫組 5 18.10±1.29 13.7±1.25 9.8±1.32 14.5±1.08 20.2±1.14 24.7±1.34 33.7±3.16亞低溫組 5 15.50±1.96* 11.40±1.08*8.4±0.84* 12.4±0.70** 17.60±1.84* 20.7±2.16** 28.9±4.43對照組 5 - - - - - - 20.6±3.*
星形膠質細胞是中樞神經系統數量最多的細胞,是構成血腦屏障的主要成分,它對腦水腫有重要影響。超微結構顯示在腦水腫早期主要表現為星形膠質細胞腫脹,它可能是腦水腫發生發展過程中的一個重要因素。星形膠質細胞的缺氧、復氧過程與腦缺血再灌注損傷的病理過程相似,因此研究星形膠質細胞的在缺氧/復氧過程中的病理、生理變化對于研究缺血性腦水腫形成、變化有著重要的意義。
本研究發現,在星形膠質細胞缺氧及復氧早期AQP5的表達降低,復氧后隨著時間延長出現AQP5表達明顯升高。在缺血性腦水腫早期主要是以細胞毒性水腫為主要機制,如果缺氧時間短暫,細胞毒性水腫往往是可逆的。AQP5蛋白在缺氧早期的表達減少,有利于保護星形膠質細胞,從而在缺血早期發揮神經保護作用。缺血缺氧可能通過激活PKA而減少AQP5的表達[4]。缺血缺氧損傷導致線粒體能量代謝障礙,亦可能直接引起水通道能量衰竭導致AQP5的減少。因而,此種情況下AQP5的表達減少,可以減輕星形膠質細胞的水腫而起到保護作用。本實驗在復氧后10、12hAQP5蛋白表達明顯增高,可能是星形膠質細胞離子泵功能衰竭,大量的Na+、Ca2+以及谷氨酸進入細胞內使細胞內外滲透壓改變,激活了細胞膜外的滲透壓感受器使AQP5表達增多,水通道開放,大量水分子流入細胞內形成水腫。
亞低溫(31~35℃)具有緩解細胞內酸中毒、減輕腦水腫、抑制白三烯B4生成、減輕腦損傷后細胞毒性作用及防止血腦屏障通透性改變等作用[5]。但其確切調節機制尚不完全清楚。李曉賓等用亞低溫對大鼠出血性腦水腫的模型進行干預發現,亞低溫可能通過下調腦內AQP4的表達而抑制出血性腦水腫[6]。
本實驗結果發現,缺氧≤8h細胞形態變化不明顯,隨著復氧時間的延長,可見活化逐漸明顯,死亡細胞數逐漸增高,32℃亞低溫干預后各時間點細胞病變的程度要輕于常溫組而死亡細胞數明顯低于常溫組,說明缺氧、復氧造成了星形膠質細胞的損傷,而亞低溫能減輕缺氧造成的星形膠質細胞損傷。本實驗亞低溫組與常溫組相比,在各時間點AQP5表達亦明顯降低,提示亞低溫可能通過降低星形膠質細胞膜上AQP5的表達,減少由經膠質細胞膜進入細胞內的水含量,抑制細胞毒性腦水腫。如將亞低溫及AQP5抑制劑聯合應用是否可以有效地控制腦水腫,將可能成為治療缺血性腦水腫新的突破。
1 Mc Carthy K and Vellis JD.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue.Cell Biol,1980,85:890-902.
2 Badaut J,Lasbennes F,Magistretti PJ,et al.Aquaporins in brain:distribution,physiology,and pathophysiology.Cereb Blood Flow Metab,2002,22(4):367-378.
3 Yamamoto N,Yoneda K,Asai K,et al.Alterations in the expression of the AQPfamily in cultured rat astrocytes during hypoxia and reoxygenation.Brain Res Mol,2001,90(1):26-38.
4 Yamamoto N,Sobue K,Fujita M,et al.Differential regulation of aquaporin-5 and -9 expression in astrocytes by protein kinase A..Brain Res Mol Brain Res,2002,104(1):96-102.
5 Den HH,Van DWB,Van GM,et a1.Therapeutic hypothermia in acute ischemic stroke.Expert Rev Neurother,2007,7(2):155-164.
6 李曉賓,董瑞國,程廣軍,等.亞低溫對實驗性腦出血后水通道蛋白4表達及腦水腫的影響.臨床神經病學雜志,2006,19(2):115-117.

