乳腺癌增強MRI特征與病理、免疫組化指標的相關性研究
張 青,王振常,鮮軍舫,燕 飛,李書玲
乳腺癌嚴重威脅女性身心健康,在美國婦女死因中占第2位,每年至少新發病例10000例[1-2]。在我國乳腺癌也是婦女最常見的腫瘤之一,其檢出與防治日益受到重視。隨著MRI高分辨率表面線圈技術的改進及新的成像技術發展,動態增強MRI已經成為乳腺癌檢出、診斷和分期的最有前途的檢查方式。對于乳腺癌高危患者,其診斷的敏感性為79.5%~95%,特異性為89.8%[3-4]。本研究探討乳腺癌的增強MRI特征與病理學及免疫組織化學指標的相關性。
1 材料與方法
1.1 臨床資料
回顧性分析我院2006年10月至2011年5月因臨床觸診或超聲檢查懷疑乳腺癌、行乳腺平掃及動態增強MRI檢查,并經手術或活檢后病理證實為乳腺癌的33例患者的MRI及病理資料。患者均為女性,年齡為25~71歲,平均為(50.9±10.6)歲。16例位于右側乳腺,17例位于左側乳腺。病理診斷24例為浸潤性導管癌(72.7%),9例為非浸潤性導管癌,包括導管內癌3例(9.1%)、浸潤性篩狀癌2例(6.1%)及髓樣癌、浸潤性小葉癌、原位癌、硬化性乳腺病并少數高度非典型增生各1例(3.0%)。11例病理證實有淋巴結轉移。所有標本均進行了免疫組織化學染色,測定癌細胞的雌激素受體(ER)、孕激素受體(PR)、P53抑癌基因、CD34的表達情況。24例(72.7%) ER(+),9例ER(-);21例(63.6%) PR(+),12例ER(-);18例(54.5%) p53(+)、15例p53(-);8例(24.2%)CD34(+),25例CD34(-)。
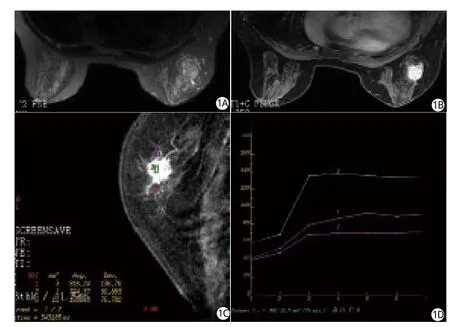
圖1 女,69歲,右側乳腺外上象限浸潤性導管癌3級,腫塊長徑約2.0cm。A:橫斷面T2WI示病灶呈稍長T2WI信號;B,C:橫斷面及矢狀面增強掃描示病灶呈明顯不均勻強化,可見分葉及毛刺;D:時間-信號強度曲線為平臺型。免疫組織化學染色顯示ER(+)、PR(-)、p53(-)、CD34(-)Fig.1 Female, 69 years old.There was a mass in the upper outer quadrant of her right breast.The diameter of the tumor was approximately 2.0cm.The pathological diagnosis was invasive ductal carcinoma.A: cross-sectional T2WI, the lesion was showed slightly high signals in T2WI; B,C: cross-sectional and sagittal contrast enhanced images showed that the lesions were signi fi cantly heterogeneous enhancement, leaf and burr signs were visible.D: time-signal intensity curve was platform type.Immunohistochemical staining showed ER (+), PR (-) , p53 (-) and CD34 (-).
MRI掃描使用1.5 T 超導MR掃描儀及專用乳腺表面線圈,患者俯臥位雙側乳腺自然懸垂于線圈槽內,胸壁緊貼線圈。囑患者呼氣末屏氣,行快速自旋回波(FSE)序列橫斷面T1WI及短反轉時間反轉恢復(STIR)序列T2WI掃描,從乳腺上緣掃描至下緣。然后對患側乳房行自外側至內側的矢狀面壓脂T2WI掃描。隨后用高壓注射器,以3 ml/s的流率靜脈團注釓噴替酸葡甲胺(Gd-DTPA) 0.1 mmol/kg,并用生理鹽水沖刷導管內殘余對比劑。在平掃基礎上選定病灶,行矢狀面動態增強掃描,注入Gd-DTPA對比劑后采集數據。在中心層面前后做3~5個層面、共12個動態掃描。最后行橫斷面、患側矢狀面的壓脂T1延遲增強掃描,并以最大密度法重建得到病灶的2D矢狀面圖像。在顯示最好的1個層面的各時間點系列動態影像中,在MR工作站上選擇ROI,獲得時間-信號動態增強曲線(TIC)。分析每例患者的MRI形態學表現、信號特征及動態增強曲線類型,在矢狀面上測量腫瘤大小。掃描參數如下:TR 550ms、TE 11 ms或TR 2714 ms、TE 120ms,FOV 300mm,RFOV 50%,層厚3~5 mm,層距1 mm,矩陣256×256,NEX為1。動態掃描TE 3.1 ms,TR 6.6 ms,NEX為2,反轉角(FA)20°,FOV 35 cm×26 cm, 矩陣256×192,延遲時間(TD) 690ms。
1.2 圖像分析
分別由1名放射科主治醫師、1名副主任醫師通過工作站獨立分析, 意見不一致時協商解決。首先評價圖像質量,圖像質量分為3級:1級,好;2級,尚可,可用于診斷;3級,差,無法診斷。
在矢狀面增強MRI上評價病灶大小,按病灶長徑分為≥2.0cm及<2.0cm 兩組;評價T1WI、T2WI信號特征、增強后強化情況,是否存在分葉及毛刺;將TIC分為:Ⅰ單相型,在動態觀察時間內信號強度持續增加;Ⅱ平臺型,早期(3 min內)信號強度逐漸增加,之后信號強度的增加突然中斷而形成中晚期的平臺;Ⅲ流出型,早期信號強度逐漸增加,之后信號強度逐漸減小;以淋巴結長徑≥1.0cm及<1.0cm為標準,評價MRI掃描范圍內淋巴結情況。
1.3 統計學方法
采用SPSS 11.5統計學軟件進行分析。對資料用Fisher精確檢驗法行卡方檢驗(Chi-Square tests)。計量資料表達為(),P<0.05為差異有統計學意義。
2 結果
33例患者的圖像質量全部為1級。
18例腫塊長徑≥2.0cm(圖1), 最大者為2.9 cm×4.0cm;15例腫塊長徑<2.0cm。MRI表現分為2種類型:結節型,26例,腫塊呈等長T1、稍長或等T2信號影,增強掃描明顯強化;囊狀型,7例,腫塊呈囊狀,呈等T1混雜T2信號,內部呈短T2信號,外周呈長T2信號,增強掃描明顯環形強化。31例腫塊有分葉征,32例有毛刺征。4例TIC為Ⅰ型,24例為Ⅱ型,5例為Ⅲ型。17例MRI掃描范圍內淋巴結長徑≥1.0cm,16例<1.0cm。
統計結果顯示,在MRI上病灶長徑與病理證實的淋巴結轉移具有相關性(P<0.01)、與p53具有相關性(P<0.01),病理證實的淋巴結轉移與p53也具有相關性(P<0.01);將TIC分為平臺型及非平臺型,曲線類型與MRI所見淋巴結大小具有相關性(P<0.01);乳腺癌病理類型與CD34亦具有相關性(P<0.05)。而患者年齡、MRI表現類型、毛刺征、分葉征與上述免疫組化指標的表達無相關性(P>0.05)。
3 討論
與鉬靶X線攝影及超聲檢查相比,MRI 是診斷乳腺癌最敏感的方法,可發現很小的隱匿性乳腺癌[5]。本研究病灶長徑最小為0.8 cm×0.7 cm,有許多病灶長徑<1.0cm,MRI顯示的病灶大小、位置與病理發現高度一致。
本組1例44歲女性患者MRI顯示長徑1.0cm結節,無毛刺,略呈分葉狀,伴乳腺增生,TIC曲線為Ⅰ型,懷疑乳腺癌,病理診斷為硬化性乳腺病合并少數高度非典型增生。文獻報道的其他假陽性發現包括纖維囊性改變、導管內乳頭狀瘤并導管不典型增生或放射狀瘢痕、腺瘤、纖維腺瘤等。考慮原因為病灶較小時根據MRI特征不易進行良惡性鑒別,病理取材時亦受限。
為評價乳腺癌動態增強MRI的特征與免疫組織化學指標的相關性,筆者選取患側T1WI SE序列增強矢狀面測量病灶及鄰近腋窩、乳腺或胸壁淋巴結的大小,以避免在GRE序列上過大估計其大小。根據國際抗癌聯盟和美國腫瘤聯合會聯合制定的2003版的乳腺癌TNM分期法,將MRI上病灶按長徑分為<2.0cm及≥2.0cm兩組,結果顯示MRI病灶長徑與病理證實的淋巴結轉移、P53相關,后兩者也相關,與以往文獻報道的乳腺癌預后因素如腫瘤分級、淋巴結狀態、激素受體狀態等一致,提示術前的乳腺動態增強MRI檢查可為臨床補充提供一些有用的預后信息。
p53是一種抑癌基因,免疫組織化學染色檢測到的為突變型(Mtp53)。p53突變后喪失了啟動細胞凋亡的能力,導致腫瘤細胞不斷增值。p53突變率高的乳腺癌細胞增殖活力強、分化差、惡性度高、侵襲性強和淋巴結轉移率高[6-7]。
有文獻報道乳腺癌的組織學分級與其強化方式相關[8]。TIC曲線切實反映了病灶的血流動力學特點,若將病灶的信號特點、形態學改變、TIC曲線類型等信息綜合起來,對腫瘤的定性診斷具有較高意義。TIC為流出型時強烈提示為惡性病變,是判斷預后的獨立因素。有大樣本研究表明平臺型也提示惡性病變,約44%的良性病變表現為平臺型[9]。MRI上淋巴結的良惡性鑒別包括其形狀、大小及強化形式等方面,短軸徑線超過1.0cm的結節,圓形(長短軸徑線比<1.5)提示轉移淋巴結。在本研究中筆者將TIC曲線分為平臺型及其他型,將MRI所見淋巴結分為長徑≥1.0cm及<1.0cm兩組,結果顯示MRI曲線類型與MRI所見淋巴結大小相關。臨床實踐中對于MRI上短徑<1.0cm的淋巴結良惡性的判斷較困難,筆者初步嘗試從淋巴結的長徑大小與TIC曲線的關系入手探究其臨床意義,若淋巴結長徑≥1.0cm,且TIC曲線為平臺型,是否更傾向于惡性淋巴結?需在今后進一步研究。
本研究的MRI發現與一些免疫組織化學指標無明顯相關性,如PR、ER等。也許是由于小樣本量限制了統計學意義,其初步結果有待于今后在大樣本中繼續研究。
[References]
[1]Sommer CA, Stitzenberg KB, Tolleson-Rinehart S, et al.Breast mri utilization in older patients with newly diagnosed breast cancer.J Surg Res, 2011, 170(1): 77–83.
[2]Lehman CD, Isaacs C, Schnall MD, et al.Cancer yield of mammography, MR, and US in high-risk women:prospective multi-institution breast cancer screening study.Radiology, 2007, 244(2): 381-388.
[3]Kriege M, Brekelmans CT, Boetes C, et al.Efficacy of MRI and mammography for breast-cancer screening inwomen with a familial or genetic predisposition.N Engl J Med, 2004, 351(5): 427-519.
[4]Bluemke DA, Gatsonis CA, Chen MH, et al.Magnetic resonance imaging of the breast prior to biopsy.JAMA,2004, 292(22): 2735-2742.
[5]Lu H, Xu YL, Zhang SP, et al.Breast magnetic resonance imaging in patients with occult breast carcinoma: evaluation on feasibility and correlation with histopathological findings.Chin Med J, 2011, 124(12):1790-1795.
[6]Gutierrez RL, DeMartini WB, Silbergeld JJ, et al.High cancer yield and positive predictive value: outcomes at a center routinely using preoperative breast MRI for staging.AJR Am J Roentgenol, 2011, 196(1): W93-W99.
[7]Biglia N, Mariani L, Sgro L, et al.Increased incidence of lobular breast cancer in women treated with hormone replacement therapy: implications for diagnosis, surgical and medical treatment.Endocr Relat Cancer, 2007, 14(3):549-567.
[8]Tuncbilek N, Karakas HM, Okten OO.Dynamic magnetic resonance imaging in determining histopathological prognostic factors of invasive breast cancers.Eur J Radiol,2005, 53(2): 199-205.
[9]Christian Sohns, Martin Scherrer, Wieland Staab,et al.Value of the BI-RADS classification in MRMammography for diagnosis of benign and malignant breast tumors.Eur Radiol, 2011, 21(12): 2475-2483.

