超臨界逆向蒸發法制備葡萄糖脂質體實驗及性能表征
陳淑花,詹世平,張 晶,陳 理
(大連大學 環境與化學工程學院, 遼寧 大連 116622)
脂質體是指將藥物包封于類脂質雙分子層內而形成的球狀載體制劑,其結構多為一層或多層同心脂質雙分子層,外層由磷脂雙分子層包覆,內部為水相內核,具有類細胞膜結構與功能。其水相內核可以攜帶親水性藥物,雙分子層結構可攜帶親脂類藥物,因而是一種非常有發展潛力的藥物傳遞系統媒介[1-3]。脂質體制備方法主要有逆向蒸發法、冷凍干燥法、pH梯度法、Bangham法等[4-6]。這些制備方法對脂溶性藥物包覆率效果較好,而對水溶性藥物包覆效果還不理想。在臨床藥品中,水溶性藥物占有很大的比例,因此提高脂質體對于水溶性藥物的包覆效果成為目前亟待解決的問題。
超臨界流體逆向蒸發是近年來提出的一種用超臨界流體代替有機溶劑的脂質體制備方法,具有制備過程簡單、對水溶性藥物包覆率較高等特點[7-10]。本文利用葡萄糖作為模型藥物,對其進行脂質體制備研究,詳細考察該工藝條件對脂質體包覆率的影響。
1 實驗部分
1.1 實驗原料
L-α-Phosphatidylcholine(sigma):磷脂酰膽堿;乙醇:助溶劑,沈陽新興試劑廠;D-葡萄糖:天津科密歐化學試劑開發中心提供;CO2氣體,大連市氣體中心,純度99.9%。
1.2 實驗裝置與脂質體制備
實驗裝置如圖1所示,設計壓力40 MPa、設計溫度室溫~80 oC,高壓反應釜有效容積為200 cm3,壓力表與溫度表的精度分別為±0.01 MPa、±0.1 oC。

圖1 超臨界逆向蒸發過程裝置示意圖
大豆卵磷脂與乙醇、葡萄糖制成溶液,經超聲振蕩后加入到反應釜中,加壓至實驗所設定的壓力,保壓一定時間,緩慢釋壓后得到脂質體樣品。
1.3 葡萄糖脂質體包覆率測定

取實驗制備的脂質體溶液1 mL放入透析袋中,封閉好透析袋后放置于干燥的燒杯中,精確加入50 mL二次去離子水,在Ph = 7的環境下透析24 h,之后取透析液25 μL放入生物傳感分析儀(山東省科學院生物研究所)中檢測葡萄含量。由下式確定脂質體對葡萄糖的包覆率[11]:
2 結果及討論
2.1 壓力對葡萄糖包覆率的影響
實驗設定溫度55 ℃,壓力分別為10、12、15、18、20、23和25 MPa下制備脂質體,圖2給出了脂質體包覆率隨壓力的變化曲線。
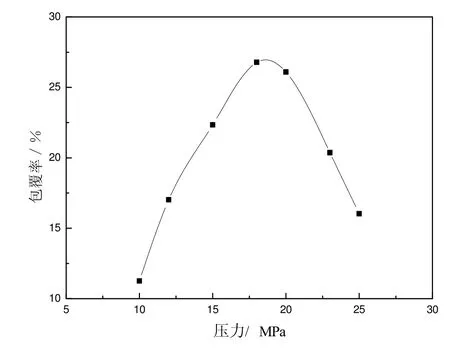
圖2 葡萄糖包覆率隨壓力變化關系曲線
當壓力從10 MPa增加到18 MPa時,脂質體內部壓力隨之增加,體積大的脂質體破裂形成體積小的,體積小的脂質體也會進一步收縮以增加內部壓力維持體系平衡,這種變化等同于增加了體系內脂質體的水相內核比率,從而逐漸提高了葡萄糖包覆率;當壓力升高到18~20 MPa時,葡萄糖的包覆率為25.7%~27.5%;繼續增大壓力,體系內膠束濃度增大,膠束之間碰撞、融合幾率增加,水相內核比率減小,包覆率降低。
2.2 溫度對葡萄糖包覆率的影響
實驗壓力20 MPa下,溫度分別為30、35、45、55和65 ℃下制備脂質體,圖3給出了脂質體包覆率隨溫度的變化曲線。隨溫度的增加,脂質體對物葡萄糖的包覆率顯著增加,最高可到41.3 %。當溫度升高時體系內分子熱運動加劇,脂質體雙分子層流動性增強,體積大的易破裂形成體積小的脂質體以維持體系的相對穩定性,這樣體系內脂質體體積平均粒徑不斷減小,同時膠束濃度增加,這種變化相當于增加了脂質體水相內核的比率,因而有更多的藥物進入到脂質體內部,從而表現為包覆率隨溫度的增加而逐漸增加。當然,考慮到溫度過高,對脂質體的穩定性、有效性不利,一般實驗都選擇在 55~60 ℃進行研究。

圖3 葡萄糖包覆率隨溫度變化曲線
2.3 平衡時間對葡萄糖包覆率的影響
實驗壓力20 MPa、溫度55 ℃時,平衡時間分別為15、20、30、40、45、50和55 min下制備脂質體,圖4給出了脂質體包覆率隨平衡時間的變化曲線。
當反應平衡時間由15 min增加到45 min時,制得的葡萄糖脂質體包覆率逐漸增加,最高可到26.6%;但繼續增加平衡時間,脂質體包覆率反而逐漸下降。原因在于實驗制備的脂質體膠束溶液在熱力學上是不穩定體系,存在較大自由能,脂質體雙分子層分子間作用力較弱,隨時間的延長,表面張力明顯減弱,雙分子層流動性增強,因此易于發生滲漏,導致包覆率大幅度下降。

圖4 葡萄糖包覆率隨平衡時間變化曲線
2.4 乙醇與類脂質量比對包覆率的影響
在壓力為20 MPa,乙醇與類脂用量比分別為0.5:1、1.5:1、2:1、2.5:1 和 3:1 條件下制備脂質體,圖5反映了脂質體包覆率隨類脂與乙醇用量比變化關系。

圖5 包覆率隨乙醇與類脂質量比變化曲線
由圖5可見,反應釜內壓力保持20 MPa,乙醇與類脂質量比為0.5:1~2:1時,隨著乙醇用量的增加,脂質體對葡萄糖包覆率會逐漸增加;當乙醇與類脂質量比為2:1~3:1時,包覆率逐漸減小。
大豆卵磷脂分散在水溶液中形成膠束,醇分子能穿入膠束形成混合膠束,減小膠束之間的排斥力,同時由于醇分子的加入使體系的熵值增大,所以有利于膠束的形成和增大,這樣在宏觀上表現為包覆率的增加。當加入的醇超過臨界值時,體系內的膠束濃度也增加到一個臨界值,繼續增加醇的用量使膠束濃度增加,膠束間相互碰撞交聯融合的幾率增加,原有包覆在水相內核中的親水性藥物將會滲漏出來,從而使包覆率逐漸降低。
2.5 不同工藝制備的葡萄糖脂質體體積平均粒徑
薄膜分散法制備的脂質體粒徑分布如圖6所示,體積平均粒徑為308 nm。葡萄糖的包覆率僅有9.5%。

圖6 薄膜分散法制備脂質體粒子粒徑分布
超臨界逆向蒸發法(溫度55 ℃、壓力20 MPa、平衡時間35 min、乙醇與類脂質量比2:1)制備的脂質體粒徑分布如圖7所示,體積平均粒徑為320 nm。

圖7 超臨界工藝制備脂質體粒子粒徑分布
評價脂質體質量的指標主要有外觀、粒徑分布和包覆率等。其中包覆率是衡量脂質體內在質量的一個重要指標。比較兩種制備方法,采用超臨界流體技術能夠顯著提高脂質體對葡萄糖的包覆率,脂質體粒徑分布窄、體積平均粒徑小。
3 結論
用超臨界逆相蒸發法制備的葡萄糖脂質體平均粒徑320 nm左右,包覆率最高可達41.3%。
實驗操作參數壓力、溫度、平衡時間和乙醇與類脂用量比對脂質體藥物包覆率影響很大:壓力為10~20 MPa時,葡萄糖脂質體包覆率逐漸增加,達到25.7%~27.5%,隨后包覆率逐漸減小;溫度為 35~65 ℃時,包覆率顯著增大,最高可達41.3%;平衡時間為15~45 min時,包覆率顯著增加,但超過45 min后對脂質體包覆率是極其不利的;乙醇與類脂質量比為0.5:1~2:1時,脂質體對葡萄糖包覆率逐漸增加,當質量比在2:1~3:1時,包覆率是逐漸減小的。
[1]NAGAYASU A, UCHIYAMA K. The size of liposomes:a factor which affects their targeting efficiency to tumors and therapeutic activity of liposomal antitumor drugs [J].Advanced Drug Delivery Reviews, 1999, 40(1-2): 75-87.
[2]孫聚魁, 鄧英杰, 曹金娜. 納米脂質體研究進展[J].沈陽藥科大學學報, 2010, 27(12): 993-997,1002.
[3]ZUZANNA D K, AGATA D J. Liposomes as delivery systems for antibiotics [J]. International Journal of Pharmaceutics, 2010, 387(1-2): 187-198.
[4]劉曉謙, 王錦玉, 仝燕, 等. 脂質體制備技術及其研究進展[J]. 中國藥學雜志, 2011, 46(14): 1084-1088.
[5]張自強, 朱家壁, 姚靜, 等. pH 梯度法制備伊立替康脂質體[J]. 中國醫科大學學報, 2008, 39(4): 312-316.
[6]程曉丹, 李學明, 顧立. 脂質體對水溶性藥物包封方法的研究進展[J]. 華西藥學雜志, 2009, 24(2):194-197.
[7]KATSUTO O, TOMOHIRO I. Development of a new preparation method of liposomes using supercritical carbon dioxide [J]. Langmuir, 2001, 17: 3898-3901.
[8]TOMOHIRO I, KATSUTO O. Preparation and physicochemical properties of various soybean lecithin liposomes using supercritical reverse phase evaporation method [J]. Colloids and Surfaces B: Biointerfaces,2003, 27: 133-140.
[9]KATSUTO O, TAKESHI S. Preparation of liposomes using an improved supercritical reverse phase evaporation method [J]. Langmuir, 2006, 22: 2543-2550.
[10]謝芳. 超臨界技術制備低水溶性藥物脂質體實驗研究[D]. 大連理工大學, 2009.
[11]陳召紅, 劉皈陽, 魏亞超. 脂質體包封率測定方法研究進展[J]. 解放軍藥學學報, 2011, 27(1): 79-82.

