力竭運動后不同時相大鼠心肌Egr-1蛋白的變化及其在運動性心肌微損傷發(fā)生中的作用
袁旭鑫,常 蕓
力竭運動后不同時相大鼠心肌Egr-1蛋白的變化及其在運動性心肌微損傷發(fā)生中的作用
袁旭鑫,常 蕓
目的:探討力竭運動后不同時相心肌早期生長應答基因Egr-1在蛋白水平的變化特點,為運動性心肌微損傷及心肌功能異常發(fā)生機制的闡釋提供實驗依據(jù)。方法:100只健康成年雄性SD大鼠,分為一次力竭游泳運動組、兩周反復力竭游泳運動組及安靜對照組,分別于力竭運動后即刻、6 h、12 h及24 h取材,應用免疫熒光組化技術和圖像分析方法研究大鼠心肌Egr-1蛋白含量的變化。結果:一次力竭運動組大鼠心臟各部位Egr-1蛋白含量即刻組與對照組相比顯著性升高(P< 0. 05),24 h組與對照組相比顯著性降低( P<0. 05);反復力竭運動組大鼠心臟各部位Egr-1蛋白含量即刻組與對照組相比顯著性升高(P< 0. 05),6 h組、12 h組、24 h組大鼠心臟各部位Egr-1蛋白含量均顯著低于對照組 (P<0. 05)。結論:不同力竭運動后心臟各部位Egr-1在運動后即刻明顯升高,表明心肌細胞Egr-1對力竭運動刺激產(chǎn)生快速應激反應,可能誘導炎性細胞的趨化、聚集以及氧自由基的產(chǎn)生。而心臟各部位Egr-1在力竭運動后24 h內恢復到正常水平,說明力竭運動后心臟Egr-1改變屬早期應激反應,且此反應屬可復性改變。
力竭運動;大鼠;心肌;早期生長應答基因-1(Egr-1)
研究表明適度運動可以有效地改善心血管功能,有利于保持人體健康和運動能力,但劇烈運動尤其是超負荷反復運動或力竭運動會誘導運動性心臟損傷。力竭性運動時,心臟消耗增加,而機體供給量卻在減少,此時心肌處于相對缺血缺氧狀態(tài)。有研究認為,運動性心肌微損傷類似于臨床上的缺血再灌注損傷,氧自由基增多、鈣超載、心肌能量代謝障礙、血管內皮細胞功能障礙、一氧化氮減少、細胞結構蛋白的降解和細胞凋亡異常等均可能參與運動性心肌微損傷的病理過程。在此過程中,多種因素均可使原本處于休眠狀態(tài)的早期生長應答基因被激活。
早期生長應答基因-1(Egr-1)為即刻早期基因(IEG)家族成員,是原癌基因家族中一類能被第二信使誘導的原癌基因,受刺激后最先表達該類基因,固亦稱快速反應基因。Egr-1具有3個鋅指樣結構的轉錄因子,它通過對其靶基因的誘導將多種細胞外環(huán)境的刺激信號(缺血缺氧、氧化應激、機械損傷等)與機體復雜的生物反應耦聯(lián)起來,因此是聯(lián)系細胞生化改變與細胞最終對刺激發(fā)生特異性反應的中介物,在生理狀態(tài)下可調整機體細胞的生長、分化和細胞內信息的傳遞,參與正常細胞的生長和發(fā)育過程,是心血管系統(tǒng)生長發(fā)育所必需的基因。目前關于不同力竭運動后心肌Egr-1蛋白含量在不同時相的變化尚無研究報道。
因此,本研究通過一次力竭游泳和反復力竭游泳運動建立運動性心肌微損傷的實驗動物模型,研究大鼠心肌Egr-1在力竭運動后不同時相的蛋白表達變化,探討其在運動性心肌微損傷及心肌功能異常發(fā)生中的調節(jié)作用,試圖為大強度運動和過度訓練所致心臟問題的醫(yī)務監(jiān)督提供理論與實驗依據(jù)。
1 材料與方法
1.1 實驗對象
選用純種SD雄性大鼠100只(維通利華公司提供),體重220±8 g,8月齡,國家標準嚙齒動物干燥飼料喂養(yǎng),自由飲食,動物室內溫度18~22℃,光照時間12 h,相對濕度40%~55%。
1.2 實驗動物分組
將100只SD大鼠首先隨機分為一次力竭游泳運動和2周反復力竭游泳運動及其相應對照組,各組間大鼠初始體重無顯著性差異(P>0.05),具體分組和體重情況見表1。
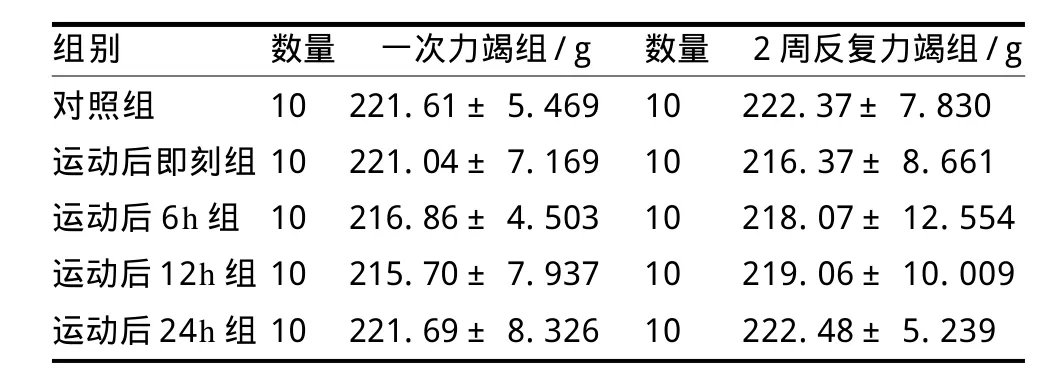
表1 分組時大鼠各組體重TableⅠ Weight of the Rats at the Time of Being Divided into Groups
1.3 動物模型的建立
依據(jù)經(jīng)典的Thomas實驗方案,通過一次力竭游泳和反復力竭游泳運動建立不同程度的運動性心肌微損傷實驗動物模型。
1.3.1 運動環(huán)境條件
PVC特制泳池,規(guī)格為1.6 m×0.8 m×1.2 m,內壁光滑,水深約60 cm,超過大鼠身長2倍,控制水溫在30~33℃。
1.3.2 運動負荷方案
安靜對照組不運動。運動組大鼠進入動物房后首先適應3 d,然后進行2 d適應性游泳運動(20 min/次)。
一次性力竭組進行一次性游泳運動,游泳大鼠在尾部負重(負重量為體重3%),直至力竭,力竭標準參照Thomas DP報道[1],即連續(xù)沉入水中超過10 s,撈出后置于平面不能完成翻正反射;對于時間相對較短就發(fā)生力竭的大鼠,撈出休息5 min后,再讓其繼續(xù)游泳運動,使每次運動時間不少于2 h。
反復力竭運動組每天1次力竭運動,游泳大鼠在尾部負重(負重量為體重3%)。每周運動6 d,共運動2周。每次運動時間不少于2 h。每次運動結束后,迅速用毛巾擦干水分,然后用電吹風徹底吹干后,再放回籠中休息。
1.4 實驗方法
1.4.1 大鼠心肌冰凍切片的制備
一次性和反復力竭運動組分別于運動后0 h、6 h、12 h、24 h取材,首先進行腹腔注射10%水合氯醛(1 ml/100 g體重)麻醉后,迅速開胸取血,然后迅速取出心臟,心臟經(jīng)滅菌生理鹽水清洗后,濾紙吸干并稱重,滴加O CT包埋劑后置于液氮冷凍20 s后轉入冰凍切片機恒溫箱(-25℃),切取7 μ m厚度的冰凍切片置于-70℃超低溫冰箱待用。
1.4.2 免疫熒光染色
主要試劑:兔多克隆Egr-1抗體購于美國Santa Cruze公司;FITC標記山羊抗兔IgG購于北京中杉生物技術有限公司;DAPI染液購于碧云天生物技術研究所。
從低溫冰箱取出心肌冰凍切片后,室溫復溫30 min;入冷丙酮(4 ℃)固定10 min,PBS洗3次,每次5 min;滴加10%封閉用羊血清(PBS稀釋,工作濃度1:50),室溫放置30 min,傾去血清,勿洗;滴加一抗(Egr-1多克隆抗體,工作濃度1∶50),4℃放置14 minPBS洗3次,每次5 min;滴加熒光素標記二抗(工作濃度1∶100),37 ℃避光放置45min,PBS洗3次,每次5 min;滴加DAPI原液7min,PBS洗3次,每次5 min;60%緩沖甘油封片,立即置鏡下觀察。PBS代替一抗作陰性對照。
1.4.3 圖像采集與分析
使用Leica As MDW活細胞多維圖成像工作站進行圖像采集以及圖像分析,具體操作參照儀器操作規(guī)范進行,所有圖片按照相同的曝光時間及條件進行。用于FITC的激發(fā)波長為490 nm,激發(fā)DAPI的波長為390 nm,放大倍數(shù)為200倍,圖像存為1024×1024像素類型,每張切片左心室、室間隔、右心室各隨機選擇心肌細胞的橫切3個視野。應用Leica Qwin圖像分析系統(tǒng)對Egr-1的免疫熒光圖進行分析,以積分灰度值(Intergrated Grey)為評價標準,對Egr-1進行半定量分析。
1.4.4 數(shù)據(jù)收集及處理方法
實驗所有數(shù)據(jù)均數(shù)SPSS15.0統(tǒng)計軟件進行統(tǒng)計分析,組間進行單因素方差分析,不同因子間進行相關性分析,結果均以平均數(shù)±標準差表示,其中P<0.05為顯著性差異, P<0.01為非常顯著性差異。
1.5 實驗主要使用儀器
實驗中使用的冰凍切片機、多維成像工作站和形態(tài)學圖像分析系統(tǒng)皆為LEICA公司生產(chǎn),試驗所用全部儀器為國家體育總局體育科學研究所實驗中心提供,操作者按照實驗操作說明規(guī)范操作。
2 結果
2.1 大鼠心臟形態(tài)肉眼觀察
對照組大鼠心臟顏色鮮紅,彈性好;一次力竭游泳運動各組大鼠心臟有充血現(xiàn)象,顏色略深,表面冠狀血管充盈;反復力竭游泳運動各組大鼠心臟充血程度較一次力竭大鼠更為顯著,顏色暗紫,表面血管怒張明顯,且有心房充血擴張。
2.2 大鼠心系數(shù)變化
各組大鼠心系數(shù)見表2。一次力竭游泳運動各組大鼠心系數(shù)與對照組之間無統(tǒng)計學差異(P>0.05),各時相組之間亦無統(tǒng)計學差異(P>0.05)。2周反復力竭游泳運動后即刻、6 h、12 h、24 h各組心系數(shù)均顯著高于對照組心臟重量指數(shù)(P<0.01),各時相組之間無統(tǒng)計學差異(P>0.05)。
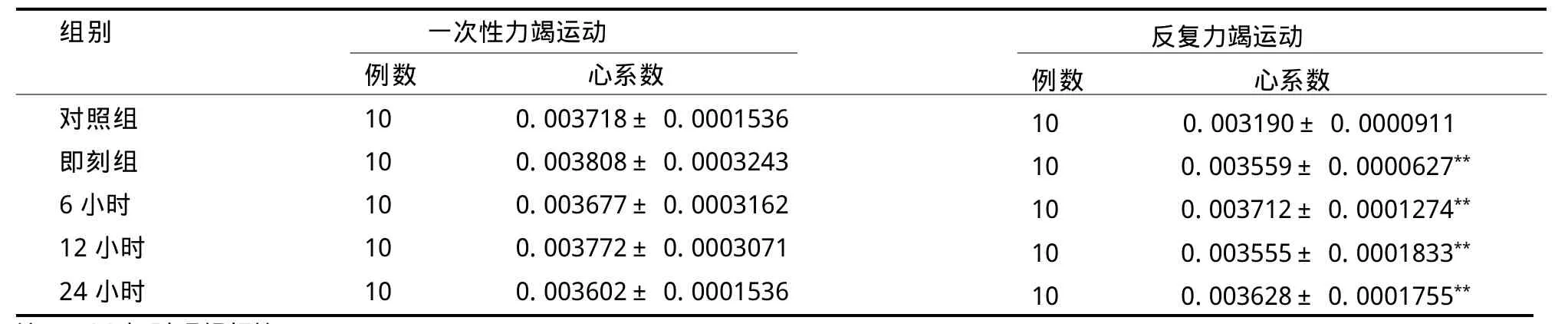
表2不同游泳運動后各組大鼠心系數(shù)的變化TableⅡ Variation of the Heart Coefficient of the Different Group Rats after the Different Exhaustive Exercises
2.3 Egr-1免疫熒光染色結果
如圖1所示,大鼠心肌橫切圖,綠色點狀或條索狀熒光斑為FITC標記的Egr-1蛋白陽性表達(圖1①)。藍色熒光斑為細胞核(DAP I標記)(圖1②)。雙熒光染色圖像(圖1 ③)。一次力竭組、反復力竭組與對照組相比,光斑數(shù)量、光斑面積、光密度大小、亮度強弱均發(fā)生改變,并可見心肌細胞Egr-1受刺激后在核內出現(xiàn)。
2.4 力竭運動后Egr-1蛋白表達
應用圖像分析系統(tǒng)對Egr-1的免疫熒光圖進行分析。由于積分灰度值是對熒光斑面積和熒光強度的一個綜合評價,因此本次實驗圖像以積分灰度值為評價標準,對Egr-1進行半定量分析。
一次力竭運動大鼠除24 h組以外,Egr-1蛋白含量在運動后整體上調,運動后即刻Egr-1即可在核內出現(xiàn),運動后即刻、6 h組、12 h組、24 h組蛋白表達呈現(xiàn)先上升再下降再上升再下降的變化趨勢,24 h組出現(xiàn)顯著性降低(見表3)。

表3 一次力竭運動后大鼠心肌E g r-1蛋白表達積分灰度值變化TableⅢ Changes of Rat Heart Muscle Egr-1 Protein Integral Expression of Gray Value after One-time Exhaustive Exercise
反復力竭運動組,Egr-1蛋白含量運動后即刻上升,但6 h后顯著性下降,隨后的12 h和24 h蛋白含量雖略呈上升趨勢,但顯著低于對照組(見表4)。
3 討論
在運動醫(yī)學研究中,大鼠動物實驗最常用的方法有游泳和跑臺兩種方法,但各有利弊。應用跑臺訓練大鼠跑步易于量化運動強度,但訓練時需采用電擊刺激或恐嚇等手段驅趕,易引起大鼠生理改變和機械性損傷,從而影響試驗結果。由于大鼠天生就會游泳,故大多學者認為游泳比跑臺優(yōu)點更多。大鼠在接受游泳訓練時,不會產(chǎn)生強烈的抵觸情緒,運動強度能維持在較高水平,對心臟的影響比較顯著,且承受體力外的不良刺激少。為保證試驗效果,查閱文獻多推薦大鼠游泳時水溫略低于體溫最為適宜,因而采用30~33℃的水溫。大鼠游泳時還要保證每只大鼠要有足夠的空間,一般每只大鼠至少應有300 cm2的水面,而水的深度至少超過大鼠身長加尾長,從而避免大鼠尾部支撐池底休息。在本次實驗中,參照Thomas等[1]、朱全等[2]的報道,游泳時大鼠負重為體重的3%,訓練至力竭時間一般為2~3 h,力竭標準是沉沒水中10 s仍不能回到水面,并且撈出水后不能完成翻正反射即為力竭。McArdle[3]從可信度和相關性兩個方面,考察了“經(jīng)10 s仍不能回到水面”的疲勞指標和“所有協(xié)調運動中止,大鼠不再能返回水面”的力竭指標間的關系,證實這兩個指標的可信度相似且高度相關(r=0.99),而前者顯然安全得多,因此我們選擇使用“經(jīng)10 s后仍不能返回水面”作衡量游泳能力時的觀察指標。
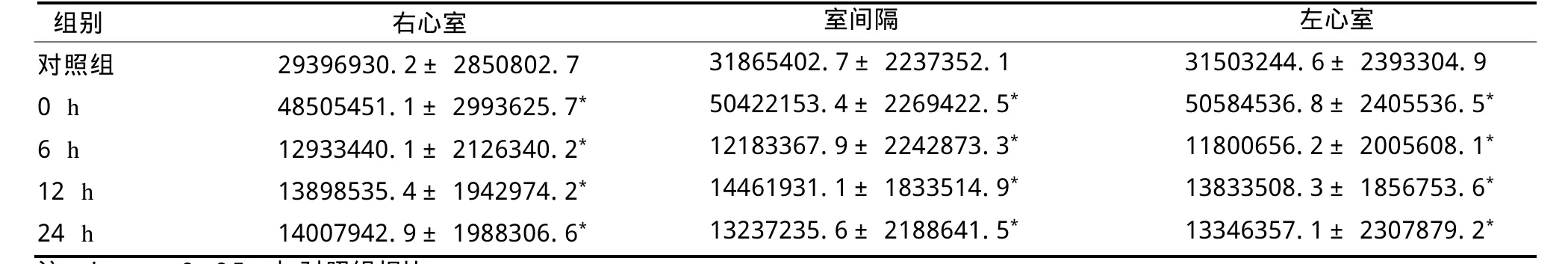
表4 反復力竭運動后大鼠心肌E g r-1蛋白表達積分灰度值變化TableⅣ Changes of Rat Heart Muscle Egr-1 Protein Integral Expression of Gray Value after Repeated Exhaustive Exercises
Egr-1屬即刻早期基因,是原癌基因家族中一類能被第二信使所誘導的原癌基因,由于細胞經(jīng)外部刺激后最先表達該類基因,固亦稱快速反應基因。近年來研究表明[4-8],Egr-1是聯(lián)系細胞生化改變與細胞最終對刺激發(fā)生特異性反應的中介物。Egr-1蛋白是一種含有3個鋅指狀結構的轉錄因子[21],能與核DNA某區(qū)段結合,誘發(fā)附近若干基因轉錄變化,從而抑制細胞生長,還能作用于細胞周期,起調節(jié)細胞生長和分化的作用,使細胞不過度生長。在生理狀態(tài)下可調整機體細胞的生長、分化和細胞內信息的傳遞,參與正常細胞的生長和發(fā)育過程,是心血管系統(tǒng)生長發(fā)育所必需的基因。在病理情況下,這些基因表達及調控的變化與多種疾病的發(fā)生發(fā)展有關。力竭運動使機體發(fā)生許多生理生化的變化,包括體溫升高、Ca2+濃度升高、體內自由基生成增加、局部組織缺血缺氧、糖原耗竭、能量儲備減少等,這些變化常導致生物體細胞Egr-1含量改變,此外心臟內如血壓負荷、牽拉、血管緊張素Ⅱ等多種刺激因素也可誘導Egr-1的表達異常。異常表達的Egr-1又可進一步誘導一系列下游基因的表達,包括白細胞介素(IL)-1β、巨噬細胞炎性蛋白-2(MIP-2)、細胞間黏附分子-1(ICAM-1)、組織因子(TF)等,這些因子隨后啟動炎性反應、凝血和血管通透性改變。此外有文獻認為[9],Egr-1上調與心肌肥厚存在某種聯(lián)系,Egr-1還影響SERCA2及心肌β受體的表達,從而直接影響了心肌細胞的收縮和舒張功能。
本次試驗各種力竭運動組即刻心肌Egr-1蛋白含量均升高,體現(xiàn)Egr-1快速反應的特性。其中一次力竭運動組即刻Egr-1蛋白含量與對照組差異顯著(P< 0.05),大量研究表明Egr-1表達異常與細胞損傷關系密切,Egr-1可參與調控多種基因觸發(fā)炎性細胞的趨化、聚集、激活凝血系統(tǒng)、產(chǎn)生氧自由基、形成微循環(huán)紊亂等。而后Egr-1蛋白含量在一次力竭運動6 h至12 h呈上升趨勢,研究發(fā)現(xiàn)[10-12],一次力竭運動對機體產(chǎn)生不利影響,可導致運動性疲勞與損傷的發(fā)生,尤其是運動性心肌微損傷,王東輝等[13]研究發(fā)現(xiàn),力竭運動引起的心肌損傷表現(xiàn)特點與臨床上心肌缺血再灌注損傷相似,這種損傷在6 h的時相較嚴重,24 h后有所減輕,但臨床病理性缺血時機體通常處于靜息狀態(tài),而運動時由于血液動力學性質改變和高負荷致心肌強烈收縮的力學因素,使心肌肌原纖維結構改變十分明顯。此外,多數(shù)學者認為原癌基因的誘發(fā)在缺血后的再灌注期,認為其誘導和表達為缺血再灌注損傷引起的繼發(fā)反應,包括:再灌注引起的自由基造成的組織損傷;直接缺血損傷之后的修復過程的開始;細胞增生的激活;離子流動(尤其是Ca2+)的改變,缺血后蛋白質的合成抑制;細胞內各種蛋白激酶的激活;多肽生長因子釋放;激素分泌等。12~24 h Egr-1蛋白含量明顯下降,證實Egr-1在心內表達時間較短。反復力竭運動組由于心肌出現(xiàn)疲勞和損傷的積累,導致除即刻組外Egr-1蛋白含量均顯著低于對照組含量(P<0.05),并最終沒有恢復到對照組水平,筆者認為與運動性心肌損傷有關。研究發(fā)現(xiàn),反復力竭運動對心肌造成的缺血缺氧損傷較一次力竭運動嚴重,反復力竭運動過程中心肌能量代謝異常,心肌疲勞與損傷累積疊加,最終導致心肌結構和功能的不可逆改變。由于各種力竭運動對心肌損傷過程相當復雜,因此筆者認為Egr-1表達異常與心肌超負荷應激過程及其產(chǎn)物、心肌缺血、再灌流及二者共同作用產(chǎn)物、心肌修復過程及其產(chǎn)物皆有聯(lián)系。
4 小結
4.1 不同力竭運動后心臟各部位Egr-1在運動后即刻明顯升高,表明心肌細胞Egr-1對力竭運動刺激產(chǎn)生快速應激反應,可能誘導炎性細胞的趨化、聚集以及氧自由基的產(chǎn)生。
[1]Thomas D P. (1988).Effect of repeated exhaustive exercise on myocardial sub cellular membrane structures. Int-J-sports-Med.9 (4):257-260.
[2]朱全,浦鈞宗.大鼠游泳訓練在運動實驗中的應用方法[J].中國運動醫(yī)學雜志,1996,2:125-129.
[3]McArdle W D, Montoye H J. (1966). Reliability of exhaustive swimming in the laboratory rat[J]. J Appl Physiol, 21(4):1431-1434.
[4]Cao X, Mahendran R, Guy GR, et al.(1993). Detection and characterization of cellular Egr-1 binding to its recognition site [J].J Biol Chem, 268(23):16949-16957.
[5]Yan SF, Lu J, Zou YS, et al. (2000). Protein kinase C-beta and oxygen deprivation. A novel Egr-1-dependent pathway for fibrin deposition in hypoxemic vasculature[J]. J Biol Chem, 275 (16):11921-11928.
[6]Yan SF, Lu J, Xu L, et al. (2000). Pulmonary expression of early growth response-1: biphasic time course and effect of oxygen concentration[J]. J Appl Physiol, 88(6):2303-2309.
[7]Yan SF,Fujita T, Lu JS et al.(2000). Egr-1, a master switch coordinating upregulation of divergent gene families underlying ischemic stress[J]. Nature Med, 6(12): 1355-1361.
[8]Slinker BK, Stephens RL, Fisher SA, et al. (1996).Immediateearly gene responses to different cardiac loads in the ejecting rabbit left ventricule[J]. J Mol Cell Cardiol, 28: 1565-1574.
[9]Kolbeck-Ruhmkorff C, Zimmer H. (1995). Proto-oncogene expression in the isolated working rat heart combination of pressure and volume overload with nor epinephrine [J]. J Mol Cell Cardiol, 279(1):501-511.
[10]Tata CA, Hyek MF, Taffet GE. (1994). Mechanisms for the responses of cardiac muscle to physical activity in age[J]. Med Sci Sports Exerc, 26(5): 561-567.
[11]Anversa P, Beghi C, Levichy V, et al.(1982). Morphomity of right ventricular hypertrophy induced by strenuous exercise in rat[J]. Am J Physiol, 243: H856-H861.
[12]Anversa P, Lecichy V, Beghi C, et al. (1983).Morphometry of exercise induced right ventricular hypertrophy in the rat[J]. Cir Res, 52:57-64.
[13]王東輝,熊若虹,鄭兵等.大鼠力竭游泳運動后不同時相心肌和血清SOD、GSH-Px、M DA和Ca2+的變化[J].沈陽體育學院學報,2 0 0 4,2 3(3):3 3 2.
[14]VIHKO V, SALMINEN A. (1983). Acid hydrolase activity in tissues of mice after physical stress[J]. Comp Biochem Physiol B, 76(2):341-344.
[15]HELAINE MA, ANN EH, SZILVIA N, et al. (2005). Exercise improves biomarkers of health and stress in animals fed ad libitum [J]. Physiol Behav, 84(7):65-72.
[16]PEDREANEZ A, ARCAYA JL, CARRIZO E, el al. (2006). Forced swimming test increases superoxide anion positive cells and angio-tensin ¢ò positive cells in the cerebrum and cerebellum of the rat[J]. Brain Res Bull, 71(13):18-22.
[17]常蕓,袁箭峰,王萊芮等.運動與心臟微損傷機制的研究[A],第七屆全國體育科學大會,論文摘要匯編(二)[C].北京:中國體育科學學會主辦,2 0 0 4
[18]宋熔,柳君澤.哺乳動物核呼吸因子研究進展[J].生理科學進展.2005,36(2):183-185.
[19]常蕓.運動心臟理論與實踐[M].北京:人民體育出版社,2008. 106-132
[20]Fu M, Zhang J, Lin Y, et al. (2002). Early growth response factor-1 is a critical transcriptional mediator of peroxisome proliferators-activated receptor-gamma 1 gene expression in human aortic smooth muscle cells[J]. J Biol Chem, 277 (30): 26808-26814.
[21]Thiel G, Cibelli G.(2002). Regulation of life and death by the zinc finger transcription factor Egr-1[J].J Cell Physiol, 193(3): 287-292.
(責任編輯:何聰)
Changes of Egr-1 Protein and It's Functions in the occurrence of Athletic Myocardial Micro-damage at the Different Phases after Exhaustive Exercise
YUAN Xu-xin, CHANG Yun
(China Institute of Sport Science, Beijing 100061, China)
Objective To explore the variation characteristics of early growth response genes Egr-1 protein level so as to provide experimental reference for the occurrence mechanism of athletic myocardial micro-damage and myocardial dysfunction. Method 100 healthy adult male SD rats were divided into three groups of one-time exhaustive swimming group, two-week repeated exhaustive swimming group and noexercise control group. Samples were collected immediately, 6 hours, 12 hours and 24 hours after exhaustive exercise. Immunofluorescence technology and image analysis were adopted to study the changes of rat myocardium Egr-1 protein level. Result The immediate Egr-1 protein levels of the different parts of rat myocardium increased significantly (P<0.05). Samples collected at 24 hours decreased distinctly compared to those of the control group (P<0.05). In repeated exhaustive group, the immediate Egr-1 protein levels of the different parts of rat myocardium increased significantly (P<0.05). Samples of Egr-1 protein levels of the different parts of rat myocardium at 6 hours, 12 hours and 24 hours were clearly lower than the control group (P<0.05). Conclusion Egr-1 of the different parts of heart increases immediately after the different exhaustive exercises shows that there is a rapid stress response of myocardial cell Egr-1 toward the stimulation of exhaustive exercise. This might lead to chemotaxis and aggregation of inflammatory cells and the production of OFR. Egr-1 of the different parts of heart returns normal level 24 hours after exhaustive exercise. This shows that Egr-1 after exhaustive exercise belongs to early-stage stress response and this response is reversible.
exhaustive exercise; rat; myocardium; early-stage growth response gene (Egr-1)
G804.5
A
1006-1207(2012)04-0030-05
2012-06-27
國家體育總局體育科學研究所基本科研業(yè)務經(jīng)費(09-10)
袁旭鑫,男,研究生. 主要研究方向:運動心臟病理與醫(yī)學監(jiān)督.
國家體育總局體育科學研究所,北京體育館路11號,北京100061

