我國獸藥行業的現狀與發展展望
馮忠武 (中國獸醫藥品監察所 所長)
1 獸藥行業的基本情況
經過多年發展,我國的獸藥行業從無到有、從小到大逐步發展起來,具有以下特點。
1.1 獸藥監督管理法規體系基本形成
1980 年國務院頒布 《獸藥管理暫行條例》,1987年正式頒布 《獸藥管理條例》 (以下簡稱 《條例》)。 但獸藥生產依然存在三亂問題,即生產亂、審批亂、使用亂。審批亂主要是解決新藥問題,原有 《條例》是二級審批,中央批原料,地方批制劑,出現了地方上大量的越權審批,造成了失控和交叉。標準亂是當時有國標、行標、地標,一些地方審批產品標準時沒有任何試驗數據。為解決這些問題,2004年對《條例》進行修訂和完善。將審批權和許可權集中,把新藥審批、標準審批、企業審批和產品審批一律上歸農業部,取消了行業標準和地方標準。目前我國已基本形成以 《獸藥管理條例》為中心的配套法律法規,確立了獸藥注冊評審、監督檢驗、生產經營許可、行政處罰等一系列管理制度。同時我國獸藥監督管理體系也基本形成,在基層主要依托獸醫行政管理部門和食品衛生監督部門來實施對獸藥的監督管理。
1.2 獸藥的行業發展已初具規模
經過30年的發展,我國的獸藥生產、經營企業數量不斷增加,產能不斷提高,從業人員數量不斷增加,行業規模不斷擴大。截至目前,我國共有獸藥生產企業1 820家,其中獸用生物制品企業78家。2011年中國獸藥協會對1 386家企業進行了統計,產值至2010年底超過331.35億元,銷售額304.38億元,產值年復合增長率12.27%。與此同時,行業的效益不斷提高,2010年1 386家生產企業總毛利94.06億元。
1.3 獸藥產業結構已趨向合理
據統計,生藥企業前10名的銷售額占到整個生藥企業銷售額的一半 (53%)。其中禽用生物制品銷售前10名占總銷售額的80.68%,豬用生物制品銷售前10名占總銷售額的62.66%,牛羊馬前5名占總銷售額的97.68%。化藥企業前10名的銷售額占整個化藥企業銷售額的18.35%。中藥銷售前10名的銷售額占整個中藥銷售額的20.06%。
行業結構趨于優化,多種所有制形式并存的產業經濟格局已初步形成,我國獸藥生產企業中有民營企業、國有企業、中外合資企業以及外國獨資企業。
獸藥行業的資源集中化趨勢已經初步顯現。集團化、現代化的獸藥企業已經出現,2008年全國年銷售收入過億元人民幣的生產企業有23家,有14家企業在上海、深圳的證券交易所上市。
獸藥行業布局也發生了積極的變化,獸藥生產的優勢產業帶逐步形成,并基本上與畜牧養殖業發展狀況相適應,與畜牧生產的優勢產區相匹配,畜牧業相對發達的地區也是獸藥生產企業相對集中的地區,魯、豫、蘇、粵、冀五省的獸藥銷售收入占全國的48.8%。
1.4 獸藥標準體系基本完善
我國目前已建立了以 《中華人民共和國獸藥典》 (以下簡稱 《中國獸藥典》)為核心的獸藥標準體系。2010版 《中國獸藥典》在2005版的基礎上進一步對我國所有的獸藥品種進行了全面、系統的梳理,不同程度地進行了修改、補充和完善,共收載1 829種獸藥品種,新增604種,修訂1 182種。其中一部收載化學藥品592種,二部收載中藥材及其成方制劑1 114種,三部收載生物制品123種。
1.5 獸藥生產漸趨規范,產品質量逐年提高
2004 年公布 《獸藥管理條例》以后,農業部實施了獸藥GMP(《藥品生產質量管理規范》)的零點行動計劃,使獸藥GMP的實施步驟明顯加快,獸藥企業的生產行為逐步規范,產品質量的合格率也呈上升趨勢。在2004年 《獸藥管理條例》剛頒布時,化學藥品抽檢合格率只有69.3%,2011年化學藥品的抽檢合格率達到91.4%;獸用生物制品質量抽檢合格率2004年為83.7%,到2011年整個疫苗的抽檢合格率為95.8%,其中重大動物疫病疫苗抽檢合格率100%。
1.6 科技創新能力不斷提升
目前我國80.37%的生藥企業和化藥企業設立了研發部門。2010年獸藥生產企業的研發資金總投入為14.78億元,占獸藥產業總銷售收入的4.85%。其中生藥企業研發資金總投入4.45億元,占生物制品企業總銷售額的7.16%;化藥企業研發資金總投入為10.33億元,占年銷售額的4.26%;且新藥的研發投入還在逐年增長。
表1為生藥和化藥企業研發人員的配備情況。從表中可以看出,被調查的1 126家獸藥生產企業,從事生物制品研發的具有中、高級職稱的人員比例接近50%,從事化藥研發的具有中、高級職稱的人員超過了50%。分類統計結果表明,2010年前50名規模較大的獸藥企業比50名以后的企業更重視新產品研發,且生藥企業比化藥企業更重視新藥的研發工作。
研發的方式有自主研發、與科研單位聯合研發和與其他企業聯合研發,其中化藥企業與科研單位聯合研發的比重較高。我國新藥研發的特點第一是仿制為主;第二是特別重視食品動物;第三是抗感染藥物占主導地位,抗菌藥物和抗生素加起來達到51%。這與我國養殖業的發展歷史有關,改革開放以后,為了滿足城鄉居民的肉、蛋、奶消費需求,我國開始大力發展養殖業。但由于我國養殖業管理水平低、飼養條件差、規模小、疫病變異程度高,依靠抗菌藥物和抗生素來減少動物疫病的發生,這使得二十世紀八、九十年代的新獸藥研發重點為抗感染藥物。第四是獸藥劑型和制劑種類單一,國外研發新藥一般一個原料要配伍7個制劑,而我國一個原料的制劑沒有超過4個,一般都是2~3個,劑型的研發較少。第五是中獸藥和中西復方制劑品種繁多。
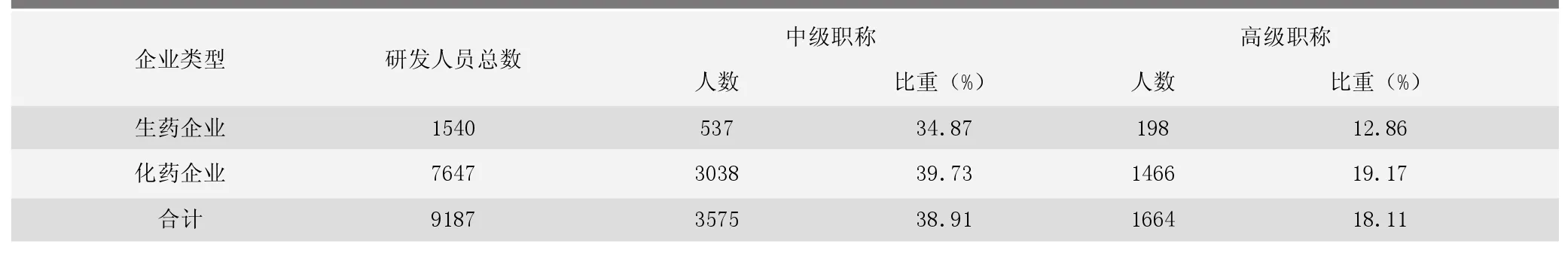
表1 研發人員的配備情況 單位:人
據統計,1987~2011年,我國共批準780種新藥產品,其中化學藥品254種,生物制品286種。共允許外國企業的788個獸藥品種在中國注冊、銷售和使用。批準的新生物制品中最多的是禽用疫苗,這和我國養殖業的結構模式相一致。20世紀80年代我國開始從國外大量引進蛋雞、肉雞,發展蛋雞、肉雞生產,需研發相應疫苗對禽病進行預防。發展第二的是診斷試劑盒,20世紀90年代,農業部曾試圖對全國所有養殖場的疫病進行凈化,尤其是核心育種場,開展了聲勢浩大的動物疫情調查,由此診斷試劑盒的研發得到重視。
2 獸藥行業發展中存在的問題
2.1 結構不合理的問題日益顯現
一是企業結構不合理,數量多、規模小、管理差、效益低。2011年我國共有獸藥企業1 820家,其中,大型生藥企業產值占整個生藥企業產值的比重不到30%,中、小型企業的產值比重超過50%;而化藥企業情況更為嚴重,大型企業的產值只占3.71%,小型企業產值比重占到66.84% (表2)。
二是產品結構不合理。以化學藥品為例,按產品劑型分,我國生產最多的是粉散劑和預混劑。粉散劑生產線因投入少、要求低、建廠速度快而建設最多,生產和銷售量也最大。而一些高科技產品包括我國畜牧生產中急需的產品如靶向制劑、透皮吸收劑卻十分稀缺。按照產品功能分,我國的獸藥產品主要是常用疾病和傳染性疾病的預防性用藥,產品份額超過70%。按照使用動物分,大多數廠家的產品都集中在食品動物如常規的家畜、家禽身上,其它如特種動物、觀賞動物、寵物等使用的產品非常缺乏,特別是專用的寵物用藥非常少。在生物制品方面,水禽疫苗、水產疫苗和診斷試劑比較缺乏;從工藝角度分析,目前我國急需的耐熱保護劑疫苗、穩定可靠的多價苗、多聯苗非常缺乏。
從技術研發角度來看,研發的主要為粉劑、散劑、預混劑等大眾劑型和常規產品,化學藥品、粉散劑太多,而新的現代生物技術、基因重組技術、中藥提取技術等新藥篩選技術應用甚少。從生產角度來講,絕大多數企業重生產、輕工藝、輕制劑,重銷售、輕服務;同時由于未形成專業的獸藥設備與配套設施生產體系,對獸藥新工藝、新產品開發的研究嚴重滯后。在產品環節,我國重生產、輕流通的現象更為嚴重,出口以化工原料為主,制劑較少,附加值較低。
2.2 重復建設比較嚴重
一是產能過剩嚴重,以生物制品為例,活疫苗的產能利用率為33.62%,剛好達到國際產能利用率的最低限 (30%),而細菌活疫苗的產能利用率不到10%,基因工程苗產能利用率最高,達到52.63%。而化學藥品的產能利用率更低,如粉散劑的產能利用率為38.37%,預混劑為44.15%。二是產品同質化嚴重,單個產品批準文號數量超過800個的有16個品種,主要是粉散劑 (有13個),即某些粉散劑各廠都有批準文號,都在生產。
2.3 法律法規和技術標準體系不健全
一是獸藥法規已不適應行業發展的需要。2004年頒布的《條例》,已經不適應目前獸藥市場的情況。這些年的實踐證明,按照安全等級的劃分分級審批會較好,安全風險系數小的一些產品和劑型,可以讓地方審批,安全風險系數大的產品如生物制品、小型無菌制劑如粉針劑和大輸液等由農業部審批。標準分成國家標準和行業標準為妥, 《中國獸藥典》是國家標準, 《中國獸藥典》之外的由農業部頒布的其它標準是行業標準,這樣在實施的過程中會更好。目前由于獸藥法規的審批權上升,地方在獸藥監督執法過程中積極性明顯不高。從另外一個角度講,為了調動和提高地方的監管積極性,應適當地把一些行政許可的權限給地方, 《條例》這方面的條款應相應修改。
二是行政管理體系不夠健全。我國的獸藥管理體系是由獸醫管理部門負責轄區內的獸藥管理工作,但從這幾年的發展情況來看,獸藥執法在一定程度上有所削弱。原來我國的獸藥管理體系是國家有中國獸醫藥品監察所,省里有省所,有90個地區級的獸藥監察所和250個縣級獸藥監察所,但這幾年因歸并和撤消,目前基層的獸藥監察基本沒有,且我國現有的獸醫執法體系零亂,獸藥的執法更不健全。
三是自主創新能力有限,新藥研發問題突出。一是研發主體破裂,生產企業是研發的主體,研發和生產嚴重脫節。三是創新能力不足。如西藥研發以仿制為主,自主創新的西藥非常少。四是在中獸藥的認識上存在誤區,中藥分為上、中、下三品,認為是藥三分毒。而現在某些企業、專家在宣傳過程中宣稱中獸藥是安全、綠色、無殘毒的,未能通過試驗深入研究其發生作用的主要成分、代謝后的殘留。中成藥應按照研究化學藥品的方法進行深入的研究,對上市的中獸藥要進行安全評價。

表2 我國獸藥企業生產規模及產值狀況表 單位:個
生物制品研發中存在的問題:一是研發的整體水平不高。二是疫苗的應激反應大,影響畜牧生產,造成生產性能下降。三是生產中使用的疫苗單苗較多,聯苗較少。四是一些影響畜牧生產的疫病還沒有疫苗。五是現有疫苗質量不夠穩定,指標不高。六是疫苗產品結構不合理,生產中需要的能抗多種疾病的多聯或多價疫苗沒有,而且對變異的超強毒、流行毒或變異株研究不夠。七是生產工藝比較落后,國外大量生產的疫苗都是低溫保藏,而我國多是凍干保藏,在使用時解凍困難,影響疫苗質量。
3 今后發展的展望
3.1 我國獸藥市場發展趨勢
據預測,美國、中國、巴西、法國、日本將成為全球五大動物保健品市場。中國未來幾年動物保健品總值將超過500億元人民幣,位于全球第二。不同地區銷售情況都處于上升趨勢,其中亞洲東部將成為增長最快的地域。據預測,今后幾年,各種動保產品都呈增長態勢,其中生物制品將增長3.6%,而抗感染藥物僅為1.1%。這也說明,隨著食品安全要求的增加,抗菌素殘留越來越被人們重視,將呈現使用量逐步下降甚至禁止使用的趨勢。如歐盟已經全面禁止使用抗生素作為飼料添加劑并限制抗菌藥物的使用,我國也將逐步向這個方向發展。
我國獸藥產業的發展取決于我國畜產品的需求情況,需求取決于三個因素,一是人口總量的增長,我國人口總數將持續增加,到2033年前后達到峰值 (約15億);二是購買力的增長,未來20年我國經濟仍將保持5%~8%的增長,居民收入將保持同步增長;三是城市居民人口的增加,我國的耕地面積在減少,城鎮化率在增加,會有更多的人消費動物產品,即養殖產品消費量仍將呈現較高增長的態勢。這就意味著需求的畜產品在增加,有更多的動物要飼養,也就需要更多的獸藥產品為動物的健康生長做保障。
基于此,對我國幾個主要養殖省份今后幾年的養殖模式、用藥情況、動物防疫免疫情況進行預測,其中商品豬的需求量最大,其次是肉雞和蛋雞。按照需求,我國今后獸藥的發展目標如下:一是產業和產品結構進一步優化。到2015年,產能利用率力爭提高10個百分點,形成10~15個具有自主知識產權和國際競爭力的企業,向集團化和專業化方向發展,獸藥產業總產值達到400億以上。二是行業監管能力進一步提高。要完善法規、標準體系,基本建立國家獸藥監管信息系統,加強獸藥檢測檢驗、獸藥殘留及耐藥性檢測,初步建立技術支撐體系、獸藥風險評估和安全評價體系,逐步完善基層獸藥執法監督體系。三是產品質量安全水平穩步提升。企業要講誠信,按照行業發展標準提高產品質量。產品質量和誠信是我國企業立足于行業并發展的基礎和條件。獸藥產品質量抽檢合格率應力爭達到95%以上;獸藥使用科學合理,畜禽產品獸藥殘留的合格率要保持在99%以上。四是科技創新能力持續提高。要培育10~20個獸藥研究平臺或工程中心來支撐我國獸藥的創新和研發,從現在的以仿制為主,逐步過渡到自主創新,與國際社會接軌。
3.2 主要任務
3.2.1 優化產業結構,促進產業升級
在優化產業結構方面首先要建立行業準入和退出機制;其次要鼓勵低污染、低能耗、低排放、工藝先進的項目進入獸藥行業。在調整產品結構方面,要增加寵物藥的比例,現在我國寵物藥基本是空白;要增加抗寄生蟲藥物的比重,國際上用量最大的是驅蟲藥,包括牛和羊的驅蟲藥,我國在這方面也有需求。
3.2.2 完善獸藥法規標準,提升規范化管理水平
加強獸藥法規體系建設,形成以 《條例》為核心,配套規章完善的獸藥法律法規體系。目前要制定獸用處方藥和非處方藥管理辦法,實行職業獸醫執證上崗制度,這是我國獸藥分類管理制度的基礎,要陸續出臺獸用生物制品批簽發管理辦法等管理規范,完善標準體系。
3.2.3 建立健全技術支撐體系,提高技術支撐能力
建立、完善獸藥與新獸藥的風險評估和安全評價體系,建立應急審批程序和現場工作檢查制度,加強省級、地市級和縣級獸藥檢測機構建設。其中執法和檢驗的重點是縣級,縣級的獸藥使用和經營環節都需把關,應在縣級設立相應的獸藥監測機構,從事相關的獸藥產品質量檢驗工作,把好獸藥的質量關,以加強食品安全的管理。在新藥研發方面,要實施 “兩點”創新戰略,把握國家產業政策與市場需求的“結合點”,帶動行業技術進步;填補產品與技術的 “空白點”,即隨著養殖業的發展,我國動物防疫模式由原來的以治療為主轉變為預防為主和養重于防,獸藥研發也要與此相適應,從治療藥轉為預防藥,進而轉為保健藥。在化藥研發方面要注重安全、高效、環保獸藥的研究,注重研發獸藥的新劑型,加強寵物和水生動物用藥的開發。生物制品的研發重點一是現有產品質量的提高,其次是工藝的改進,新技術的應用,疫苗新型佐劑和凍干保護劑的研究。
(以上內容根據報告錄音和相關資料整理,未經作者本人審核)

