Stat3-siRNA表達(dá)質(zhì)粒在AFP陽性腫瘤基因治療中的應(yīng)用
鹿理友 于傳亭 辛志玲
肝癌是我國最常見的惡性腫瘤之一,具有發(fā)展迅速,侵襲性強(qiáng),惡性程度高,預(yù)后差等特點(diǎn)[1]。雖然手術(shù)技術(shù)的提高,治療有了很大的提高,但發(fā)現(xiàn)時往往已至晚期,手術(shù)效果不理想。基因表達(dá)水平的改變是細(xì)胞癌變的一個重要因素。近幾年發(fā)現(xiàn)和發(fā)展起來的RNA干擾技術(shù),是一種新興基因阻斷技術(shù),同源性mRNA的降解通過內(nèi)外源性雙鏈RNA觸發(fā),從而使該基因表達(dá)沉默。人體正常組織及細(xì)胞中有STATs少許表達(dá),正常的生理功能得以維持。但持續(xù)性的激活在腫瘤組織及細(xì)胞中卻表現(xiàn)出來[2],被認(rèn)為是潛在的腫瘤抑制因子。其中以sTAT3尤為活躍,現(xiàn)多認(rèn)為其可促進(jìn)腫瘤細(xì)胞的凋亡[3]。本研究觀察stat3-siRNA表達(dá)質(zhì)粒在治療AFP陽性腫瘤基因中的作用。
1 材料與方法
1.1 材料 RPMI 1640培養(yǎng)基購自Invitro-gen公司;無內(nèi)毒素質(zhì)粒提取試劑盒購自Qiagen公司;轉(zhuǎn)染試劑購自大連寶生物公司;電脈沖儀為德國ECM 630;電擊杯購自Bio-Rad生物公司;細(xì)胞總RNA提取試劑盒(北京天根生化科技有限公司);反轉(zhuǎn)錄-聚合酶鏈反應(yīng)(reverse transcription-p01ymerase chain reaction,RT-PCR)試劑盒購自TAKARA公司;人肝癌細(xì)胞株HepG2為本室保存。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) 常規(guī)方法接種于1640新鮮培養(yǎng)基復(fù)蘇的肝癌細(xì)胞株 HepG2,于37℃,5%的 CO2培養(yǎng)箱中培養(yǎng),含10%小牛血清,含均100 U/ml雙抗青霉素、鏈霉素,G418濃度為400ug/ml,傳代培養(yǎng)用0.25%的胰蛋白酶消化,觀察是否為細(xì)胞對數(shù)生長期,備實(shí)驗(yàn)用。
1.2.2 質(zhì)粒DNA的擴(kuò)增與抽提 由上海生物工程技術(shù)有限公司合成的長度為350 bpPCR產(chǎn)物,引物序列如下:βactin sense: 5'GCACCACACCTTCTACAATG 3'; antisense:5'GTGGTGAAGCTGTAGC3'。根據(jù)美國國立衛(wèi)生圖書館基因庫中人STAT 3 mRNA序列(NM 31500)合成其引物序列如下:mstAT 3 sense:5'CAGccTcTCTGCAGAATTCAA3';antisense:5'AGCCCATGTGATCTGACACC 3',取 100 μl感受態(tài)細(xì)胞,待轉(zhuǎn)化的質(zhì)粒DNA50ng加入,輕輕混勻后30 min冰浴,熱休克42℃90 s后,立刻2 min冰浴,LB 培養(yǎng)基900 μl加入,搖床振蕩,45 min培養(yǎng)。離心5 min以4℃4000 r/min,大部分上清棄去,僅200 μl培養(yǎng)基留下,菌體輕輕莆懸,在50 μg/ml氨芐青霉素的LB瓊脂糖平板上將其涂布,37℃培養(yǎng)過夜,接種陽性菌落于4ml LB培養(yǎng)基中,37℃振蕩過夜。質(zhì)粒抽提采用美國Qiagen公司小提質(zhì)粒試劑盒,嚴(yán)格依照說明書步驟提取。
1.2.3 RNA的提取 按試劑說明書完成RT-PCR收獲的細(xì)胞,取總RNA10 μg逆轉(zhuǎn)錄為cDNA以紫外分光光度計(jì)法定量后進(jìn)行,PCR條件:94℃,5 min;94℃,30 s;56℃,30 s;72℃,45 s;72℃,7 min,30循環(huán),25 μL體系,PCR 產(chǎn)物以20 g/L瓊脂糖凝膠電泳,以β-actin為內(nèi)參,EB染色,圖像分析應(yīng)用天能Gis凝膠成像系統(tǒng),以光密度/面積表示PCR產(chǎn)物量,最終結(jié)果以STAT3產(chǎn)物量/b-actin產(chǎn)物量的比值,3次實(shí)驗(yàn)重復(fù),引物序列:引物均由上海生工公司合成,B-actin:Sense5'-AAGTACTCCGTGTGGATCGG-3', Antisence5'-ATGCTATCACCTCCCCTGTG-3';STAT3:Sense5'-TTGCCAGTTGTGGTGATC-3',Antisence 5'-AGACCCAGAAGGAGCCGC-3'。
1.2.4 Western blot方法檢測 收集空白組、陰性對照組、siRNA組細(xì)胞。離心制備的單細(xì)胞懸液,上清液棄去,PBS沖洗,50 μl預(yù)冷的細(xì)胞裂解液加入,30 min冰浴中裂解,離心20 min已4℃、12000r/min,取上清,-70℃保存待測。測定蛋白含量應(yīng)用Bradford比色法。樣品電轉(zhuǎn)移到PVDF膜上,在SDS-PAGE聚丙烯酰胺凝膠電泳分離后。置PVDF膜于5%脫脂奶粉溶液中。4℃封閉過夜。加入兔抗人,濃度為1∶500~1∶1000,1.5~2 h抗孵育。TBST洗膜后加入羊抗兔二抗1∶5000孵育。lh孵育,Lurriglo Keageut試劑A、B液洗膜后加入,反應(yīng)15~30 min。X光片暴光,拍照。
1.2.5 流式細(xì)胞儀檢測細(xì)胞凋亡 培養(yǎng)緩沖液中加入轉(zhuǎn)染后的肝癌細(xì)胞,按Immuno-tech公司的說明書進(jìn)行,用冰PBS液洗2次1×106個/ml細(xì)胞,細(xì)胞濃度調(diào)整為1×106個/ml,于490 μL細(xì)胞懸液中加入5 μl Annexin V液(1∶10稀釋)和5ul碘化丙錠(250μg/ml,冰浴放置10min,轉(zhuǎn)染48h后的細(xì)胞1×106個分別收集,離心,細(xì)胞用冷PBS懸浮,離心10min以1000 r/min,清洗2遍,棄上清,用1ml注射器將細(xì)胞快速推入700ml/L冷乙醇中,4℃固定12 h以上,PBS洗2次,細(xì)胞密度調(diào)整為1×109/L,用RNase消化后,1.5ml PI50 mg/L加入對DNA進(jìn)行染色,混勻后單參數(shù)分析上流式細(xì)胞儀FCM做,各期細(xì)胞所占比例根據(jù)實(shí)驗(yàn)數(shù)據(jù)用累積曲線分割法計(jì)算,實(shí)驗(yàn)共重復(fù)3次,用流式細(xì)胞儀分析細(xì)胞凋亡情況。
1.3 統(tǒng)計(jì)學(xué)方法 采用SPSS 13.0軟件進(jìn)行數(shù)據(jù)處理,計(jì)量數(shù)據(jù)均以均數(shù)±標(biāo)準(zhǔn)差(±s)表示。多組均數(shù)間的顯著性檢驗(yàn)用方差分析,兩組均數(shù)間的比較用t檢驗(yàn),P<0.05表示差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 stat3 mRNA的表達(dá)量比較 經(jīng)比較,stat3相對量在空白組和陰性對照組無明顯差異,siRNA組的stat3相對量比空白組和陰性對照組明顯減少(P<0.01),見表1。
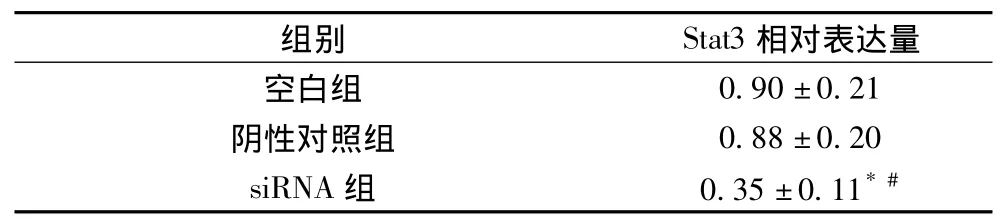
表1 stat3 mRNA的表達(dá)量比較
2.2 凋亡率與G1期阻滯率的比較 流式細(xì)胞儀結(jié)果顯示,轉(zhuǎn)染stat3-siRNA的細(xì)胞與陰性對照組、空白對照組比較在G1期出現(xiàn)明顯阻滯,在 G1期出現(xiàn)的阻滯為(78.17±21.73)%,凋亡率達(dá)(21.39±9.47)%,與空白組和陰性對照組比較有明顯差異(P<0.01),見表2。
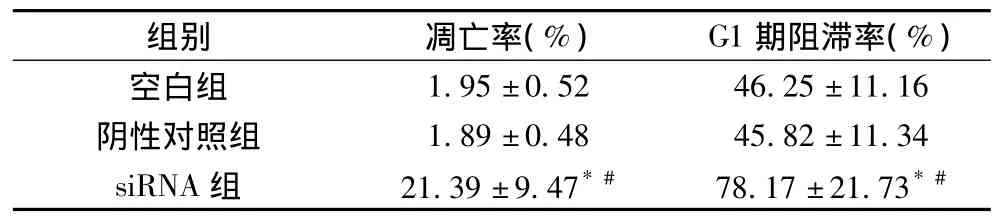
表2 凋亡率與G1期阻滯率的比較
3 討論
世界范圍內(nèi)原發(fā)性肝癌是發(fā)病率最高的惡性腫瘤之一,新患此病的患者每年約有100萬以上,肝癌發(fā)患者數(shù)中國居世界首位,每年死于肝癌約23萬人,占全球肝癌患者死亡數(shù)的53%,列惡性腫瘤病死率第2位,雖有進(jìn)展的綜合性治療手段,但令人滿意的療效仍不能取得[4]。到目前尚未清楚肝癌的確切發(fā)病機(jī)制,但可以肯定其形成是一個多因素、多階段、多步驟、多系統(tǒng)、多基因參與的復(fù)雜過程,一些信號轉(zhuǎn)導(dǎo)通路的異常可能涉及到,進(jìn)而異常的激活一系列原癌基因以及失活導(dǎo)致的抑癌基因突變。
近年來興起的RNAi技術(shù),分子生物治療中為異常表達(dá)stat3腫瘤開辟了新的途徑,與傳統(tǒng)的基因治療方法相比RNAi具有兩大明顯優(yōu)勢,高特異性和高抑制率,與之序列同源的mRNA能夠被siRNA非常特異地誘導(dǎo)降解,而無關(guān)基因不受影響;且其表達(dá)抑制基因的效率極高,甚至基因表達(dá)可完全阻斷,效果接近基因敲除技術(shù)。siRNA是21-23bp小片段雙鏈RNA,可以和靶基因mRNA序列特異性互補(bǔ)結(jié)合,誘導(dǎo)其降解,RNA干擾效應(yīng)產(chǎn)生強(qiáng)大[5]。近年siRNA成功轉(zhuǎn)入活體內(nèi)的進(jìn)展,使得siRNA藥物被人們越來越期待能成為精力充沛的“魔術(shù)子彈”,應(yīng)用于病毒感染、寄生蟲感染、人類腫瘤等的治療[6]。siRNA可以特異性地作用于信號轉(zhuǎn)導(dǎo)通路以及肝癌的相關(guān)基因,可望提供標(biāo)記物和治療靶點(diǎn)為肝癌的診斷和治療[7]。與蛋白相比,在細(xì)胞能耗方面非編碼RNA作為調(diào)控分子存在優(yōu)勢,因?yàn)槠洳恍枰g,能量消耗更少,而且比蛋白更容易降解[8]。
Stat3是一類脫氧核糖核酸結(jié)合蛋白,有少量表達(dá)在細(xì)胞漿內(nèi),其在細(xì)胞核內(nèi)無表達(dá),是轉(zhuǎn)錄激活因子家族與信號轉(zhuǎn)導(dǎo)的重要成員之一。Stat3信號傳導(dǎo)通路接受多種非受體酪氨酸激酶、G蛋白、細(xì)胞因子、生長因子等分子刺激,通過借助細(xì)胞內(nèi)的一類具有激酶結(jié)構(gòu)的連接蛋白JAKs磷酸化而被激活從而完成信息轉(zhuǎn)導(dǎo)。設(shè)想癌細(xì)胞內(nèi)stat3基因的表達(dá)如能設(shè)法阻斷,癌細(xì)胞增殖能力定會大大減弱,同時減弱凋亡抑制[9]。Gao等[10]設(shè)計(jì)人喉部鱗狀細(xì)胞癌Hep2細(xì)胞轉(zhuǎn)染兩對STAT3-siRNA,研究結(jié)果顯示在未經(jīng)處理的Hep2細(xì)胞和空質(zhì)粒對照的Hep2細(xì)胞中STAT3被表達(dá),而STAT3的表達(dá)在siRNA-sTAT3轉(zhuǎn)染的細(xì)胞中明顯減少,且表現(xiàn)為時間和劑量依賴性。
RNAi技術(shù)可以使特定基因的表達(dá)在mRNA水平抑制。而一種簡單有效的RNAi實(shí)現(xiàn)方法是通過化學(xué)合成、細(xì)胞內(nèi)表達(dá)siRNA。本研究中,我們成功地合成了siRNA轉(zhuǎn)染肝癌HepG2細(xì)胞后。實(shí)現(xiàn)了有效抑制STAT3的基因表達(dá),與空白組和陰性對照組均有明顯差異(P<0.01)。充分顯示了該技術(shù)抑制基因表達(dá)特異、高效、簡便快捷的優(yōu)點(diǎn)。應(yīng)用Western blot證實(shí)stat3在人肝癌細(xì)胞的過度表達(dá)由于siRNA而明顯抑制,隨著stat3表達(dá)抑制,癌細(xì)胞出現(xiàn)凋亡,本研究顯示siRNA組的凋亡率明顯比空白組和陰性對照組增高(P<0.01)。我們認(rèn)為,以sTAT3為靶點(diǎn)的siRNA技術(shù)有望成為肝癌基因治療的新途徑。
[1]Bosch FX.Ribes J,Diaz M,et al.Primary liver cancer:worldwide incidence and trends.Gastroenterology,2004,127(5 suppl 1):5-16.
[2]杜攀,稅青林.STATs與腫瘤治療的研究進(jìn)展.現(xiàn)代診斷與治療,2010,21(2):100-103.
[3]Huang Y,Li X,liang J,et al.Prolaetin modulates phosphorylation,signaling and trafficking of epidermal growth factor receptor in human T47 d breast cancer cells.Oncogene,2006,25(58):7565-7576.
[4]Marsh JW,F(xiàn)inkelstein SD,Schwartz ME,et al.Advancing the diagnosis and treatment of hepatocellular caxcinonma.Liver Transpl,2005,11(4):469-472.
[5]Lopes RB,Gangeswaran R,McNeish IA,et al.Expression of the IAP protein family is dysregulated in pancreatic cancer cells and is important for resistance to chemotherapy.Int J Cancer,2007,120(11):2344-2352.
[6]Cejka D,Losert D,Wacheck V.Short interfering RNA(siRNA):tool or therapeutic?Clin Sci(Lond),2006,110(2):47-58.
[7]Kruglova IS,Meshchaninova MI,VeniaminovaAG,et al.Cholesterol-modified anti-MDR1 small interfering RNA uptake and biologicalactivity.MolBiol,2010,44(2):284-293.
[8]Szymanskia M,Barciszewskaa MZ,Erdmannb VA,et al.A new frontier for molecular medicine:noncoding RNAs.Biochim Biophys Acta,2005,1756(12):65-75.
[9]趙樹鵬,朱培,齊鳳杰.SiRNA抑制Stat3基因?qū)θ巳橄侔┘?xì)胞的影響.廣東醫(yī)學(xué),2010,31(12):1520-1523.
[10]Gao L F,xu DQ,wen LJ,et al.Inhibition of sTAT3 expression by siRNA suppresses growth and induces apoptosis in laryngeal cancer cells.Acta Pharmacol,2005,26(3):377-383.

