桿狀病毒表面展示丙型肝炎病毒結構蛋白及其對丙型肝炎病毒的檢測*
李 祥,金愛慧,鄒立林,高基民,呂建新
(溫州醫學院浙江省醫學遺傳學重點實驗室,浙江省模式生物技術與應用重點實驗室,浙江 溫州 325035)
丙型肝炎是一種主要經血液傳播的疾病,丙型肝炎病毒(hepatitis C virus,HCV)慢性感染可導致肝臟慢性炎癥性壞死和纖維化,部分患者可發展為肝硬化甚至肝細胞癌(hepatic celluler cancar,HCC)。因此,肝炎病毒的早期檢測對治療和防御疾病的惡化至關重要。
近年來,國內外對HCV的檢測技術越來越先進,如PCR技術和基因芯片的應用等。HCV-RNA核酸擴增檢測技術(nucleic-acid amplification technology,NAT)可精確地檢測血清中HCV的載量,是預測和觀察抗病毒效果的重要指標。但HCV RNA在達到峰值或重新出現前數天或數周內偶爾也可能檢測不到[1]。此外,其它很多因素也影響患者的HCV檢出率。目前,美國已采用了RIBA 3.0試劑檢測技術來檢測HCV,但是抗-HCV檢測方法陽性率低。另外,由于“窗口期”的存在,仍有一定的漏檢率[2]。
對于抗-HCV的檢測,核心蛋白(core,C)和外膜蛋白(envelope,E)被認為能有效提高抗-HCV的靈敏度,但其對抗體的檢出率依賴于抗原的獲得方法,可能與抗原的構象表位有關[3-4]。而開發HCV抗體蛋白芯片檢測技術已經成為科研人員關注的熱點。在HCV檢測中,加強和擴大對HCV不同編碼區的抗體檢測,是近年來該領域研究的一個新熱點,它直接關系到檢測技術的準確率和應用率。
桿狀病毒表面展示(baculovirus surface display)系統是在對病毒基因組結構和功能深刻認識的基礎上發展起來的。通過在病毒衣殼蛋白插入外源肽、與衣殼蛋白融合表達或與特異性的錨定部位結合,桿狀病毒表面展示系統可以在被感染細胞或病毒粒子的表面大量展示目的多肽或蛋白[5-6],而且還能對外源蛋白進行糖基化加工和折疊等翻譯后修飾,尤其適合于展示需要特異的翻譯后加工才能有效折疊和具有生物活性的細胞表面蛋白和分泌蛋白[5,7]。目前研究及應用最為廣泛的桿狀病毒表面展示系統是苜蓿銀紋夜蛾核多角體病毒(Autographa canifornica multiple nucleopolyhedrovirus,AcMNPV)表面展示系統[6,8],效率最高的展示措施是將外源肽或蛋白與膜融合蛋白GP64融合形成融合蛋白。外源蛋白插入N端信號肽后與GP64融合,加工后信號肽被切除,形成的N端融合蛋白可以穩定地表達在病毒粒子的表面[9]。
本實驗根據桿狀病毒表面展示系統的特點,我們將HCV的C、E1和E2抗原兩兩融合或三者融合構建成重組桿狀病毒并將這些蛋白表達在病毒粒子的表面;將重組桿狀病毒粒子經過濃縮純化后對HCV的樣品進行檢測。
材料和方法
1 細胞系和病毒
實驗所使用的昆蟲細胞系為Sf9。Sf9來源于Spodoptera frugiperda(草地夜蛾)卵巢細胞,由中國科學院武漢病毒研究所中國典型培養物保藏中心(CCTCC,武漢)。Sf9傳代培養采用25 cm2的培養瓶以單層細胞的形式多次傳代,培養基為含10%胎牛血清的Grace培養基(Gibco-BRL),培養溫度為27℃。
2 主要試劑和儀器
限制性核酸內切酶、核酸分子量marker、T4 DNA連接酶及其配套緩沖溶液均購自TaKaRa。PCR產物回收試劑盒和質粒純化試劑盒購自V-Gene。HCV C抗體、Cy3標記的羊抗小鼠IgG、堿性磷酸酶標記的羊抗小鼠IgG和小鼠抗人IgG購自深圳晶美生物公司;NBT和BCIP溶液購自碧云天生物公司。HCV抗體ELISA試劑盒購自上海科華公司。分析緩沖液、增強液等購自廣州達瑞公司,時間分辨熒光免疫分析儀購自PE。
3 主要方法
3.1 重組病毒的構建及其制備 我們首先將經PCR獲得的HCV C、E和CE基因分別插入pSKF64載體的Sal I和Pst I及Pst I和Xba lI位點(C基因上游引物5'-GGG CTG CAG GAG CAC TGC AAC GCG CAA -3',下游引物 5'-GGG AAG CTT TTA ATA TTG TCT ATT ACG GTT TCT AA-3';E基因上游引物5'-GGG AGA TCT TAC CAA GTG CGC AAT TCC-3',下游引物 5'- GGG GAA TTC GCC GCT ACC CGA GCC CGC CTC CGC TTG GGA TAT-3';CE基因上游引物5'-GGG ACT AGT ATG AGC ACG AAT CCT AAA CCT -3',下游引物5'-GGG CTG CAG CGC CTC CGC TTG GGA TAT-3'),這些質粒分別被命名為pSKF-C/E/CE。在此基礎上將Flag、信號肽及HCV C、E和CE基因通過Sal I和Pst I及Pst I和Xba lI位點一起克隆到pFastbacDual-GFP載體的相同位點,分別命名為 pFBDeGFP-Flag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CE-GP64。然后通過Bac-to-Bac系統將pFBDeGFP-Flag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CEGP64質粒轉座到Ac-bacmid中,經PCR鑒定正確后分別命名為Ac-Flag-HCV C-GP64、Ac-Flag-HCV E-GP64和Ac-Flag-CE-GP64。在35 mm的培養皿中接種1×106的Sf9細胞,27℃培養過夜;棄去上層培養基,加入1 mL不含血清的培養液洗滌細胞2次,再加入1 mL不含血清的培養基于27℃培養0.5 h以上;在細胞室中將1~2 μg重組bacmid DNA與10 μL cellfectin分別用無血清Grace稀釋至50 μL,5 min后將DNA加入稀釋后的cellfectin中,每隔5 min輕輕混勻1次,45 min后在聚丙烯管中輕輕加入900 μL不含血清的Grace培養基,混勻。棄去35 mm培養皿中的培養基,加入含有轉染混合物的Grace培養基,28℃溫箱培養;6 h后用含10%血清的Grace培養替換原有的培養基;3 d后若觀察到GFP表達說明重組病毒包裝成功,收集細胞上清(重組病毒)保存或進行再次感染進行功能分析。
3.2 Western blotting 收集病毒感染72 h的Sf9細胞總蛋白,用SDS-PAGE上樣緩沖液裂解。煮沸10 min后進行SDS-PAGE(7.5%),用半干法將膠上蛋白轉移到硝酸纖維素膜上。封閉液(含5%脫脂奶粉的TBS)封閉1 h后,以溶解一定濃度Ⅰ抗的封閉液4℃過夜。經TBST洗脫后,以溶解一定堿性磷酸酶標記的Ⅱ抗封閉液孵育1 h,經TBST洗脫后,BCIP/NBT顯色檢測。
3.3 免疫熒光染色 在22 mm×22 mm的1.5號玻璃蓋玻片上培養細胞,用含2%多聚甲醛的 PBS(pH 7.4)溶液在20℃固定細胞15 min。用 PBS(pH 7.4)洗 3次,每次 10 min;用含0.2%Triton X-100和1%正常山羊血清(normal goat serum,NGS)的PBS溶液在冰上,透化5 min;用PBS加1%NGS洗3次,每次10 min;在蓋玻片上加30 μL稀釋的抗體,并將蓋玻片倒置在玻璃載玻片上,然后將載玻片放到濕盒里以室溫孵育1 h;用PBS加1%NGS洗3次,每次10 min;在濕盒里與稀釋為4 mg/L的Ⅱ抗,室溫孵育1 h;用PBS洗4次,每次10 min;將蓋玻片封在載玻片上。用激光共聚焦掃描顯微鏡進行觀察。
3.4 重組出芽病毒(budded virus,BV)的純化 重組病毒的BV來源于經細胞培養擴增后的培養基上清。病毒的擴增如下,在75 cm2培養瓶中按感染復數(multiplicity of infection,MOI)=0.1加入桿狀病毒的BV,25℃溫箱培養,當BV的產量達到最高峰時收集含有BV的培養液。含有病毒的培養液收集后,于1000×g離心10 min,收集上清。收集的上清于4℃、50000×g離心1 h,棄上清,沉淀溶解在PBS溶液中。然后將其加在經梯度混合儀制成的25%~56%的蔗糖梯度上,于4℃、100000×g離心2 h;在45%蔗糖濃度的部位有白色帶出現,即重組病毒BV。收集病毒帶,轉移至1個新的離心管中,用PBS稀釋10倍。稀釋后的病毒液在4℃、50000×g離心1 h,棄上清,沉淀溶解在PBS溶液中,病毒粒子經負染后,用透射電子顯微鏡(H-7000FA)鑒定純度。
3.5 免疫膠體金標記 將鎳網在純化好的BV樣品液中懸滴反應5 min;在濾紙上晾干4℃過夜;再用含5%牛血清白蛋白(bovine serium albumin,BSA)的PBS(pH 7.2)懸滴反應30 min;取出鎳網用0.1%BSA的 TBS(pH 7.4)稀釋抗體(1∶500)作用1 h;然后用 0.1%BSA 的 TBS(pH 7.4)洗滌 3次(每次5 min);再用0.1%BSA的TBS(Tris-HCl緩沖鹽溶液,pH 8.2)稀釋膠體金(1∶25)作用 1 h 后用 0.1%BSA 的TBS洗滌3次(每次5 min);最后用2%磷鎢酸(phosphotungstic acid,PTA)染色3 min,進行電鏡觀察。
3.6 間接時間分辨熒光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)檢測臨床樣本HCV IgG (1)固相包被板的制備:分別將HCV C、E、CE的重組桿狀病毒上清用包被液(50 mmol/L,pH 9.6 的碳酸鹽緩沖液)稀釋為1 mg/L,100 μL每孔加入96孔板中,于4℃過夜。棄去包被液,加入封閉液(去金屬離子的 20 g/L BSA),150 μL/well,于 37 ℃ 3 h棄去封閉液真空抽干,-20℃保存。(2)Eu3+標記鼠抗人IgG的制備與純化:將0.5 mg鼠抗人IgG加入到帶有濾膜的離心管中,以8000 r/min離心3 min。用標記緩沖液 (50 mmol/L Na2CO3,pH 9.5)重復洗滌6 次后,將250 μL 標記抗體和0.5 mg Eu3+標記試劑混勻后于4℃過夜。將標記抗體加入到Sephadex G-50層析柱(1×30 cm)中,用洗脫液洗脫。收集流出液(1 mL/tube),測定蛋白含量,合并洗脫峰的各管。(3)間接TRFIA檢測人HCV IgG程序:向包被板中加90 μL樣品稀釋液,10 μL質控血清或臨床病人血清,室溫孵育1 h。用洗滌液洗板4次,拍干。再加入1∶200稀釋的Eu3+標記鼠抗人IgG 100 μL,于室溫孵育40 min。用洗滌液洗板6次,拍干。最后加入200 μL增強液振搖5 min后由時間分辨熒光免疫分析儀檢測熒光值。
4 統計學處理
采用SPSS 13.0軟件進行分析,配對數據用McNemer檢驗。
結 果
1 重組Bacmid的構建
利用AcMNPV Bac-to-Bac系統,分別以pFBDeGFPFlag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CE-GP64質粒轉座含有輔助質粒(helper plasmid)與Ac-bacmid(AcMNPV的Bac to Bac系統)的大腸桿菌DH10B,得到重組AcMNPV bacmid:Ac-Flag-HCV C-GP64、Ac-Flag-HCV E-GP64和Ac-Flag-CE-GP64,見圖1A。利用M13F(M13上游引物)和目的基因下游引物(HCV C下游引物5'-GGG GGA TCC TGT CGT GGC GAT TGT AGC ACG AAT CCT AAA C-3';HCV E下游引物:5’-GGG CTG CAG CGC CTC TTG GGA TAT-3’)進行 PCR 鑒定:分別產生了3.3 kb、4.4 kb 和 5.0 kb 左右的帶,見圖 1B,表明目的片段插入的位置正確。將重組bacmid DNA分別轉染Sf9細胞得到重組病毒vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和 vAc-Flag-CE-GP64。同時構建vAc-bacmid-GFP作為對照病毒。
2 Western blotting檢測
分別收集重組病毒感染后的細胞,檢測目的蛋白的表達。免疫印跡顯示當用HCV C抗體檢測時,重組病毒vAc-Flag-HCV C-GP64的樣品有21 kD的特征帶,見圖2A,重組病毒vAc-Flag-CE-GP64的樣品有84 kD的特征帶出現,見圖2C。當用HCV E抗體檢測重組病毒vAc-Flag-CE-GP64的樣品時,出現63 kD的特征帶,見圖2B。在這些檢測過程中,對照病毒vAc-bacmid-GFP感染的樣品中無這些特征帶出現。Western blotting結果證明能夠在vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和vAc-Flag-CE-GP64感染的細胞中檢測到目的蛋白的表達,說明HCV C、E和CE能夠成功展示在重組病毒粒子的表面。
3 HCV C、E和CE融合蛋白在被感染sf9細胞上的定位
重組病毒 vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和vAc-Flag-CE-GP64和野生型病毒AcMNPV以10 MOI感染接種于蓋玻片上的sf9細胞,在感染后72 h觀察細胞內紅色熒光的分布情況。在對照病毒vAc-bacmid-GFP感染后的細胞內和細胞膜上均未觀察到紅色特異性熒光;而在重組病毒感染后的細胞膜上看到一圈強烈的紅色特異性熒光(代表HCV C、E和CE融合蛋白),細胞內則未出現紅色熒光,見圖3。這說明HCV C、E和CE融合蛋白最終是定位在被感染Sf9細胞的膜上,隨后在病毒粒子出芽過程中整合到病毒粒子上。
4 HCV C、E和CE融合蛋白在BV上的定位
圖4顯示,在重組病毒 vAc-Flag-HCV C-GP64(圖4B)、vAc-Flag-HCV E-GP64(圖4C)和vAc-Flag-CEGP64(圖4D)的BV上看到了大量的黑色金顆粒,對照病毒vAc-bacmid-GFP的BV上沒有(圖4A)。這表明HCV C、E和CE融合蛋白展示在BV囊膜上。
5 間接TRFIA檢測人HCV IgG
收集溫州醫學院第二附屬醫院丙型肝炎患者血清106例,分別以間接ELISA和間接TRFIA檢測人HCV IgG。TRFIA檢測時,分組如下:TRFIA(C):包被HCV C重組桿狀病毒;TRFIA(E):包被HCV E重組桿狀病毒;TRFIA(C+E):包被HCV C重組桿狀病毒和HCV E重組桿狀病毒;TRFIA(CE):包被HCV CE重組桿狀病毒。
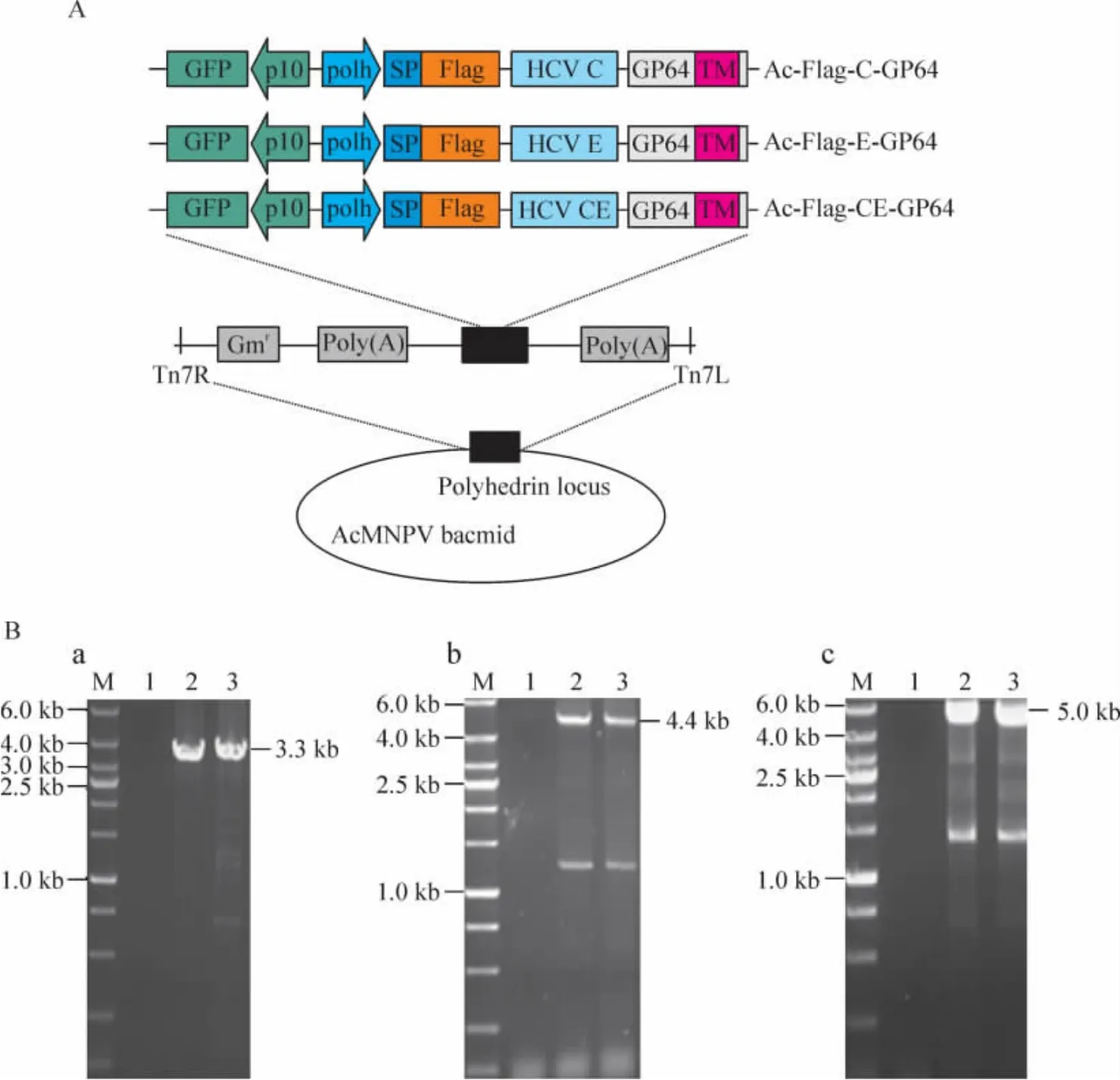
Figure1.Construction of the recombinant bacmids.A:the strategy for insertion of the gene cassettes into the polyhedrin locus of the Ac-MNPV bacmid.FLAG-HCV C,E or CE was fused with AcMNPV GP64 protein after the signal peptide(SP).The cassettes depicted were inserted into the attB site(indicated by right and left insertion sites,Tn7R and Tn7L)in the polyhedrin locus by Tn-based transposition and generated the recombinant bacmids,Ac-Flag-C-GP64,Ac-Flag-E-GP64 and Ac-Flag-CE-GP64.B:identification of recombinant bacmids by PCR.a:Ac-Flag-C-GP64(using M13 forward primer and HCV C reverse primer).1:negative control;2,3:Ac-Flag-C-GP64.b:Ac-Flag-E-GP64(using M13 forward primer and HCV E reverse primer).1:negative control;2,3:Ac-Flag-E-GP64.c:Ac-Flag-CE-GP64(using M13 forward primer and HCV E reverse primer).1:negative control;2,3:Ac-Flag-CE-GP64.圖1 重組病毒的構建

Figure2.Expression of fusion proteins in Sf9 cells infected with recombinant viruses was detected by Western blotting.M:protein marker;1:negative control(vAc-bacmid-GFP);2:vAc-Flag-C-GP64(A),vAc-Flag-E-GP64(B)or vAc-Flag-CE-GP64(C).圖2 重組病毒蛋白在Sf9細胞中的表達
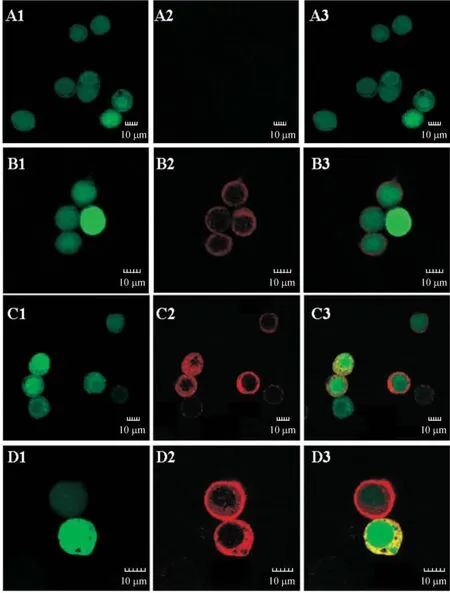
Figure3.Immunofluorescence analysis of HCV C,E and CE expression in infected Sf9 cells using an anti-HCV core monoclonal antibody.Sf9 cells were infected with vAc-bacmid-GFP(A),vAc-Flag-C-GP64(B),vAc-Flag-E-GP64(C)and vAc-Flag-CE-GP64(D)at multiplicity of infection(MOI)of 10 and were examined under confocal microscope.1:green fluorescent(GFP);2:red fluorescent(Cy3 - labeled HCV C,E or CE);3:merged images.圖3 HCV C,E和CE融合蛋白在感染的Sf9細胞中的分布
ELISA檢測丙型肝炎患者HCV抗體的陽性率為84.0%(89/106);TRFIA(C)和TRFIA(E)檢測陽性率分別為58.5%(62/106)、53.8%(57/106),與 ELISA 檢測具有統計學差異。TRFIA(C+E)和TRFIA(CE)檢測陽性率分別為78.3%(83/106)和80.2%(85/106),與ELISA檢測結果無統計學差異,見表1。
TRFIA和ELISA檢測HCV抗體的靈敏度比較:將HCV抗體陽性質控血清以 PBS 溶液進行 1(未稀釋)、2、4、8、16、32、64、128 倍稀釋,以 ELISA 和 TRFIA(C)、TRFIA(E)、TRFIA(C+E)和TRFIA(CE)進行檢測。TRFIA(C+E)和TRFIA(CE)的檢測敏感性高于ELISA,TRFIA(C)檢測敏感性和ELISA基本相同,TRFIA(E)的檢測敏感性略低于ELISA,見表2。
討 論
丙型肝炎是一種流行較為廣泛的病毒性疾病。據估計,全球有1.7億人口,即全世界人口的3%左右感染了HCV(世界衛生組織,1999年)。而且,每年有300~400萬新發病例。在HCV感染者中,實際上僅有20%的患者被診斷出丙型肝炎。HCV慢性感染可導致肝臟慢性炎癥壞死和纖維化,部分患者可發展為肝硬化甚至 HCC[10]。因此加強對HCV的檢測具有十分重要的意義。但是由于感染HCV后血中抗體(抗-HCV)出現時間晚,從HCV感染后到抗體轉陽的時間平均為50~70 d,有的患者可延長至6~9個月,檢測的“窗口期”較長。對于抗-HCV的檢測,C和E蛋白被認為能有效提高抗-HCV的靈敏度[11-12]。因此在HCV檢測中,加強和擴大對HCV不同編碼區的抗體檢測,它直接關系到檢測技術的準確率和應用率。
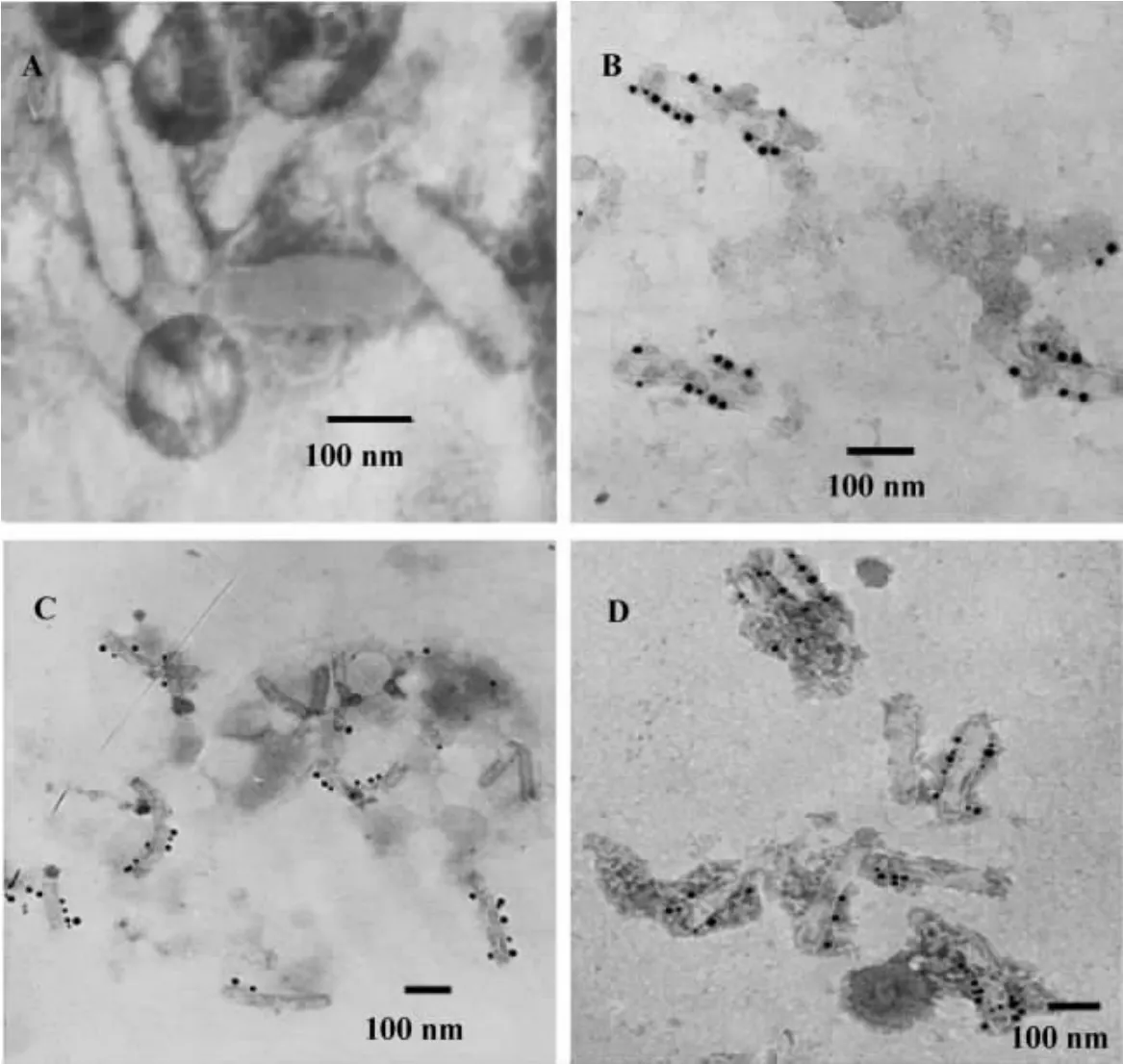
Figure4.Electron micrograph of immunogold-labeled purified vAc-bacmid-GFP(A),vAc-Flag-C-GP64(B),vAc-Flag-E-GP64(C)and vAc-Flag-CE-GP64(D)BVs.BVs were probed using anti-HCV core antibody counterstained with gold spheres coupled to anti-mouse IgG.圖4 免疫膠體金檢測HCV C,E和CE在BV上的定位
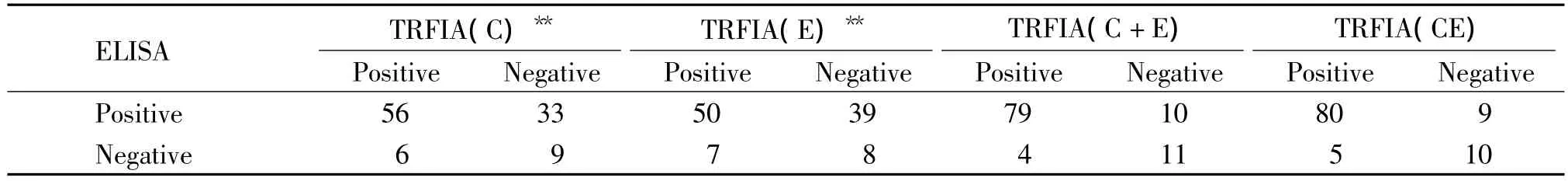
表1 丙型肝炎患者血清的TRFIA和ELISA檢測結果Table1.Results of serum of patients with HCV detected by TRFIA and ELISA(n=106)

表2 TRFIA和ELISA檢測的靈敏度比較Table2.Comparison of the sensitivity between TRFIA and ELISA
桿狀病毒展示系統具有許多優點,能夠通過在病毒基因組上直接克隆展示片段或在感染昆蟲細胞表面表達以及在病毒顆粒表面表達來展示抗原產生抗體及進行疫苗相關研究展示復雜有活性的蛋白[13-14]。由于桿狀病毒展示表面展示系統的優點,使其在高親和力抗體及多肽藥物的篩選、蛋白質抗原表位分析、新受體及天然配體結合結構域的識別和鑒定、藥物(激動劑和多肽藥物)篩選、設計和制備、重組疫苗的建立、酶的固定化和再生等方面具有廣闊的應用前景[11-12,15]。
為了提高HCV的檢測率,本實驗通過桿狀病毒表面展示系統構建了HCV C、E和CE融合蛋白的重組病毒。通過Western blotting檢測發現在重組病毒感染的細胞中有HCV C、E和CE蛋白的存在(圖2);同時免疫熒光染色結果表明HCV C、E和CE融合蛋白定位在被感染Sf9細胞的膜上(圖3)。進一步,免疫膠體金技術將HCV C、E和CE融合蛋白定位于BV的囊膜上(圖4),表明成功地將HCV C、E和CE融合蛋白展示在病毒的表面。對重組病毒濃縮后,建立時間分辨熒光免疫技術檢測HCV抗體的方法,與ELISA進行比較,包被有2種蛋白的TRFIA(C+E)和TRFIA(CE)的檢測敏感性高于ELISA,而只包被一種蛋白的TRFIA(C)或TRFIA(E)檢測敏感性和ELISA基本相同。用HCV臨床樣本進行檢測,結果顯示單獨包被HCV C重組病毒或HCV E重組病毒的TRFIA檢測陽性率明顯低于ELISA檢測,這是由于ELISA試劑盒的微孔板上包被了更多的HCV特異性蛋白,提高了HCV抗體的檢出率;包被HCV CE重組病毒時TRFIA檢測陽性率為80.2%,明顯高于單獨包被HCV C和HCV E重組病毒的TRFIA檢測,接近目前使用的ELISA檢測試劑盒。我們擬通過改進濃縮純化的方法和工藝,進一步提高丙型肝炎的診斷敏感性,為HCV抗體檢測帶來新的希望。
[1]陳朝霞,閔保華,陳延平.影響HCV-RNA熒光定量PCR檢測的因素及其對策[J].國際檢驗醫學雜志,2007,28(2):175-176.
[2]謝 立,吳曉東.丙型肝炎病毒檢測方法的研究進展及其臨床意義[J].世界華人消化雜志,2005,13(7):884-886.
[3]魏葆珺,李金明.丙型肝炎病毒感染篩檢中抗原表位的應用及其研究進展[J].中華肝臟病雜志,2006,14(12):955-957.
[4]邵圣文,武文斌,于建國,等.丙型肝炎病毒F蛋白抗原性及患者血清F抗體流行率的研究[J].中華肝臟病雜志,2006,14(12):890-893.
[5]Grabherr R,Ernst W,Oker- Blom C,et al.Developments in the use of baculoviruses for the surface display of complex eukaryotic proteins [J]. Trends Biotechnol,2001,19(6):231-236.
[6]Kaba SA,Hemmes JC,van Lent JW,et al.Baculovirus surface display of Theileria parva p67 antigen preserves the conformation of sporozoite - neutralizing epitopes[J].Protein Eng,2003,16(1):73-78.
[7]Ernst WJ,Spenger A,Toellner L,et al.Expanding baculovirus surface display.Modification of the native coat pro-tein gp64 of Autographa californica NPV[J].Eur J Biochem,2000,267(13):4033-4039.
[8]Rahman MM,Gopinathan KP.Bombyx mori nucleopolyhedrovirus-based surface display system for recombinant proteins[J].J Gen Virol,2003,84(Pt 8):2023 -2031.
[9]Boublik Y,Di Bonito P,Jones IM.Eukaryotic virus display:engineering the major surface glycoprotein of the Autographa californica nuclear polyhedrosis virus(AcNPV)for the presentation of foreign proteins on the virus surface[J].Biotechnology(N Y),1995,13(10):1079 -1084.
[10]王齊欣,魏 來,高 燕,等.丙型肝炎病毒感染自然過程中的準種變化[J].中華傳染病雜志,2004,22(5):323-324.
[11]Oker-Blom C,Airenne KJ,Grabherr R.Baculovirus display strategies:Emerging tools for eukaryotic libraries and gene delivery[J].Brief Funct Genomic Proteomic,2003,2(3):244-253.
[12]Riikonen R,Matilainen H,Rajala N,et al.Functional display of an α2integrin - specific motif(RKK)on the surface of baculovirus particles[J].Technol Cancer Res Treat,2005,4(4):437 -445.
[13]Konig M,Lengsfeld T,Pauly T,et al.Classical swine fever virus:independent induction of protective immunity by two structural glycoproteins[J].J Virol,1995,69(10):6479-6486.
[14]van Zijl M,Wensvoort G,de Kluyver E,et al.Live attenuated pseudorabies virus expressing envelope glycoprotein E1 of hogcholera virus protects swine against both pseudorabies and hogcholera[J].J Virol,1991,65(5):2761 -2765.
[15]Ribeiro BM,Gatti CD,Costa MH,et al.Construction of a recombinant Anticarsia gemmatalis nucleopolyhedrovirus(AgMNPV -2D)harbouring the β - galactosidase gene[J].Arch Virol,2001,146(7):1355 -1367.

