基于直列式交錯微電極陣列的細胞電融合*
鄭小林,鄢佳文,胡 寧,楊 軍,楊 靜
(1.重慶大學生物工程學院,重慶 400030;2.重慶通信學院軍事信息工程系,重慶 400035)
0 引言
細胞電融合利用強電場誘導2個或者多個細胞通過無性方式融合[1]。融合子包含來自不同親代細胞的遺傳物質,從而表現出新的遺傳特性。該方法有助于培養新的物種、品系或細胞工程產品。相對于生物誘導和化學誘導等傳統技術,細胞電融合效率較高、操作簡便、對細胞無毒害、便于觀察、適于儀器應用和規范操作[2,3],因此,這種融合也被廣泛應用[4]。
傳統細胞電融合中的電融合槽盡管加工簡便,體積較大,一次可操作毫升級樣本,但電極間距較大(2~10 mm),需要幾百甚至上千伏電壓才足以產生103 V/cm量級的電場強度使細胞穿孔并融合[5],這增加了信號源的制造難度與成本。而且,電融合槽中常選用平板電極[6],電極間會形成大范圍的均勻電場。這一方面不利于細胞的精確控制,導致細胞通常以長鏈狀排隊;另一方面,長鏈上各細胞間結合點的電場強度相同,電融合的幾率也相當,從而產生大量難以后期應用的多細胞融合子。
微流控技術可以通過減小電極間間距,在低電壓條件下實現強電場。這為細胞電融合技術向微型化、低電壓及低功耗方向發展奠定了基礎[7~9]。本文在前期研究基礎上,利用COMSOL Multiphysics軟件對芯片結構進行了仿真研究,特別分析了微電極陣列結構參數對電場強度與分布的影響。在此基礎上獲得一種優化的電極結構,并利用SoI硅片加工制作。實驗研究表明:在不超過20 V的電壓驅動下,芯片可以高效地實現細胞排隊、電穿孔及融合。
1 芯片結構仿真與設計
微通道內的電場強度與分布對細胞電融合有重要影響,而它又直接取決于微電極的結構與排布。前期研究表明,交錯式微電極陣列有利于提高電融合效率,因此,本文建立了這種結構模型(圖1),并重點討論了電極的結構參數(微電極長度l,微電極寬度w,相對微電極間間距dy,相鄰微電極間間距dx)對電場強度及其分布的影響。同時,由于前期研究中在微通道轉角處存在細胞堵塞問題,本文設計了直列式微通道結構,以期在這方面有所改進。
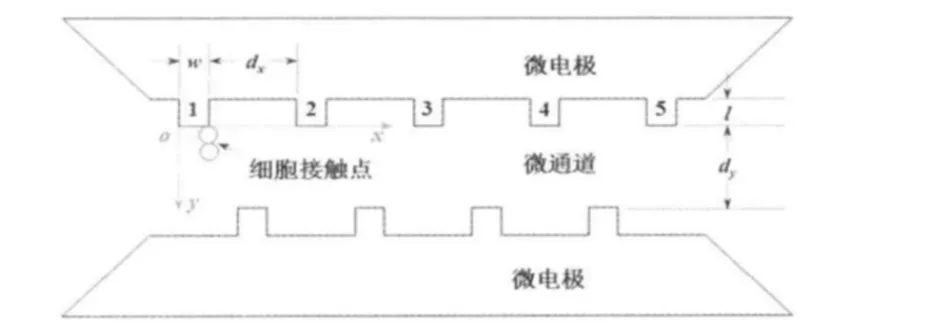
圖1 交錯式微電極陣列結構模型Fig 1 Interdigital microelectrodes array model
根據前期研究建立初始模型,l=20 μm,w=20 μm,dy=60 μm,dx=60μm。實驗中,緩沖液電阻率為4 ×104Ω·m,電極電阻率為0.1 Ω· m。加載10 V的電信號后,得到微通道內部電場分布,如圖2(b)。隨后改變上述4個參數,研究對電場強度的影響。
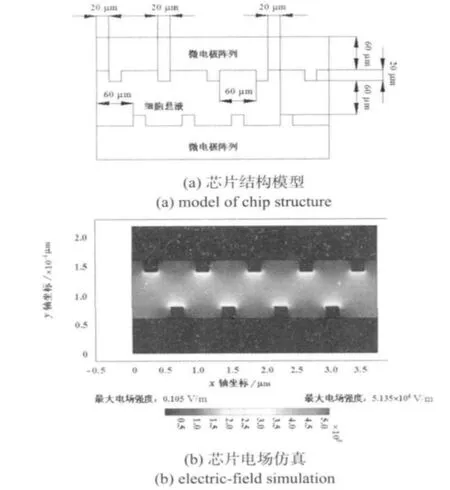
圖2 芯片模型與仿真Fig 2 Chip model and electric-field simulation
1.1 微電極長度l對電場強度的影響
仿真研究中,l從5~30 μm,以5 μm為間距變化。選取距離模型中2,3,4號微電極(圖1)5 μm的位置進行采樣分析,獲得了電場強度分布曲線(圖3(a))。隨著電極長度l的增加,電場強度分布曲線的峰值也隨之增加,當l增加到20μm后,峰值的增加就不再顯著。而兩電極之間區域的電場強度隨著l的增加而降低,表明電場分布的非均勻度增加了。因此,電極長度的增加有利于提高電極間的電場強度,也有利于提高電場分布的非均勻度。但是,l的增加將增大低電場區域的面積(該區域介電電泳力較小,無法驅動細胞),將造成更多的細胞落于該區域而無法參與排隊及電融合。因此,電極長度的選擇需要折中。考慮到l>20 μm后,電場的非均勻變化不顯著這一特點,在設計電極時,選擇l=20 μm。
1.2 微電極寬度w對電場強度的影響
微電極寬度的影響主要體現在:寬度越小,微電極高能量區域越集中,相應地最大電場強度也越大。同樣位置的采樣分析表明,當寬度w從10 μm增加到30 μm時,電場強度極大值從 2.03×105V/m降低到 1.74×105V/m(圖3(b))。隨著w的增加,其下降的速度逐漸減緩。因此,在設計微電極時可盡量減小電極寬度,進而可在較低的驅動電壓下完成細胞電融合。但是,過窄的電極不利于細胞的穩定吸附。因此,實驗中選擇20 μm寬的電極。
1.3 相對微電極間間距dy對電場強度的影響
當相對電極間間距dy自50 μm 變化至100 μm(10 μm增量)時,不同間距條件下電場分布類似,電場強度最大值Emax隨著dy的增加而減小(圖3(c))。考慮到盡量在每個微電極上排列一對細胞,故在芯片設計中,應該在保證電極間距大于4個細胞直徑之和的前提下,盡量減小相對電極間間距。
1.4 相鄰微電極間間距dx對電場強度的影響
在電極大小固定的情況下,電極間距縮小到一定程度后,相鄰電極間電場會產生相互干擾,進而對溝道內部電場分布產生影響。當相鄰電極間距dx自20 μm變化至80 μm(10μm增量)時,隨著dx的增大,兩相鄰電極間的干擾逐漸減小。采樣點處的電場強度也隨之增大,特別是2,3,4號微電極位置的電場強度從1.70×105V/m增加到1.92×105V/m(圖3(d))。當dx≥50μm時,dx增大對于最大電場強度的增加無顯著影響。結合不同dx條件下的電場分布,可以認為dx=50 μm 是一個變化閾值,只要dx≥50 μm,相鄰電極間的干擾可忽略不計。
2 芯片的加工與封裝
在仿真獲得的直列式交錯微電極陣列優化結構參數(l=20 μm,w=20 μm,dy=60 μm,dx=60 μm)基礎上,利用SoI硅片[10]加工了實驗芯片。
2.1 芯片材料的選擇
SoI硅片的底層硅將為芯片提供有效的機械支撐;SiO2絕緣層將為頂層硅(微電極陣列)層提供良好的電絕緣特性;頂層低阻硅將用于構造微電極陣列結構,同時,微電極陣列也將形成微通道的側壁。此外,雖然SoI硅片的底層硅經過離子注入提高了電導率(0.1 Ω/m),但為保證良好的電導性,在低阻硅上還覆蓋了一層鋁導電層。最后,為了保證芯片在電場及緩沖液浸泡下的可靠性與穩定性,選用SiO2在鋁導電層表面形成一層保護層,提高芯片的抗氧化、抗腐蝕能力。
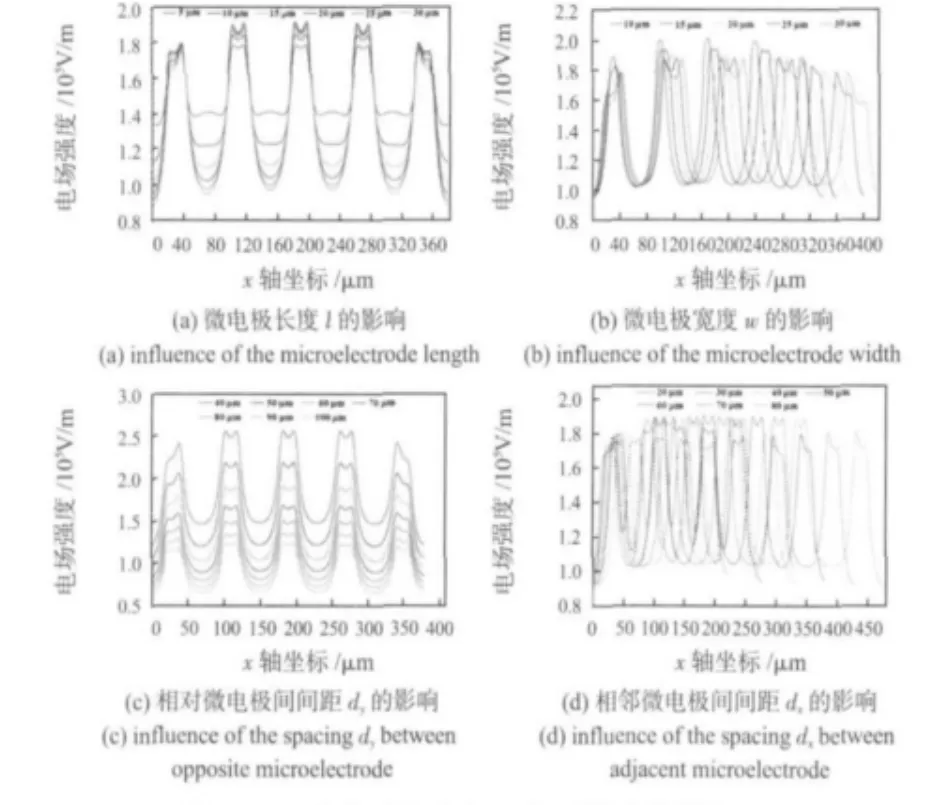
圖3 芯片的結構參數對電場強度的影響Fig 3 Influence of the chip structure parameters on the electric-field intensity
2.2 芯片的加工
采用光刻與干法蝕刻加工芯片,具體流程為:磁控濺射在SoI硅片的頂層低阻硅表面形成一層2 μm厚的鋁膜;通過光刻/腐蝕工藝刻蝕鋁膜,形成一層與微電極陣列對應的鋁引線層,它將大大降低微電極陣列的電阻率,避免因自身電阻帶來的電壓降問題,保證各微電極區域電場強度的一致性;采用PECVD工藝在鋁膜表面形成一層厚度為500 nm的SiO2絕緣膜,SiO2良好的抗氧化、抗腐蝕性能,有助于保護鋁引線層,提高芯片的穩定性和可靠性;通過干法刻蝕SiO2絕緣膜,形成與微電極陣列一致的SiO2絕緣層;以SiO2絕緣層為掩模,使用干法刻蝕頂層低阻硅,形成微電極陣列與微通道結構。
2.3 芯片的封裝
利用金屬管殼封裝加工好的芯片裸片(圖4(a)),微電極陣列的引線點和管殼的連接點采用φ=75 μm的金絲實現電氣連接(圖4(b))。實驗前,用PDMS對金絲進行絕緣與保護處理。同時,制備一塊與芯片大小相對應的PDMS蓋片,在對應微通道進、出樣口的區域打孔(φ=1 mm)用于樣本液進出芯片。

圖4 細胞電融合芯片Fig 4 Cell-electrofusion chip
3 細胞排隊、融合實驗
3.1 實驗流程
將實驗對象細胞離心后,利用PM緩沖液清洗3次,加入少量PM緩沖液將細胞調整到4×106/mL;隨后利用微量注射器將細胞懸浮液經導管注入微通道中;加載排隊信號(正弦信號,頻率 1 MHz,Vp~p=3 V);30 s后加載電壓脈沖信號[11](方波脈沖信號,脈寬為 50 μs,脈沖間隔為 1 s,V=9~15 V);然后加載低強度的排隊信號,維持細胞緊密接觸以提高融合效率。
3.2 排隊實驗結果
當加載排隊信號后,交錯式齒狀微電極陣列結構所形成的非均勻電場將產生一定的電場梯度。這種條件下,細胞可以看著一個電介質小球,會受到介電電泳力[12]的作用。由于PM緩沖液的離子濃度低于細胞內液離子濃度,因此,細胞將受到正向介電電泳力的作用,向高強度電場(靠近微電極)區域運動,在微電極上吸附并排列成細胞珠串。通過電壓控制,大部分細胞能形成兩兩排隊(圖5)。

圖5 HEK293細胞排隊Fig 5 Cell alignment of the HEK293
3.3 融合實驗結果
當加載低壓脈沖信號后,在強電場作用下,兩細胞的連接處會發生可逆性電穿孔。在持續加載的低強度排隊信號作用下,介電電泳力將保持兩細胞緊密接觸,進而使電穿孔區域的細胞膜發生重構,建立連接通道,兩細胞的胞內物質發生交換,最終形成一個完整的融合子(圖6)。

圖6 融合信號加載后不同時間點HEK293細胞的融合情況Fig 6 Fusion of the HEK293 at different time scales after pulses loading
4 結論
在前期研究基礎上,仿真研究了微電極陣列幾何參數與電場強度的關系。結果表明:微電極長度、寬度、相鄰及相對電極間距非常重要。同時,設計了直列式微通道結構,避免了轉角處的細胞堆積問題。利用SoI硅片加工了細胞電融合芯片,通過濺射鋁引線層和增加SiO2絕緣層處理分別提高了芯片的電導性和抗氧化、抗腐蝕能力,保證了芯片內部電場分布的一致性和芯片的可靠性。實驗結果表明:芯片能夠以較高效率形成兩兩排隊。借助于微電極間較短的間距,能夠在低壓電脈沖下形成高強度電場,并成功誘導細胞電融合。該方法融合效率較高,可以達到35%。
[1]夏 斌,楊 軍,胡 寧,等.基于MEMS細胞電融合芯片的設計與實驗研究[J].傳感器與微系統,2009,28(2):45 -47.
[2]Cowan C A,Atienza J,Melton D A,et al.Nuclear reprogramming of somatic cells after fusion with human embryonic stem cells[J].Science,2005,5739(309):1369 -1373.
[3]Ambrosi D J,Tanasijevic B,Kaur A,et al.Genome-wide reprogramming in hybrids of somatic cells and embryonic stem cells[J].Stem Cells,2007,25(5):1104 -1113.
[4]Cao Y,Yang J,Yin Z Q,et al.Electric field simulation of highthroughput cell electrofusion chip[J].Chinese Journal of Analytical Chemistry,2008,36(5):593 -598.
[5]Zmimermann U.Electric field mediated fusion and related electrical phenomena[J].Biochimica et Biophysica Acta,1982,694(3):227-277.
[6]汪和睦,謝廷棟.細胞電穿孔電融合電刺激原理技術及應用[M].天津:科學技術出版社,2000.
[7]Wang J,Lu C.Microfluidic cell fusion under continuous direct current voltage[J].Applied Physical Letters,2006,89:234102.
[8]Skelley A M,Kirak O,Suh H,et al.Microfluidic control of cell pairing and fusion[J].Nature Methods,2009,6(2):147 - 152.
[9]Techaumnat B,Tsuda K,Kurosawa O.Micro-scale instruments applied to a bovine nuclear transfer system[J].IET Nano-biotechnology,2008,2(4):93 -99.
[10]曹 毅,楊 軍,胡 寧,等.高通量細胞電融合芯片研究進展[J].傳感器與微系統,2009,28(3):1 -7.
[11]Cao Y,Yang J,Yin Z Q,et al.Study of high-throughput cell electrofusion in a microelectrode-array chip[J].Microfluidics &Nanofluidics,2008,5(5):669 -675.
[12]陳 興,崔大付,劉長春,等.用于細胞破裂的微流控生物芯片的研制[J].分析化學,2006,34(11):1656 -1660.

