兩種擬南芥MYB51突變體的鑒定與初步分析
李夢莎,石 璐,國 靜
(東北林業大學鹽堿地生物資源環境研究中心,東北油田鹽堿植被恢復與重建教育部重點實驗室,哈爾濱 150040)
芥子油苷又稱硫代葡萄糖苷(Glucosinolate,GS),是一類含氮、含硫的植物次生代謝產物。芥子油苷及其降解產物具有多種生化活性,其在植物防御方面的作用已經引起人們的廣泛關注。根據氨基酸來源的不同,芥子油苷通常分為脂肪族、芳香族和吲哚族三大類[1-5]。
對植物芥子油苷代謝調控的研究發現,多個R2R3-MYB家族轉錄因子成員對芥子油苷合成具有直接調控作用。ATR1/MYB34、HIG1/MYB51和HIG2/MYB122為吲哚族芥子油苷合成途徑中的正向調控因子,其中,MYB34和MYB122調節吲哚族芥子油苷和吲哚乙酸(IAA)代謝之間的平衡[6-8],而MYB51(AT1G18570)特異地調控吲哚族芥子油苷合成及與其相關的初生代謝途徑[9-11]。盡管MYB51在吲哚族芥子油苷合成調控中的作用已有報道,但對其介導的吲哚族芥子油苷環境調控機制了解的并不透徹。為深入分析MYB51在環境因子調控吲哚族芥子油苷合成過程中的作用,本研究組從擬南芥生物資源中心(Arabidopsis Biological Resource Center,ABRC,Ohio State University,USA)購 買AT1G18570的兩種T-DNA插入突變體SALK_045103和SALK_059771,分別通過基因型分析篩選得到了純合突變體。進一步利用半定量RT-PCR及高效液相色譜方法對其在轉錄水平及代謝水平進行了檢測,結果顯示,兩種突變體中MYB51基因的表達水平與野生型相比顯著下調,且受其調控的吲哚族芥子油苷含量與野生型相比也顯著降低,表明由于T-DNA的插入,致使SALK_045103和SALK_059771純合突變體中MYB51轉錄因子的功能顯著降低,表明這兩種純合突變體均可作為功能缺失突變體用于分析MYB51的功能。該研究為進一步分析MYB51轉錄因子在環境因子調控擬南芥吲哚族芥子油苷合成過程中的作用奠定了材料基礎。
1 材料與方法
1.1 植物材料及生長條件
野生型擬南芥(Arabidopsis thaliana)為Columbia-0(Col-0)型,AT1G18570的T-DNA插入突變株SALK_045103和SALK_059771的種子購自ABRC。種子經75%酒精消毒10 min后,用無菌水沖洗3~5次,并于4℃避光條件下處理3 d后逐粒播于盛有草炭土與蛭石混合物(體積比1∶2)的花盆中,在人工培養室中培養(溫度19~23℃,人工光照8 L/16 D,光子通量密度約150 μmol·m-2·s-1,空氣相對濕度50%~70%)。
1.2 基因組DNA的提取
總DNA的提取方法參照陳慶山等的方法進行[12]。當植株生長至6周時,從待檢植株上剪取1片綠葉,用液氮處理并研磨成粉末,加入500 μL CTAB提取液;65℃水浴30 min后加入500 μL氯仿∶異戊醇(24∶1);離心,上清液中加入500 μL異丙醇,混勻,靜置10 min;4℃離心,沉淀真空吸干后加入30 μL滅菌ddH2O(含RNase A),37℃處理30 min,-20℃保存備用。
1.3 純合突變體的鑒定
參照李敏等的方法[13],以所提取植株的基因組DNA為模板,進行PCR擴增。PCR所用引物出自SIAGnAL(http://signal.salk.Edu/isectprimers.html),引物分別為LBb1.3:5'ATTTTGCCGATTTCGGAAC 3';SALK_045103-LP:5'AAAGGGGGTTGTTCTCAAGT G 3';SALK_045103-RP:5'CATGGAAACGTACCT TTGTGG 3';SALK_059771-LP:5'AAATTTTGGTC AAGAATCGGG 3';SALK_059771-RP:5'AAAGGG GGTTGTTCTCAAGTG 3'。
1.4 半定量RT-PCR
總RNA的提取參照譚麗麗等的方法進行[14]。使用DNAase(TaKaRa Inc.)對RNA中所含痕量基因組DNA進行消化。使用NanoDrop 1000型(Nano-Drop Technologies Inc.)分光光度計檢測RNA純度及濃度。按照Transcriptor First Strand cDNA synthesis kit(TaKaRa Inc.)試劑盒說明書合成cDNA第一鏈,去離子水稀釋10倍作為半定量RT-PCR的模板。
按照TAIR數據庫(Eurogentec,Seraing,Belgium)提供的基因序列,使用Primer 5.0軟件設計MYB51基因的特異引物。引物序列分別為MYB51-LP:5'CTACAAGTGTTTCCGTTGACTCTGAA 3'和MYB51-RP:5'ACGAAATTATCGCAGTACATTAGA GGA 3';以ACTIN基因作為內參,其引物序列分別為:ACTIN-LP:5'ATTCAGATGCCCAGAAGTCT TGTTCC 3'和ACTIN-RP:5'ACCACCGATCCAGAC ACTGTACTTCC 3'。引物由上海生工有限公司合成。
半定量RT-PCR反應參照董曉麗等的方法[15]。擴增ACTIN的PCR反應程序為:94℃預變性3 min;94℃20 s,55℃30 s,72℃30 s,24個循環,每個樣品做3個重復;MYB51基因的PCR反應程序為:94℃預變性3 min;94℃ 20 s,55℃ 30 s,72℃30 s,30個循環,每個樣品做3個重復。擴增產物用1.0%瓊脂糖凝膠電泳進行分析。
1.5 芥子油苷的提取及測定
芥子油苷提取及測定按照Pang等的方法[16]。
2 結果與分析
2.1 T-DNA插入純合突變體的鑒定
根據 TAIR(http://www.arabidopsis.org/)提供的信息,SALK_045103為反向插入突變體,SALK_059771為正向插入突變體,T-DNA插入位點均為MYB51基因起始密碼子上游1 000 bp的啟動子內(見圖1)。
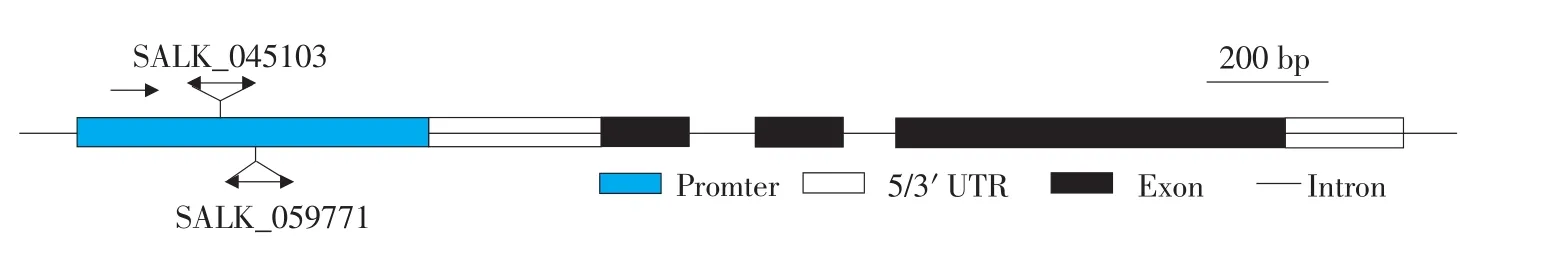
圖1 擬南芥MYB51基因結構及其突變體示意Fig.1 MYB51 gene structure and mutants sketch map of Arabidopsis thaliana
使用SIAGnAL(http://signal.salk.edu/tdnaprimers.2.html)提供的SALK_045103和SALK_059771突變體的前向引物SALK_045103-LP和SALK_059771-LP及反向引物SALK_045103-RP和SALK_059771-RP,以候選植株的基因組DNA為模板,進行PCR鑒定。若植株為野生型植株,因無T-DNA插入,用前向引物和反向引物可擴增出1 000 bp左右的特異DNA片段;若植株為純合體,由于T-DNA的插入,前向引物和反向引物之間的片斷長度遠遠超過當前PCR條件下的PCR擴增長度,無法擴增出DNA片段,而用T-DNA左邊界引物LBb1.3與基因反向引物進行PCR擴增,則能擴增出約500 bp的DNA片段;若植株為雜合體,用基因前向引物和反向引物進行PCR擴增,能夠擴增出約1 000 bp的DNA片段,同時,用T-DNA左邊界引物與基因反向引物進行PCR擴增,也能夠擴增出約500 bp的DNA片段。
圖2所示為突變體SALK_045103的PCR鑒定結果。結果顯示,3號植株用基因前向引物和反向引物擴增出約1 000 bp的DNA條帶,而T-DNA左邊界引物LBb1.3與基因反向引物未擴增出DNA帶,這與野生型植株基因組DNA的PCR帶型一致,表明3號植株中沒有T-DNA插入。1、2、4、5號植株用T-DNA左邊界引物LBb1.3與基因反向引物擴增出約500 bp的DNA條帶,而基因前向引物和反向引物未擴增出DNA條帶,表明1、2、4、5號植株為純合突變體。篩選出的純合突變體分別留種、繁種備用。
圖3所示為突變體SALK_059771的PCR鑒定結果。結果表明,5號植株用基因前向引物和反向引物擴增出約1 000 bp的DNA條帶,同時T-DNA左邊界引物LBb1.3與基因反向引物擴增出500 bp的DNA條帶,表明5號植株為雜合突變體。1、2、3、4號植株用T-DNA左邊界引物LBb1.3與基因反向引物擴增出500 bp的DNA條帶,而基因前向引物和反向引物未擴增出DNA條帶,表明1、2、3、4號植株為純合突變體。篩選出的純合突變體分別留種、繁種備用。
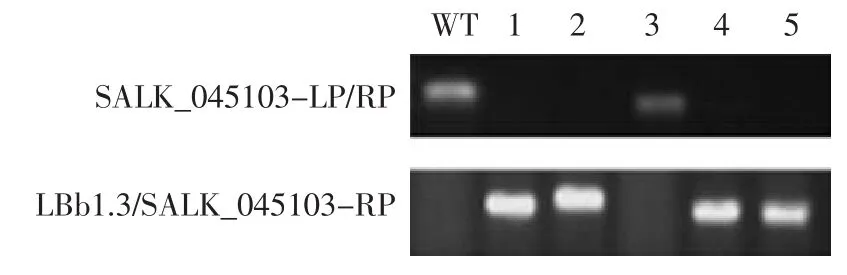
圖2 SALK_045103突變體PCR鑒定電泳檢測Fig.2 Electrophoresis results of SALK_045103 mutants via PCR detection

圖3 SALK_059771突變體PCR鑒定電泳檢測Fig.3 Electrophoresis results of SALK_059771 mutants via PCR detection
2.2 純合突變體中MYB51基因的表達
基因啟動子中T-DNA插入往往會導致基因表達水平下調甚至不表達[17]。利用半定量RT-PCR技術對上述純合突變體后代植株蓮座葉中MYB51基因的表達量進行了分析。
如圖4所示,兩種突變體與野生型擬南芥植株中均檢測到了MYB51基因的表達,但與野生型相比,兩種突變體植株中MYB51基因表達水平顯著降低,表明T-DNA的插入導致SALK_045103和SALK_059771純合突變體中MYB51基因的表達量顯著下調。
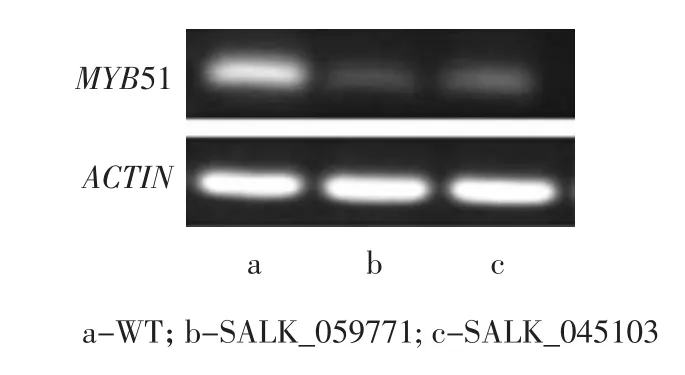
圖4 MYB51基因表達的RT-PCR分析Fig.4 MYB51 gene expression by RT-PCR
2.3 突變體中芥子油苷的組成及含量
擬南芥SALK_045103和SALK_059771純合突變體蓮座葉中共檢測出9種芥子油苷,其中脂肪族芥子油苷5種,包括3-甲基亞磺酰丙基芥子油苷(3-methylsulphinylp ropyl glucosinolate,3MSOP)、4-甲基亞磺酰丁基芥子油苷(4-methylsulphinyl-butyl glucosinolate,4MSOB)、5-甲基亞磺酰戊基芥子油苷(5-methylsulphinylpentyl glucosinolate,5MSOP)、6-甲基亞磺酰己基芥子油苷(6-methylsulphinylhexyl glucosinolate,6MSOH)和8-甲基亞磺酰辛基芥子油苷(8-methyl-sulphinyloctyl glucosinolate,8MSOO);吲哚族芥子油苷4種,包括:4-羥基吲哚基-3-甲基芥子油苷(4-ydroxyin-dol-3-ylmethyl glucosinolate,4OH-I3M)、吲哚基-3-甲基芥子油苷(Indol-3-ylmethyl glucosinolate,I3M)、4-甲氧吲哚基-3-甲基芥子油苷(4-methoxyindol-3-ylmethyl glucosinolate,4MT-I3M)和1-甲氧吲哚基-3-甲基芥子油苷(1-Methoxyindol-3-ylmethylglucosinolate,1MT-I3M),未檢測到芳香族芥子油苷。這與野生型擬南芥蓮座葉中芥子油苷組分一致。表明SALK_045103和SALK_059771純合突變體蓮座葉中芥子油苷的組成未發生變化。
對SALK_045103和SALK_059771純合突變體蓮座葉中芥子油苷的含量進行分析表明,兩種突變體中總芥子油苷含量和脂肪族芥子油苷總量與野生型相比變化均不顯著,而吲哚族芥子油苷總量與野生型相比顯著降低,其中,SALK_059771純合突變體蓮座葉中吲哚族芥子油苷總量與SALK_045103純合突變體相比降低幅度更大(見圖5)。進一步對兩種純合突變體中四種吲哚族芥子油苷組分的含量進行了分析。表明,I3M、1MT-I3M和4MT-I3M三種組分含量均顯著低于野生型中的含量。如圖6所示,除4OHI3M以外,幾種吲哚族芥子油苷的含量在突變體中都有明顯的下降。表明SALK_045103和SALK_059771純合突變體中由于MYB51基因的突變導致吲哚族芥子油苷的生物合成受到影響。

圖5 擬南芥蓮座葉中吲哚族芥子油苷總量Fig.5 Content of total indolic gluconsinolates in Arabidopsis thaliana rosette leaves
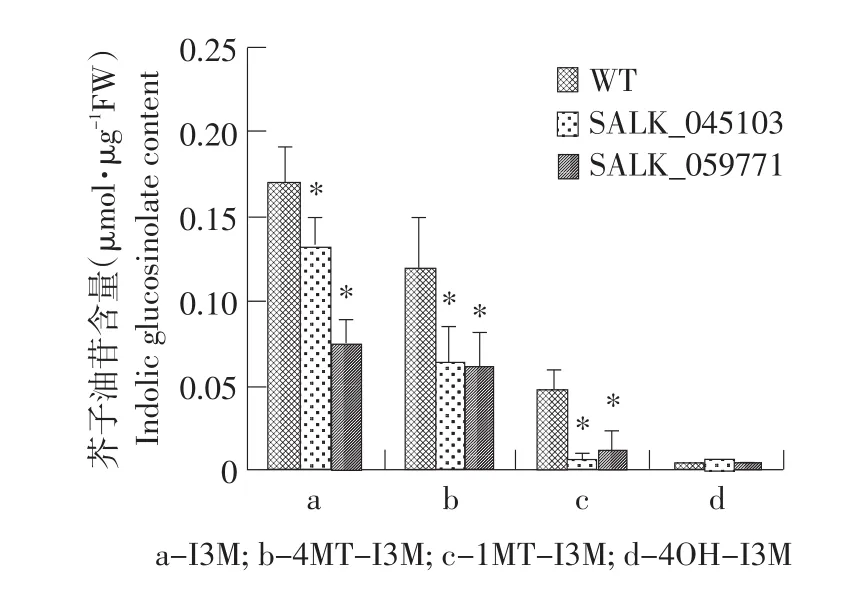
圖6 擬南芥蓮座葉中吲哚族芥子油苷各組分含量Fig.6 Content of indolic glucosinolates in Arabidopsis thaliana rosette leaves
3 討論
擬南芥作為模式植物,被國內外學者廣泛應用于各種基因功能的研究[18]。為深入研究MYB51轉錄因子介導的吲哚族芥子油苷環境調控機制,本研究鑒定獲得了擬南芥MYB51的兩種T-DNA插入純合突變體SALK_045103和SALK_059771。通過半定量RT-PCR技術對兩種突變體中MYB51基因的表達進行了初步分析,結果顯示,盡管兩種純合突變體中MYB51基因的表達與野生型相比均顯著降低,但T-DNA的插入并沒有使MYB51基因表達量完全消失(見圖4),這可能與T-DNA在MYB51基因啟動子上的插入位置有關,兩種突變體中TDNA均插入到MYB51基因起始密碼子上游1 000 bp的啟動子內(見圖1),該位置可能位于MYB51核心啟動子的上游,使這兩種突變體中MYB51基因核心啟動子完整存在,從而導致MYB51的泄露表達。這表明在這兩種純合突變體中,MYB51轉錄因子的功能可能并未完全缺失。由于MYB51為吲哚族芥子油苷生物合成的正向調控因子,其功能的缺失會導致吲哚族芥子油苷含量下降,因此,只有當SALK_045103和SALK_059771純合突變體中吲哚族芥子油苷的含量顯著低于野生型植株中的含量,才可用于后續基因功能分析。高效液相色譜分析結果顯示,SALK_045103和SALK_059771純合突變體中吲哚族芥子油苷的含量與野生型相比均顯著下降,且SALK_059771純合突變體中吲哚族芥子油苷總量的下降幅度大于SALK_045103純合突變體(見圖5),這與半定量RT-PCR的結果SALK_059771純合突變體中MYB51基因表達量低于SALK_045103純合突變體一致(見圖4),進一步表明吲哚族芥子油苷含量的降低是由于MYB51的表達受T-DNA插入影響造成的。因此,SALK_045103和SALK_059771純合突變體可作為MYB51的功能缺失突變體進行后續基因功能研究。
4 結論
本研究篩選獲得了擬南芥MYB51的T-DNA純合突變體SALK_045103和SALK_059771。半定量RT-PCR及高效液相色譜分析結果顯示兩種突變體中MYB51基因的表達顯著下調且吲哚族芥子油苷的生物合成受到影響,暗示SALK_045103和SALK_059771可作為MYB51的功能缺失突變體進行后續基因功能研究。
[1]陳亞州,閻秀峰.芥子油苷在植物-生物環境關系中的作用[J].生態學報,2007,27(6):2584-2593.
[2]陳亞州,陳思學,閻秀峰.環境對植物芥子油苷代謝的影響[J].生態學報,2008,28(6):2828-2834.
[3]Yan X,Chen S.Regulation of plant glucosinolate metabolism[J].Planta,2007,226:1343-1352.
[4]Halkier B A,Gershenzon J.Biology and biochemistry of glucosinolates[J].Plant Biology,2006,57:303-333.
[5]Kliebenstein D J,Kroymann J,Mitchell-Olds T.The glucosinolatemyrosinase system in an ecological and evolutionary context[J].Plant Biology,2005(8):264-271.
[6]Smolen G,Bender J.Arabidopsis cytochrome P450 cyp83B1 mutations activate the tryptophan biosynthetic pathway[J].Genetics,2002,160:323-332.
[7]Celenza J L,Quiel J A,Smolen G A,et al.The Arabidopsis ATR1 Myb transcription factor controls indolic glucosinolate homeostasis[J].Plant Physiology,2005,137:253-262.
[8]李一蒙,陳亞州,閻秀峰.植物中的吲哚族芥子油苷與生長素代謝途徑的關系[J].植物生理學通訊,2009,45(2):195-201.
[9]Gigolashvili T,Berger B,Mock H P,et al.The transcription factor HIG1/MYB51 regulates indolic glucosinolate biosynthesis in Arabidopsis thaliana[J].Plant Journal,2007,50:886-901.
[10]Malitsky S,Blum E,Less H,et al.The transcript and metabolite networks affected by the two clades of Arabidopsis glucosinolate biosynthesis regulators[J].Plant Physiology,2008,148:2021-2049.
[11]Bender J,Celenza J L.Indolic glucosinolates at the crossroads of tryptophan metabolism[J].Phytochemistry Reviews,8:25-37.
[12]陳慶山,劉春燕,呂東,等.大豆DNA提取基本原理的探討[J].東北農業大學學報,2004,35(2):129-134.
[13]李敏,楊雙,阮燕曄,等.擬南芥T-DNA插入突變體atsuc3的PCR鑒定[J].植物生理學通訊,2006,42(1):91-94.
[14]譚麗麗,燕正民,徐亞英,等.番茄葉片總RNA提取方法的比較[J].東北農業大學學報,2010,41(4):29-32.
[15]董曉麗,王加啟,卜登攀,等.免疫刺激后小鼠肝臟內參基因穩定性研究[J].東北農業大學學報,2009,40(5):80-85.
[16]Pang Q,Chen S,Li L,et al.Characterization of glucosinolatemyrosinase system in developing salt stress Thellungiella halophila[J].Physiologia Plantarum,2009,136(1):1-9.
[17]周玉萍,陳瓊華,林麗麗,等.擬南芥突變體lac8-2和lac8-3的鑒定[J].廣州大學學報,2009,8(6):87-90.
[18]鐘海秀,陳亞州,閻秀峰.植物芥子油苷代謝及其轉移[J].生物技術通報,2007(3):44-48.

