酸牦牛乳中乳酸菌降膽固醇作用及膽鹽耐受性研究
焦月華,張蘭威,易華西,張莉麗,馬 微
(1.哈爾濱工業大學食品科學與工程學院,哈爾濱 150090;2.黑龍江中醫藥大學藥物安全性評價中心,哈爾濱 150040;3.黑龍江出入境檢驗檢疫局,哈爾濱 150001)
膽固醇是人體不可缺少的營養成分,但膽固醇過高或過低都會影響人的身體健康,尤其是高膽固醇,是引發人腦血管疾病的主要危險因子之一。目前研究表明,一些人體內乳酸菌及來自發酵食品的乳酸菌具有降膽固醇功能[1-3]。張佳程、薄金嶺、呂兵等分別研究了一些乳酸菌可降低食物中膽固醇含量[4-6],并從不同的食品中篩選出一些具有較好降膽固醇作用的菌株。Pereira研究了分離自人體腸道中的乳酸菌和雙歧桿菌的膽固醇同化能力[1]。El-Gawad用飼喂高脂飼料的大鼠證實了酸奶和發酵豆奶中的雙歧桿菌的對膽固醇血癥的作用[2]。在這些研究中,乳桿菌和雙歧桿菌表現出了明顯的降低膽固醇的能力。前人在乳酸菌降膽固醇的研究方面做了大量工作,以期獲得優良適合作為益生菌的菌株。因此,本研究以分離于甘肅的酸牦牛奶中的23株乳酸菌為研究對象,擬對不同菌株的體外同化膽固醇效果進行測定,以期篩選出具有較好降膽固醇特性的益生菌菌株應用于實踐。
1 材料與方法
1.1 材料與設備
1.1.1 菌種
23株供試乳酸菌從采樣于甘肅牧民家庭制作的酸牦牛奶中分離得到;嗜酸乳桿菌(Ac)由科漢森發酵劑分離得到,本實驗室保存。
1.1.2 試劑與培養基
牛膽汁(OXGALL)、膽酸、牛磺脫氧膽酸鈉(TDCA)、甘膽酸鈉(TCA)(SIGMA 公司)、膽固醇,所用試劑均為分析純或優級純。所用培養基均是按照凌代文等的方法配制[7]。
膽固醇濃縮液[8]:N,N-二甲基甲酰胺10 mL,0.5 mL吐溫80,膽固醇0.5 g,充分混合后121℃滅菌20 min。
膽固醇標準液[9]:用正己烷定容配制1 mg·mL-1的膽固醇標準液。
鄰苯二甲醛冰醋酸溶液(0.5 g·L-1)[10]:0.250 g鄰苯二甲醛,用冰醋酸定容于500 mL的容量瓶中,使用當天配制。
1.1.3 主要儀器設備
TGL-16LG高速冷凍離心機(湖南星科),756PC型紫外可見分光光度計(上海光譜),DHP9272電熱恒溫培養箱(上海一恒),pH計(德國賽多利斯PB-10),厭氧培養箱(美國THERMO Forma 1029),超凈工作臺(蘇州安泰SW-CJ-IFO)。
1.2 方法
1.2.1 菌株的培養
乳酸菌在傳代培養、活化后,用MRST[11]液體培養基37℃培養20 h。
1.2.2 乳酸菌菌株去除膽固醇的實驗
將已滅菌的膽固醇濃縮液分別加入MRST培養基和MRST-O(MRST培養基中添加0.3%的牛膽汁)培養基使其濃度達到100 μg·mL-1,1%接種目的菌,37℃培養20 h。然后將菌液在4℃,5 200×g條件下離心10 min[11]。取1.0 mL上清液,用鄰苯二甲醛法測定膽固醇的量[12],根據標準曲線計算樣品中膽固醇含量。
膽固醇同化量[10(]mg·g-1)=
C1、C2分別是0 h時和20 h時的膽固醇含量(mg);
W1、W2分別是0 h時和20 h時的菌體干重(g)。
1.2.3 死亡菌體的降膽固醇試驗
菌株經MRST培養基37℃培養20 h后于1 000×g,4℃離心10 min。滅菌水洗滌2次,用5 mL滅菌水懸浮,121℃滅菌15 min,制備熱致死菌體。將熱致死菌體加入到含有0.3%(W/V)牛膽汁和膽固醇的培養基中。同時,對熱致死菌體進行平板計數,以確定滅菌效果。37℃培養20 h后,測量培養液中膽固醇的含量[13]:
A=100-[100-(B/C)×100]
其中,A-膽固醇降低率(%);
B-接種目的菌的培養液中膽固醇含量(mg);
C-沒有接種目的菌的培養液中的膽固醇含量(mg)。
1.2.4 膽鹽水解活性的測定
用滅菌的濾紙片沾取培養過夜的受試菌株(1×108~1×109cfu·mL-1)加入到添加 0.5%TDCA(W/V)和0.37 g·L-1CaCl2的固體培養基中,37℃厭氧培養72 h,有沉淀區形成則認為有膽鹽水解活性(BSH陽性)[14]。用不加TDCA的培養基作對照,每株菌重復3次。
1.2.5 膽鹽耐受性
參照文獻[10]的方法,使用三種形式的膽鹽:牛膽汁、膽酸、甘膽酸鈉來測試各菌株的膽鹽耐受性。
1.2.6 統計與分析
采用SPSS11.0軟件ANOVA對試驗數據進行方差分析,差異顯著性比較,平均數用LSD進行多重比較。
2 結果與分析
2.1 膽固醇含量與吸光值關系曲線
膽固醇含量與吸光值關系結果見圖1。
得到一元回歸方程:y=0.1946x+0.0016(R2=0.9994)
其中,y代表膽固醇含量,x代表吸光值,R2=0.9994線性關系良好,說明該方法有著較高的準確度,適合用來測定膽固醇的含量。

圖1 膽固醇含量標準曲線Fig.1 Standard curve about the amount of cholesterol
2.2 牛膽汁對菌株降低膽固醇的影響
在不同pH條件下,所用牛膽汁對培養基中膽固醇的含量影響(見表1)不顯著(P>0.05),說明培養基中加入的牛膽汁所含的游離的膽酸鹽含量極低或者不含有游離膽酸,培養基中的膽固醇并沒有在酸性條件下與游離膽酸共沉淀。該結論說明下述試驗中膽固醇減少的量是由于菌株同化作用,而非pH影響。
表1 不同pH對培養基中膽固醇含量的影響(±S,n=3)Table 1 Effect of pH on the content of cholesterol in media

表1 不同pH對培養基中膽固醇含量的影響(±S,n=3)Table 1 Effect of pH on the content of cholesterol in media
注:中同列數據肩注標有相同字母者表示差異不顯著(P>0.05)。Note:Means with the same superscripts in the same column differ insig nificantly(P>0.05).
MRSTO-C培養基MRSTO-C media pH4.5 pH6.0膽固醇含量(μg)Content of cholesterol 98.94±1.45a 99.56±2.04a
由酸牦牛乳中分離的23株乳酸菌以及嗜酸乳桿菌(Ac)培養20 h后同化膽固醇的量見表2。
結果表明,所有的菌株都具有一定降低膽固醇的能力,每克菌體干重減少的膽固醇量在0.58~10.537 mg。在23株菌中,除832在兩種培養基中同化膽固醇量差異不大外,J9、I10、H11、E16、L18、67、271和AC這8株菌在添加牛膽汁時同化膽固醇量高于未添加牛膽汁的對照組,其余14株菌則與此相反。一般來說,適當增加膽鹽濃度可以提高菌體細胞壁的通透性,使固醇類物質滲入細胞內部,引起環境中膽固醇濃度下降;而膽鹽濃度過高,則抑制細菌的生長,不利于菌體細胞對膽固醇的吸收[1]。Liong等的研究中11株嗜酸乳桿菌和干酪乳桿菌在0.3%存在時8株菌同化膽固醇的量高于對照組,只有3株菌對照組中的量較高[10]。
Dora對19株菌培養12 h后,除Lactobacillus crispatus ATCC 33820和Enterococcus durans ATCC 59607沒有在培養基中生長外[11],其他菌株每克菌體干重對膽固醇的同化量為0.09~29.73 mg,大多數在添加0.4%牛膽汁的培養基中培養的菌株同化膽固醇得量高于對照組。
上述兩個結論均是多數菌在添加牛膽汁培養基中在同化膽固醇量高于對照組,在本研究中卻表現為少數菌,是因為牛膽汁對菌株降低膽固醇的影響具有菌株特異性。特異性可能與菌種來源、生長條件有關,此次試驗所用菌種并非來源于人體腸道(膽鹽水平為0.3%~0.5%),也沒有經過牛膽汁的馴化,故0.3%牛膽汁對多數受試菌的生長有較大影響。
通過顯著性分析可知,W2在兩種培養基中沒克菌體干重同化膽固醇的量分別為10.537和9.460 mg,都顯著高于其他菌株,在不加牛膽汁的培養基中,每克菌體干重降膽固醇能力強弱依次:W2>H1>J2>G17>H11>A6>M12>E5>67>AC,在加牛膽汁的培養基中,每克菌體干重降膽固醇能力強弱依次:W2>AC>H11>271>67>J2>A6>J9>E16>411>I10。
2.3 死亡菌體的降膽固醇作用
為了探究死亡的菌體細胞是否具有同化膽固醇的能力,熱致死菌體與正常菌體細胞對膽固醇的同化率對比見圖2。
表2 不同菌株降膽固醇能力及牛膽汁對其影響(±SD,n=3)Table 2 Cholesterol removal ability of different strains and the the effect of oxgall on it

表2 不同菌株降膽固醇能力及牛膽汁對其影響(±SD,n=3)Table 2 Cholesterol removal ability of different strains and the the effect of oxgall on it
注:#為0 h與20 h時MRST培養基中生長的菌體干重之差(g)。※為20 h時受試菌上清液在550 nm波長處的吸光值與不接種的空白培養基吸光值之差。△將※中的值代入方程y=0.196x+0.0016計算降低的膽固醇量(mg)。★同一列標注不同字母表示差異顯著(P<0.05)。note:#indicates the differential dry weight of the strain grown for 0 h and 20 h in MRST media.※indicates the difference value of OD550 is the result value of the subtraction of the media without innoculant from the supernate of the strains grown for 20 h.△indicates the results come from the equation y=0.196x+0.0016 when※ instead of x.★ means with different superscripts in succession differ significantly(P<0.05).
測定值(MRST)Measured value 測定值(MRSTO)Measured value 菌體同化膽固醇結果★(mg·g-1)Results of cholesterol removal菌株Strains MRST MRSTO H1 J2 F3 E4 E5 A6 C7 J9 I10 H11 M12 N13 B14 D15 E16 G17 L18 67 271 411 832 Q9 W2 AC菌體干重增量#(g)Increased dry weight 0.0045 0.0026 0.0090 0.0066 0.0035 0.0032 0.0124 0.0102 0.0076 0.0019 0.0088 0.0057 0.0066 0.0031 0.0150 0.0039 0.0119 0.0024 0.0024 0.0028 0.0066 0.0074 0.0086 0.0118 OD550增量※Increased value of OD550-0.070-0.032-0.047-0.002-0.015-0.024-0.047-0.041-0.032-0.015-0.055-0.013-0.010-0.011-0.064-0.047-0.004-0.007-0.004-0.025-0.024-0.016-0.147-0.064同化膽固醇量△(mg)Content of cholesterol assimilation 0.0457 0.0235 0.0322 0.0060 0.0136 0.0188 0.0322 0.0287 0.0235 0.0136 0.0369 0.0124 0.0106 0.0112 0.0422 0.0322 0.0071 0.0089 0.0071 0.0194 0.0188 0.0141 0.0906 0.0422菌體干重增重#(g)Increased dry weight 0.0087 0.0028 0.0028 0.0133 0.0033 0.0021 0.0116 0.0067 0.0049 0.0028 0.0161 0.0090 0.0144 0.0069 0.0089 0.0032 0.016 0.0019 0.0022 0.0125 0.0055 0.0089 0.006 0.0031 OD550增量※Increased value of OD550-0.032-0.027-0.003-0.005-0.002-0.009-0.009-0.045-0.023-0.034-0.013-0.02-0.009-0.023-0.062-0.006-0.050-0.020-0.024-0.084-0.019-0.002-0.089-0.041同化膽固醇量△(mg)Content of cholesterol assimilation 0.0235 0.0206 0.0066 0.0077 0.0060 0.0101 0.0101 0.0311 0.0182 0.0246 0.0124 0.0165 0.0101 0.0182 0.0410 0.0083 0.0340 0.0165 0.0188 0.0538 0.0159 0.0060 0.0568 0.0287 10.148±0.741a 9.031±0.093b 3.582±0.270fg 0.904±0.088k 3.873±0.231f 5.879±1.156e 2.600±0.354ghi 2.810±0.059 ghi 3.090±1.163 hi 7.135±0.216d 4.194±0.208f 2.174±0.231i 1.612±0.079j 3.620±0.085fg 2.811±0.078hi 8.266±1.095c 0.600±0.141k 3.703±0.073fg 2.973±1.090 ghi 6.927±0.100d 2.850±1.090hi 1.911±0.073i 10.537±2.514a 3.573±0.149fg 2.699±0.213d 7.344±0.597b 2.340±1.170d 0.580±0.014e 1.808±1.076de 4.788±1.221c 0.867±0.139e 4.637±1.071c 3.720±0.673c 8.803±1.380ae 0.770±0.120e 1.831±0.305de 0.698±0.069e 2.642±1.182d 4.606±1.349c 2.595±1.074d 2.124±1.441de 8.672±2.172b 8.551±1.304b 4.307±0.288c 2.889±0.135c 0.671±0.091e 9.460±1.170a 9.270±1.309a
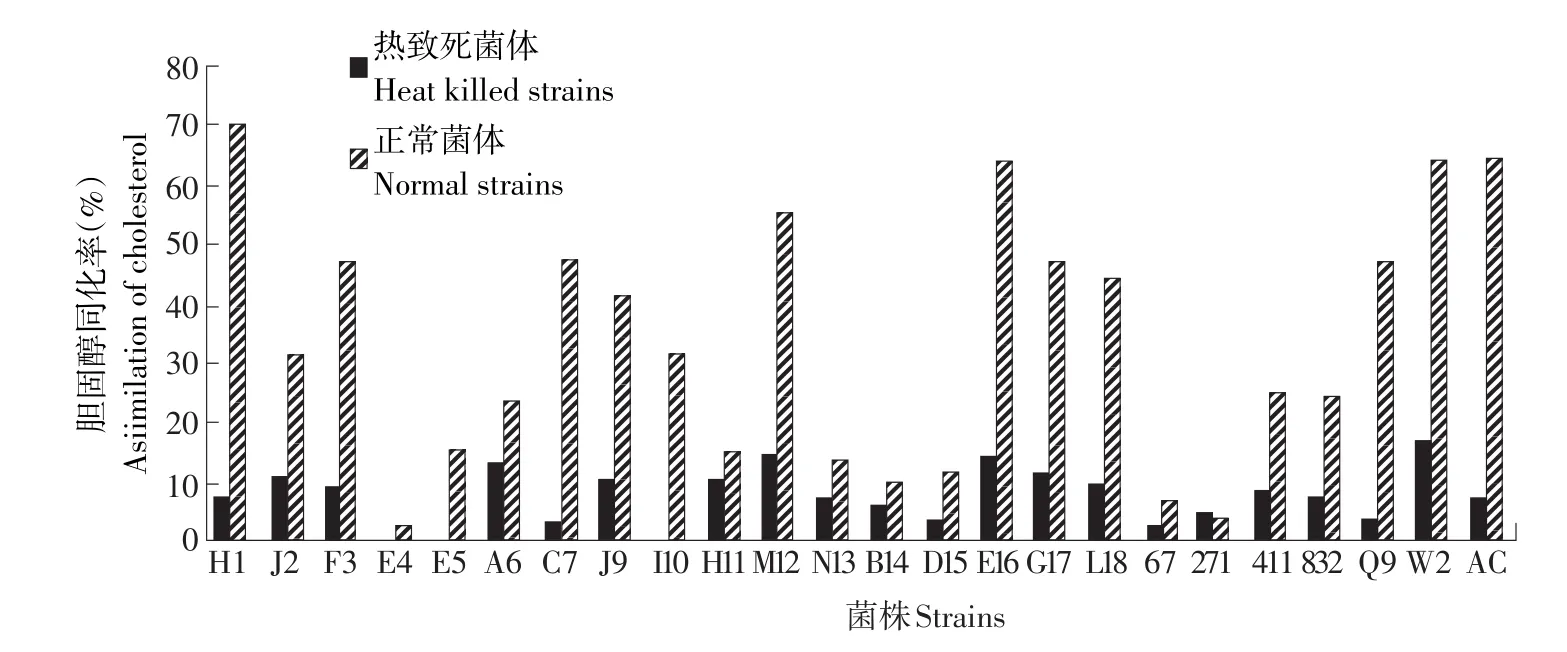
圖2 熱致死菌體對膽固醇的同化能力Fig.2 Cholesterol assimilation of strains heat killed
通過平板計數,證實菌株在121℃15 min高壓滅菌后,已全部死亡。熱致死菌體對膽固醇的同化率在0.3%~17.1%之間,正常菌體細胞對膽固醇的同化率在2%~70%范圍內,乳酸菌的活菌對同化膽固醇的能力顯著強于熱致死菌體,Liong[10]及Kimoto等的試驗表明乳酸菌的活菌體同化的膽固醇的能力顯著高于熱致死菌體及休眠菌體[14],與本試驗結果一致,說明菌體可以代謝膽固醇[15],菌體細胞對膽固醇的同化吸收在膽固醇的去除中起主要作用。
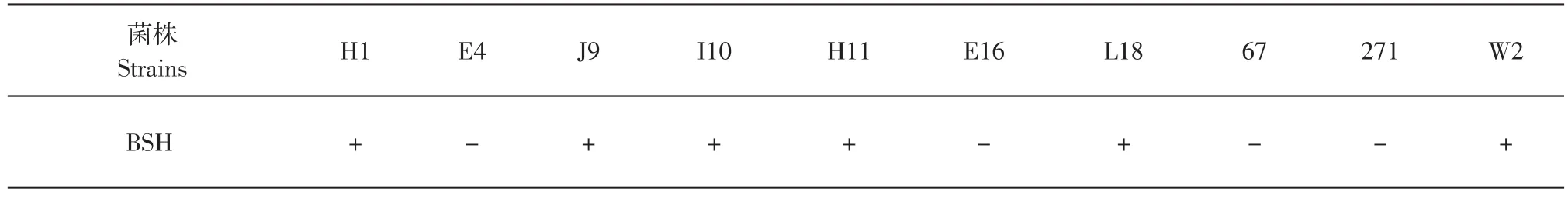
表3 不同菌株的膽鹽水解活性Table 3 Bile salt hydrolase activity of different strains
2.4 膽鹽水解酶活性與膽鹽耐受性
綜合考慮菌種同化膽固醇的能力及對抑制腸道病原菌的抑制效果(數據未列出)我們選擇H1、H11、E16、L18、W2、E4、J9、I10、67和271進行膽鹽水解酶活性試驗及膽鹽耐受性試驗。膽鹽水解酶活性是膽固醇降低的關鍵因素。乳酸菌產生的膽鹽水解酶(Bile salt hydrolase,BSH)可以使結合態膽酸(鹽)分解為游離膽酸。膽鹽經水解后溶解度下降,從而致使膽固醇也一同沉淀下來(因膽固醇的溶解度取決于膽鹽的溶解度);膽鹽水解酶作用后產生的解離態的膽酸在大腸內不被重復吸收而由糞便排出,膽酸的排出導致其在腸肝系統循環次數減少,從而增加了膽酸的生物合成。添加0.5%(W/V)牛磺脫氧膽酸鈉(TDCA)和0.37 g·L-1CaCl2的固體培養基上測試這10株菌的BSH活性,其中H1、J9、I10、H11、L18和W2菌的紙片周圍產生了明顯的沉淀圈,證明其BSH陽性。但是,沉淀圈直徑均小于15 mm,說明其酶活性較低。
牛膽汁、膽酸、TCA對受試菌生長的影響結果見表4。
表4 不同菌株對不同膽鹽的耐受性的影響(±S,n=2)Table 4 Effect of different bile salt tolerance on different strains
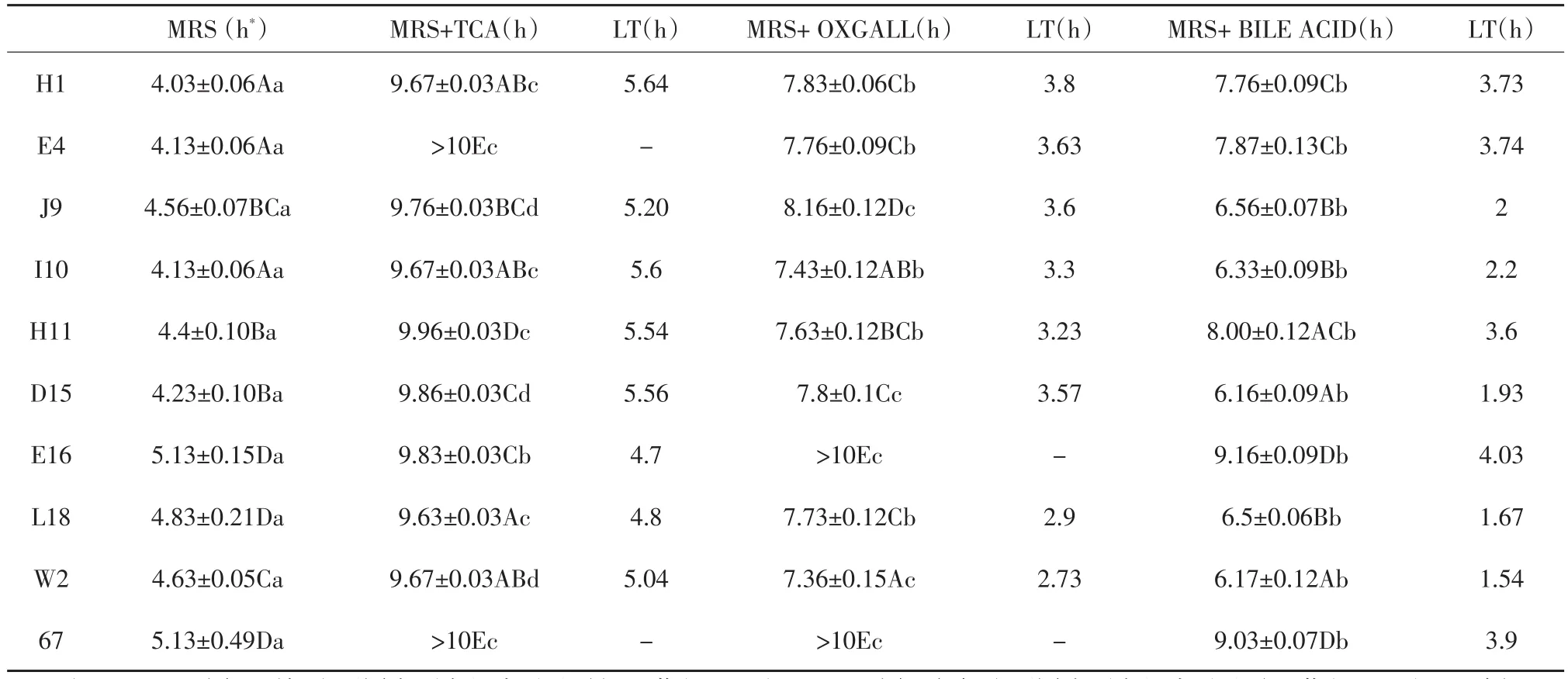
表4 不同菌株對不同膽鹽的耐受性的影響(±S,n=2)Table 4 Effect of different bile salt tolerance on different strains
注:ABCD:同一列標注不同大寫字母表示差異極顯著(P<0.01);abcd:同一行標注不同小寫字母表示差異顯著(P<0.05);*波長620 nm吸光值增長0.3的單位所用的時間(h)。Note:ABCD Means in the same row followed by different lowercase letters are significant extremely difference(P<0.01);abcd Means in the same column followed by different uppercase letters are significantly different(P<0.05);*Time(h)required to increase by 0.3 absorbance units at 620 nm in each medium.
H1 E4 J9 I10 H11 D15 E16 L18 W2 67 MRS(h*)4.03±0.06Aa 4.13±0.06Aa 4.56±0.07BCa 4.13±0.06Aa 4.4±0.10Ba 4.23±0.10Ba 5.13±0.15Da 4.83±0.21Da 4.63±0.05Ca 5.13±0.49Da MRS+TCA(h)9.67±0.03ABc>10Ec 9.76±0.03BCd 9.67±0.03ABc 9.96±0.03Dc 9.86±0.03Cd 9.83±0.03Cb 9.63±0.03Ac 9.67±0.03ABd>10Ec LT(h)5.64-5.20 5.6 5.54 5.56 4.7 4.8 5.04-MRS+OXGALL(h)7.83±0.06Cb 7.76±0.09Cb 8.16±0.12Dc 7.43±0.12ABb 7.63±0.12BCb 7.8±0.1Cc>10Ec 7.73±0.12Cb 7.36±0.15Ac>10Ec LT(h)3.8 3.63 3.6 3.3 3.23 3.57-2.9 2.73-MRS+BILE ACID(h)7.76±0.09Cb 7.87±0.13Cb 6.56±0.07Bb 6.33±0.09Bb 8.00±0.12ACb 6.16±0.09Ab 9.16±0.09Db 6.5±0.06Bb 6.17±0.12Ab 9.03±0.07Db LT(h)3.73 3.74 2 2.2 3.6 1.93 4.03 1.67 1.54 3.9
培養基中添加各膽酸鹽后,測量觀察各培養基pH隨培養時間的變化。pH降低最多的是在添加牛膽汁培養基中培養的W2(1.16)。盡管添加膽酸的一組初始pH最低,但是pH降低的平均值最大的一組是添加牛膽汁組(4.76),添加TCA的一組pH降低的最少(2.88)。這些發現表明,添加不同膽酸鹽的培養基的初始pH對隨后的菌種的生長、膽鹽耐受性及與pH相關的膽鹽抑制效果的影響是很小的。所有菌種在不含膽酸鹽的培養基中生長的更好;相對于含牛膽汁的培養基,大多數菌種在含膽酸的培養基中生長的更快一些,在含TCA的培養基中生長的更慢一些。
在對0.3%的膽酸,0.3%的牛膽汁及0.3%的牛磺膽酸鈉的耐受能力比較分析得出,各種形式的膽酸鹽均對乳酸菌的生長有抑制作用,抑制順序由強到弱依次為:TCA>BILE ACID>OXGALL。
由表4中各菌種的延時時間(LT)可見,E16和L18耐TCA能力最強,E4和67對TCA更為敏感;對牛膽汁的耐受性則是W2、L18較強,E16和67較弱;對膽酸而言,不同菌株對膽酸的耐受性差異很大,延時時間在1.54(W2)~4.03(E16)之間變化。膽鹽耐受力是益生菌的重要特征之一,其耐受力高低意味著該菌株在腸道中的存活能力的強弱。而通過比較表4和表1發現,菌株對膽鹽的耐受能力與降低膽固醇能力沒有直接相關性。綜合對比表1、3和4,篩選出具有較好益生特性的菌株H1、I10和W2。
3 討論
本研究證實了牛膽汁的確能夠促進乳酸菌對膽固醇的降解率[1],但是也有部分菌株在不添加牛膽汁的的情況下也能降低膽固醇,這可能與細菌產胞外多糖的能力有關,因為Tok等發現L.delbrueckiissp Bulgaricus降低培養基中的膽固醇的能力與細菌產胞外多糖的能力成正相關[16]。他們推測培養基中膽固醇的減少可能是由細菌的胞外多糖對培養基中的膽固醇產生了黏附。
另外本研究還發現很多菌株的活體細胞比熱致死細胞降低膽固醇的能力更強,與Liong[10]及Kimoto等[14]的結論一致,這說明細菌除了可以通過共沉淀方式脫除培養基中的膽固醇外,同化吸收發揮了更為重要的作用,同化吸收中細胞壁的吸附作用、細胞膜的吸收作用、細胞質的積累作用還是以上三種方式的共同起作用還有待進一步的研究。
目前,心腦血管疾病已成為我國居民死亡了主要因素[17],而高血清膽固醇水平是造成心腦血管疾病的重要因素之一,因此具有降膽固醇功能的益生菌也就制劑將越來越受到人們的青睞。因此本研究通過科學的實驗方法,篩選出在體外具有膽鹽耐受性的降解膽固醇特性的潛在益生菌株,在進行進一步研究后將有選擇的用于生產實踐,造福人類,從而發揮它們良好的發酵特性和益生作用。
4 結論
經過研究發現活的菌體細胞對膽固醇的同化吸收在降低膽固醇中起主要作用。菌株的耐膽鹽能力與降低膽固醇能力沒有直接相關性。通過對降膽固醇、BSH及對各種膽鹽的耐受性綜合比較選出H1、I10、W2三株菌,可以作為降低人體血清膽固醇水平的候選菌株,應用于發酵食品或其他微生態制劑。
[1]Pereira D I A,Gibson G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Appl Enviro Microbiol,2002,68:4689-4693.
[2]El-Gawad I.A.A.et al.The hypocholesterolaemic effect of milk yoghurt and soy-yoghurt containing bifidobacteria in rats fed on a cholesterol-enriched diet[J].International Dairy Journal,2005,15:37-44.
[3]王欣,劉飛,霍貴成.傳統乳制品中嗜酸乳桿菌的生理特性研究[J].東北農業大學學報,2008,39(9):87-92.
[4]張佳程,駱承庠.乳酸菌對食品中膽固醇脫除作用的研究-乳酸菌菌種(株)的篩選[J].食品科學,1998,19(3):20-22.
[5]薄金嶺,沙淼.高效同化膽固醇乳酸菌菌株的篩選及在食品中的應用[J].中國乳品工業,2004,32(4):31-33.
[6]呂兵,夏文水,張國農.分離自Kefir的植物乳桿菌體外降膽固醇作用的研究[J].中國乳品工業,2004,32(4):3-5.
[7]凌代文.乳酸細菌分類鑒定及實驗方法[M].北京:中國輕工業出版社,1999:85-86.
[8]王成濤,牛天貴,郭三堆.構建高效降解膽固醇的融合乳酸菌的研究-原生質體融合及融合子的篩選[J].生物技術通報,2002(2):42-46.
[9]肖琳琳,董明盛.西藏干酪乳酸菌降膽固醇特性研究[J].食品科學,2003,24(10):142-145.
[10]Liong M T,Shah N P.Acid and bile tolerance and cholesterol removal ability of lactobacilli strains[J].Journal of Dairy Science,2005,88:55-66.
[11]Pereira D A,Gibson G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human guts[J].Applied and Environmental Microbiology,2002,68:4689-4693.
[12]Rudel L L,Morris M D.Determination of cholesterol using o-phthalaldehyde[J].Journal of Lipid Research,1973,14:364-366.
[13]Usman,Hosono A.Bile tolerance,taurocholate deconjugation,and binding of cholesterol by Lactobacillus gasseri Strains[J].Journal of Dairy Science,1999,82:243-248.
[14]Kimoto H,Ohmomo S,Okamoto T.Cholesterol removal from media by Lactococci[J].Journal of Dairy Science,2002,85:3182-3188.
[15]袁肖寒,高學軍.嗜熱鏈球菌超濃縮培養過程中菌體生化代謝規律研究[J].東北農業大學學報,2005,36(5):621-624.
[16]Tok E,Aslim B.Cholesterol removal by some lactic acid bacteria that can be used as probiotic[J].Microbiology and Immunology,2010,54(5):257-264.
[17]He J,Gu D,Wu X.Major causes of death among men and women in China[J].The New England Journal of Medicine,2005,353(11):1124-1134.

