華北大黑鰓金龜氣味受體OrCo基因的克隆及序列分析
王 冰, 尹 姣, 李克斌, 曹雅忠
(中國農業科學院植物保護研究所,植物病蟲害生物學國家重點實驗室,北京 100193)
昆蟲在長期進化過程中形成靈敏的嗅覺機制,以適應復雜多變的環境條件,從而得以生存繁衍。昆蟲對氣味分子的識別和鑒定包括一系列的過程,即脂溶性小分子化合物的氣味物質借助氣味結合蛋白(odorant-binding proteins,OBPs)等小分子量觸角蛋白的攜帶,穿過氣—液相界面到達嗅覺受體(olfactory receptors,ORs),在觸角嗅覺受體內完成對氣味的識別[1-2]。1981年昆蟲氣味分子結合蛋白的發現以及其功能探討,邁出了對嗅覺機制研究的第一步[3]。1991年,Buck和Axel首次在哺乳動物鼠中分離出了嗅覺受體[4]。而昆蟲嗅覺受體的研究起步較晚,1999年在黑腹果蠅(Drosophila mela-nogaster)中發現了第一個昆蟲氣味受體[5],為昆蟲嗅覺蛋白功能的研究以及氣味分子識別機制奠定了基礎。昆蟲氣味受體分為傳統氣味受體(conventional receptor)和OrCo(曾經被稱為Or83b)受體(olfactory receptor coreceptor)[6]。前 者 基 因 在 不同昆蟲間同源性較低,目前已有的研究顯示只在較小部分昆蟲物種間獲得;而后者基因是一類非典型氣味受體,在不同種間高度保守,與傳統的氣味受體共同行使嗅覺功能[7-9]。同時也有研究表明,OrCo受體對傳統的氣味受體在膜結構上的正確定位起著不可或缺的作用[10]。
近年來,由于作物種植結構和耕作制度的調整等原因導致地下害蟲頻頻暴發,對我國的農業生產安全造成重大的威脅[11]。鞘翅目金龜甲類昆蟲是國內外公認的難以防治的土棲性害蟲,其中比較特殊的類群—華北大黑鰓金龜[Holotrichia oblita(Faldermann)]在我國發生相當嚴重,是金龜子類害蟲中防治的難點[12]。金龜子類害蟲的幼蟲主要集中在地下危害,防治困難,而成蟲一般在地面活動,防治方法相對簡便,因此,尋求對成蟲的有效防治方法成為了科學家們近年來研究的熱點。金龜子在尋找寄主、配偶,搜尋產卵及生殖場所等過程中,蟲體同外界的化學信息交流密切,其中嗅覺在此過程中具有重要的作用[13]。因此,對其成蟲嗅覺系統的深入研究可成為控制其幼蟲為害的突破點。目前,現有的研究發現,昆蟲對成千上萬種氣味分子的識別主要依賴于氣味受體介導的氣味分子與嗅覺神經的專一性結合。因此,研究氣味受體的特性、變異及專一性對于闡明嗅覺識別的分子機理是非常重要的[14-15]。本研究采用PCR克隆和RACE延伸技術獲得了華北大黑鰓金龜子非典型受體蛋白OrCo基因,并對其進行序列分析,為深入研究華北大黑鰓金龜嗅覺機制打下基礎。
1 材料與方法
1.1 供試蟲源
試蟲華北大黑鰓金龜成蟲于2011年5月在河北省滄州市郊區采集。將試蟲成蟲的觸角用刀片切下,立即置于液氮中速凍,之后于-80℃保存。
1.2 主要試劑
總RNA提取試劑Trizol購自Invitrogen公司;PrimeScript 1st Strand cDNA Synthesis Kit、5′-Full RACE Kit、3′-Full RACE Core Set Ver.2.0、Agarose Gel DNA Purification Kit Ver.2.0試劑盒、LA Taq酶購自寶生物工程有限公司(TaKaRa);感受態細胞Trans5αChemically Competent Cell購自全式金公司;pGEM-T Easy vector購自Promega公司;抗生素類、X-gal、IPTG購自Sigma公司;其余試劑均為國產或進口分析純試劑。引物合成由上海生工公司完成;測序由華大基因生物技術公司完成。
1.3 試驗方法
1.3.1 華北大黑鰓金龜觸角總RNA的提取
取50頭華北大黑鰓金龜成蟲,剪下觸角,于液氮中研磨,根據Trizol提取RNA說明書提取總RNA,之后加入RNase-free水30μL,立即進行cDNA第1鏈合成或-80℃保存。
1.3.2 cDNA第1鏈合成
以總RNA為模板,按照PrimeScript 1st Strand cDNA Synthesis Kit說明書進行反轉錄,合成cDNA第1鏈。反應步驟如下:將下列物質混合:Oligo dT Primer(50μmol/L)1μL,dNTP 1μL,總 RNA 6μg,RNase free dH2O 2μL,之后在PCR儀上進行65℃5min變性、退火反應,于冰上急冷。配制反轉錄反應液,包括5×PrimeScriptTMBuffer 4μL,RNase Inhibitor(40U/μL)0.5μL,PrimeScriptTMRTase(200U/μL)1μL,上述變性、退火后反應液10μL,RNase Free dH2O 4.5μL,在PCR儀上按下列條件進行反轉錄反應:42℃60min,70℃15min,冰上放置。將合成的cDNA于-20℃保存。
1.3.3 引物設計與合成
根據GenBank中已經登錄的近緣種金龜子Or-Co基因的保守區域,利用引物設計軟件Primer Premier 5設計相應的簡并引物,用于擴增華北大黑鰓金龜OrCo受體基因的cDNA片段。3′RACE和5′RACE引物是根據cDNA擴增片段獲得的序列而進一步設計的。最后設計特異性引物擴增OrCo受體基因的全長。引物序列見表1。

表1 擴增華北大黑鰓金龜OrCo基因所用引物
1.3.4 PCR擴增和RACE反應
以合成的cDNA為模板,選用LATaq酶擴增。混勻下列成分:合成的cDNA 2.5ng,dNTP Mixture 8μL(各2.5mmol/L),10×LA PCR BufferⅡ(Mg2+free)5μL,25mmol/L MgCl25μL,正向引物和反向引物各1μL(20μmol/L),LA Taq DNA 聚 合 酶(5U/μL)0.5μL,加滅菌蒸餾水至50μL,放入PCR儀進行擴增。PCR反應條件:94℃變性5min;30個循環條件為94℃30s,55℃30s,72℃1min的循環;72℃延伸10min。
RACE 反應參照5′-Full RACE Kit和 3′-Full RACE Core Set Ver.2.0說明書。擴增的產物用1.0%瓊脂糖凝膠電泳檢測并對目的片段進行回收。
1.3.5 PCR產物克隆及序列測定
按說明書的說明,將PCR回收產物連接到pGEM-T Easy vector上,然后轉化到大腸桿菌Trans5αChemically Competent Cell,進行藍白斑篩選,挑取陽性克隆,之后送公司測序。
1.3.6 序列分析
Blast同源性搜索在NCBI網站進行,序列分析由DNAman軟件完成,跨膜域預測由TMHMM程序(http:∥www.cbs.dtu.dk/services/TMHMM)完成。多序列同源性比對和結果輸出應用Clustal 2.0.7軟件進行。昆蟲氣味受體進化樹的構建使用Mega4.1軟件進行。
2 結果與分析
2.1 華北大黑鰓金龜OrCo基因的克隆
以反轉錄獲得的cDNA為模板,利用簡并引物對其進行PCR擴增,獲得450bp左右的片段,與pGEMT Easy vector連接,并轉化大腸桿菌Trans5α細胞,對其進行菌液PCR,檢測片段大小正確后測序。獲得的片段序列在NCBI網站上進行BLAST同源搜索,比對結果顯示該片段與鞘翅目嗅覺受體基因高度同源。根據獲得的序列分別設計3′-RACE和5′-RACE所需的特異性引物(見表1),并根據說明書進行擴增,結果得到了580bp和1 300bp的特異性條帶,同樣將這些片段進行連接,轉化與測序。
根據3′-RACE和5′-RACE測序結果,拼接獲得一個編碼華北大黑鰓金龜OrCo的cDNA序列。同時,我們設計了1對特異性引物(見表1)來證明PCR,3′-RACE和5′-RACE片段是來源于同一個基因,PCR擴增得到了一條全長為1 598bp的序列,測序結果與拼接結果一致(圖1)。該序列蛋白編碼區長1 434bp,5′非翻譯區長203bp,3′非翻譯區不完整,但是得到了終止密碼子TAA以及多聚腺苷酸信號序列,因此蛋白編碼區是完整的。
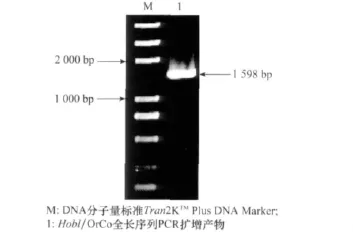
圖1 華北大黑鰓金龜OrCo基因(Hobl/OrCo)PCR擴增結果
2.2 序列分析
將克隆獲得的華北大黑鰓金龜cDNA全長序列命名為Hobl/OrCo,并在GenBank注冊,登錄號為:JF718 662。如圖2所示,Hobl/OrCo基因的核苷酸序列全長共1 598bp,開放閱讀框全長1 434bp,編碼477個氨基酸。根據網站http:∥www.expasy.ch/tools/protparam.html預測其分子量為54.54ku,等電點為7.65。跨膜結構分析(http:∥www.cbs.dtu.dk/services/TMHMM)表明,Hobl/OrCo基因推斷的氨基酸序列具有7個α螺旋跨膜區,跨膜位置分別為37~59、74~96、135~157、194~216、339~361、381~403、451~473(圖3),類似于一個典型的G蛋白偶聯受體。

圖2 華北大黑鰓金龜Hobl/OrCo核苷酸序列及推導的氨基酸序列

圖3 華北大黑鰓金龜Hobl/OrCo跨膜區預測
以往的研究表明OrCo受體在昆蟲進化過程中高度保守,因此選取已知近緣種鞘翅目的鉛灰齒爪鰓金龜(Hplu/OrCo)、赤擬谷盜(Tcas/OrCo)和黃曲條跳甲(Pstr/OrCo),以及鱗翅目、雙翅目和膜翅目具有代表性的昆蟲與其進行序列聯配。結果顯示,Hobl/Or-Co基因的氨基酸序列與近緣種鉛灰齒爪鰓金龜(Hplu/OrCo)的同源性高達95.39%,與鞘翅目赤擬谷盜(Tcas/OrCo)同源性高達80.71%,與已經報道的其他昆蟲的嗅覺受體同源性在76%以上,尤其在C端保守性非常高,這與以往的研究高度吻合(圖4)。


利用Mega 4.1軟件[16]構建了鱗翅目、鞘翅目、膜翅目、雙翅目部分昆蟲非典型氣味受體的系統進化樹(圖5)。經1 000次重復后,該進化樹非常直觀地呈現出4個目昆蟲之間的進化關系。結果顯示,22個OrCos分成2個大的分支,其中雙翅目和鞘翅目昆蟲處于一個分支上,而膜翅目和鱗翅目昆蟲處于另一個大分支上,說明相對于膜翅目和鱗翅目而言,雙翅目與鞘翅目在OrCo上的親緣關系較近。這4個目的氣味受體序列均表現得相對較為保守,未出現較大的分化。在鞘翅目中,大黑鰓金龜(Hobl/Or-Co)與鉛灰齒爪鰓金龜(Hplu/OrCo)的非典型氣味受體親緣關系很近,與黃曲條跳甲(Pstr/OrCo)則相對遠些,這與序列聯配的結果相一致。
3 討論
對果蠅(Drosophila melanogaster)、岡比亞按蚊(Anopheles gambiae)、意大利蜜蜂(Apis mellifera)、煙芽夜蛾(Heliothis virescens)、家蠶(Bombyx mori)、埃及伊蚊(Aedes aegypti)和赤擬谷盜(Tribolium castaneum)等多種昆蟲研究發現,普通氣味受體基因在昆蟲中同源性很低[9,17-24]。但是另一類非典型氣味受體基因OrCo則不同,這類基因在不同昆蟲體內高度保守[25]。目前,已經在鱗翅目、膜翅目、鞘翅目、雙翅目[22,26-27]等4個目昆蟲中發現 Or-Co的存在。本研究利用基因克隆技術成功獲得了華北大黑鰓金龜OrCo基因的cDNA全長序列,并進行了序列分析,獲得的氨基酸序列與近緣種鉛灰齒爪鰓金龜嗅覺受體的同源性高達95%以上,與鞘翅目赤擬谷盜的同源性高達80%以上,這些都與OrCo基因在不同昆蟲體內的高度保守性相吻合[28-33]。
目前研究顯示OrCo可加速受體與氣味分子間的相互作用[8-9,22,34],并能輔助傳統氣味受體正確定位到嗅覺神經元樹突膜上[8]。OrCo基因與傳統氣味受體間的互作研究,有助于發掘和研究傳統氣味受體的相關功能,為進一步探索受體在氣味識別過程中所起的作用和功能提供了理論基礎。但是,完整的嗅覺受體信號傳導機制尚不清楚[35]。2008年在《nature》發表的兩篇文章提出了一種新的嗅覺傳導模型,即OR-OrCo和氣味化合物共同控制的離子通道[36-37]。該研究顯示昆蟲的化學傳導機制可能與其他脊椎動物的有所不同。經典的G蛋白偶聯受體的膜拓撲結構呈現為:蛋白的N末端位于細胞膜外,C末端位于細胞膜內。然而,果蠅的膜拓撲結構則與傳統的G蛋白偶聯受體相反,這樣與配體結合的ORs就受到了更多的限制[34]。如果所有果蠅的ORs都呈現出反向G蛋白偶聯受體的特征,那么它們將代表另一種7個跨膜結構域蛋白家族。同時,它們的信號傳導途徑可能與G蛋白偶聯受體不同,可能利用磷脂肌醇(IP3)信號通路抑或是環核苷酸信號通路將配體信息傳導到受體神經元上,刺激電生理活動[38]。因此,當嗅覺受體與氣味配體結合后是如何傳導信號的尚需進一步的研究與驗證。
華北大黑鰓金龜OrCo受體的成功克隆,對進一步研究華北大黑鰓金龜氣味受體的功能以及解析嗅覺機制具有重要的意義。同時,從應用角度來看,由于OrCo基因在昆蟲中普遍存在以及其在嗅覺機制中的重要性,使其成為切斷嗅覺識別途徑的分子靶標,對其深入研究將為農業害蟲的防控提供新的理論基礎,并具有一定的實踐意義。
[1]Subchev M,Jurenka R A.Sex pheromone levels in pheromone glands and identification of the pheromone and hydrocarbons in the hemolymph of the moth Scoliopteryx libatrix L.(Lepidoptera:Noctuidae)[J].Arch Insect Biochem Physiol,2001,47(1):35-43.
[2]MatouskováP,PichováI,Svatos A.Functional characterization of a desaturase from the tobacco hornworm moth(Manduca sexta)with bifunctional Z11-and 10,12-desaturase activity[J].Insect Biochemistry and Molecular Biology,2007,37(6):601-610.
[3]Vogt R G,Riddifoed L M.Pheromone binding and inactivation by moth antennae[J].Nature,1981,293:161-163.
[4]Buck L,Axel R.A novel multigene family may encode odorant receptors:a molecular basis for odor recognition[J].Cell,1991,65:175-187.
[5]Pennisi E.Fruit fly odor receptors found[J].Science,1999,283(5406):1239.
[6]Vosshall L B,Hansson B S.A unified nomenclature system for the insect olfactory co-receptor[J].Chemical Senses,2011,36:497-498.
[7]Wetzel C H,Behrendt H J,Gisselmann G,et al.Functional expression and characterization of a Drosophila odorant receptor in a heterologous cell system[J].Proceedings of the National Academy of Sciences,USA,2001,98(16):9377-9380.
[8]Larsson M C,Domingos A I,Jones W D,et al.Or83bencodes a broadly expressed odorant receptor essential for Drosophila olfaction[J].Neuron,2004,43(5):703-714.
[9]Jones W D,Nguyen T A,Kloss B,et al.Functional conservation of an insect odorant receptor gene across 250million years of evolution[J].Current Biology,2005,15(4):119-121.
[10]Miller R,Tu Z J.Odorant receptor C-terminal motifs in divergent insect species[J].Journal of Insect Science,2008,8:1-10.
[11]曹雅忠,李克斌,尹姣.淺析我國地下害蟲的發生與防治現狀[M]∥農業生物災害預防與控制研究.北京:中國農業出版社,2005:389-393.
[12]姚慶學,張勇,丁巖.金龜子防治研究的回顧與展望[J].東北林業大學學報,2003,31(1):64-66.
[13]鄧思思,尹姣,曹雅忠,等.華北大黑鰓金龜對20種植物源揮發物的電生理和行為反應[J].植物保護,2011,37(5):62-66.
[14]Clyne P J,Warr G G,Freeman M R,et al.A novel family of divergent seven-transmembrane proteins:Candidate odorant receptors in Drosophila[J].Neuron,1999,22:327-338.
[15]Vosshall L B,Amrein H,Morozov P S,et al.A spatial map of olfactory receptor expression in the Drosophilaantenna[J].Cell,1999,96:725-736.
[16]Tamura K.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24:1596-1599.
[17]Fox A N,Pitts R J,Robertson H M,et al.Candidate odorant receptors from the malaria vector mosquito Anopheles gambiae and evidence of down-regulation in response to blood feeding[J].Proceedings of the National Academy of Sciences,USA,2001,98(25):14693-14697.
[18]Hill C A,Fox A N,Pitts R J,et al.G protein-coupled receptors in Anopheles gambiae[J].Science,2002,298:176-178.
[19]Krieger J,Raming K,Dewer Y M E,et al.A divergent gene family encoding candidate olfactory receptors of the moth Heliothis virescens[J].European Journal of Neuroscience,2002,16:619-628.
[20]Krieger J,Grosse-Wilde E,Gohl T,et al.Gene encoding candidate pheromone receptors in a moth(Heliothis virescens)[J].Proceedings of the National Academy of Sciences,USA,2004,101(32):11845-11850.
[21]Sakurai T,Nakagawa T,Mitsuno H,et al.Identification and functional characterization of a sex pheromone receptor in the silkmoth Bombyx mori[J].Proceedings of the National Academy of Sciences,USA,2004,101:16653-16658.
[22]Nakagawa T,Sakurai T,Nishioka T,et al.Insect sex-pheromone signals mediated by specific combinations of olfactory receptors[J].Science,2005,307:1638-1642.
[23]Robertson H M,Wanner K W.The chemoreceptor superfamily in the honey bee,Apis mellifera:expansion of the odorant,but not gustatory,receptor family [J].Genome Research,2006,16(11):1395-1403.
[24]Wanner K W,Anderson A R,Trowell S C,et al.Female-biased expression of odourant receptor genes in the adult antennae of the silkworm,Bombyx mori[J].Insect Molecular Biology,2007,16(1):107-119.
[25]Dobritsa A A,van der Goes van Naters W,Warr C G,et al.Integrating the molecular and cellular basis of odor coding in the Drosophilaantenna[J].Neuron,2003,37(5):827-841.
[26]Krieger J,Klink O,Mohl C,et al.A candidate olfactory receptor subtype highly conserved across different insect orders[J].Journal of Comparative Physiology A-Neuroethology Sensory Neural and Behavioral Physiology,2003,189(7):519-526.
[27]Pitts R J,Fox A N,Zwiebel L J.A highly conserved candidate chemosensory receptor expressed in both olfactory and gustatory tissues in the malaria vector mosquito,Anopheles gambiae[J].Proceedings of the National Academy of Sciences,USA,2004,101:5058-5063.
[28]王桂榮,吳孔明,蘇宏華,等.棉鈴蟲嗅覺受體基因的克隆及組織特異性表達[J].昆蟲學報,2005,48(6):823-828.
[29]鞏中軍,周文武,祝增榮,等.昆蟲嗅覺受體的研究進展[J].昆蟲學報,2008,51(7):761-768.
[30]喬奇,原國輝,李海超,等.昆蟲氣味受體研究進展[J].昆蟲學報,2008,51(1):75-80.
[31]張帥,張永軍,蘇宏華,等.中紅側溝繭蜂非典型氣味受體的克隆及組織特異性表達[J].中國農業科學,2009,42(5):1639-1645.
[32]陳全森,姜曉靜,鞠倩,等.農業害蟲鉛灰齒爪鰓金龜氣味受體基因Or83b的克隆及序列分析[J].江西農業學報,2010,22(11):1-4.
[33]申建梅,胡黎明,賓淑英,等.瓜實蠅嗅覺受體基因的克隆及表達譜分析[J].昆蟲學報,2011,54(3):265-271.
[34]Benton R,Sachase S,Michnick S W,et al.A typical membrane topology and heteromeric function of Drosophilaodorant receptors in vivo[J].PLoS Biology,2006,4(2):240-257.
[35]Ha T S,Smith D P.Insect odorant receptors:Channeling scent[J].Cell,2008,133(5):761-763.
[36]Sato K,Pellegrino M,Nakagawa T,et al.Insect olfactory receptors are heteromeric ligand-gated ion channels[J].Nature,2008,452:1002-1006.
[37]Wicher D,Schafer R,Bauernfeind R,et al.Drosophila odorant receptors are both ligand–gated and cyclic-nucleotide-activated cation channels[J].Nature,2008,452:1007-1011.
[38]Smart R,Kiely A,Beale M,et al.Drosophila odorant receptors are novel seven transmembrane domain proteins that can signal independently of heterotrimeric G proteins[J].Insect Biochemistry and Molecular Biology,2008,38(8):770-780.

