具有除草活性的小麥根腐病菌發酵條件優化
魏松紅, 張麗瑩, 王 黎, 張景遠, 李 斐
(沈陽農業大學植物保護學院,沈陽 110866)
化學除草劑的大量使用,對環境和人類的健康產生嚴重威脅[1],因此尋求更為安全有效的除草劑已成為除草劑產業今后的發展方向。近年來微生物源除草劑得到了較大的發展,從植物病原真菌中篩選具有除草活性的菌株是微生物源除草劑研究的一個很重要的方面[2]。
研究報道最多的產生除草活性毒素的植物病原真菌主要來自鏈格孢菌屬(Alternaria)、鐮刀菌屬(Fusarium)、炭疽菌屬(Colletotrichum)等。強勝等[3]對百日草鏈格孢菌(Alternaria alternata)孢子大規模生產以及該菌產生的毒素進行了提純和生測,該菌株產生的毒素對紫莖澤蘭(Eupatorium adenophorum)有致病作用。張金林等[4]研究發現蔥葉枯病菌(Stemphylium botryosum)毒素對稗草(Echinochloa crusgalli)和馬唐(Digitaria sanguinalis)等雜草種子的萌發和幼苗生長有較強的抑制作用。董金皋等[5]從灰葡萄孢BC7-3菌株的代謝產物中得到了一個純度達99.38%對馬唐具有較強殺除活性的純組分。
本試驗利用篩選到的對馬唐種子萌發具有抑制作用的小麥根腐病菌菌株,對該菌株搖瓶發酵條件進行優化,為該菌株進行發酵工業生產提供依據,并為進一步利用該菌株產生的除草活性物質開發創制新農藥奠定基礎。
1 材料與方法
1.1 供試雜草、菌株和培養基
馬唐(Digitaria sanguinalis)采自沈陽農業大學實驗基地。
小麥根腐病菌(Bipolaris sorokiniana)由沈陽農業大學農藥科學實驗室提供,對馬唐種子萌發抑制率達到81.67%。
PDA培養基、PSA培養基、Peberdy培養基、Richard培養基、察氏培養基。
1.2 菌株培養濾液制備
將小麥根腐病菌菌株擴繁,用直徑0.5cm的打孔器打取菌片,接種于250mL三角瓶中,每瓶裝有150mL PD培養液,每瓶接種3片,置于恒溫培養箱中28℃、130r/min振蕩培養,7d后,用4層紗布過濾去掉菌絲體,再用定性濾紙(中速)過濾,得到無菌培養濾液。
1.3 供試菌株培養濾液除草活性測定
采用種子萌發法測定菌株的除草活性。將濾紙放入培養皿中,165℃干熱滅菌30min。在皿中放入待測雜草種子20粒,加入無菌培養濾液3mL,以清水做對照,重復3次,在28℃恒溫培養箱中黑暗培養,對照發芽率達到80%及以上時,記錄種子發芽數,并計算校正抑制率,用DPS數據處理系統Duncan新復級差法分析5%差異顯著性。

1.4 初始發酵培養基的篩選
供試培養基選擇PDA、PSK、Peberdy培養基、Richard培養基、察氏培養基。將篩選出的小麥根腐病菌分別接種于不同培養液中,28℃、130r/min振蕩培養5d后過濾,進行除草活性測定。
1.5 發酵培養基成分優化
1.5.1 單因素試驗
(1)碳源篩選:以篩選出的培養液作為基礎培養液,1 000mL培養液中分別加入20g葡萄糖、麥芽糖、蔗糖、木糖、可溶性淀粉、乳糖作碳源,取代培養液中的碳源,每處理3次重復,以不加碳源的培養濾液為對照,28℃、130r/min振蕩培養5d,過濾。(2)氮源篩選:在1 000mL基礎培養液中,分別加入2.5g氯化銨、硝酸鈉、硝酸鉀、酵母膏、硝酸銨、蛋白胨作為氮源,每處理3次重復,以不加氮源的培養濾液作為對照,28℃、130r/min振蕩培養5d,過濾。(3)添加不同無機鹽:在1 000mL基礎培養液中,分別加入 KCl 0.5g,K2HPO41.0g,MgSO4·7H2O 0.5g,FeSO40.01g,CuSO40.5g,MnCl20.5g,Zn-SO40.5g,每處理3次重復,以不加無機鹽的基礎培養液作為對照,28℃、130r/min振蕩培養5d,過濾。
1.5.2 多因素正交試驗
以篩選出的最佳碳源、氮源、無機鹽為變異因素,采用L18(37)正交表進行培養基基本組成配比優化試驗,從中選出發酵液的最佳培養基組合。
1.6 菌株發酵條件的優化
對小麥根腐病菌從初始pH、轉速、溫度、發酵時間、裝液量和接種量等方面進行發酵條件的優化:(1)將發酵液初始pH 分別調至3.0、4.0、5.0、6.0、7.0、8.0、9.0、9.5、10.0、11.0,28 ℃、130r/min振蕩培養5d,過濾。(2)將小麥根腐病菌接種于察氏培養 液 中,分 別 放 在 靜 置、100、130、150、180、210r/min的條件下,28℃,培養5d,過濾。(3)將發酵培養液分別放置在20、24、28、32、36、40℃的搖床中,130r/min振蕩培養5d,過濾。(4)將小麥根腐病菌接種于察氏培養液中,28℃、130r/min振蕩培養,分別發酵1、2、3、4、5、6、7、8、9、10d后過濾。(5)在250mL的三角瓶中分別裝入40、80、100、120、140、160、180mL發酵培養液,28℃、130r/min振蕩培養5d,過濾。(6)取10mL無菌水沖洗平板上的小麥根腐病菌孢子,分別按培養液的0.5%、1%、2%、4%、6%、8%、10%接入到發酵培養基中,28℃、130r/min振蕩培養5d,過濾。
1.7 小麥根腐病菌菌株發酵產物理化性質研究
對小麥根腐病菌發酵產物的理化性質主要從以下方面進行研究:
(1)熱穩定性測定
試驗設兩組處理,將培養濾液分別于30、50、70、90、121℃處理30min;將培養濾液在高壓滅菌條件下處理30、60、90min。待培養濾液自然冷卻后,用種子萌發法檢測除草活性。
(2)酸堿穩定性測定
用1.0mol/L HCl和1.0mol/L NaOH 分別將培養濾液 pH 調為1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0,常溫下 放置24h后,將pH調回原值,用種子萌發法檢測除草活性。
(3)光照穩定性測定
將培養濾液置開蓋培養皿內,分別在自然光和40W日光燈(距光源50cm)下照射3、6、12h后以種子萌發法檢測活性。
(4)紫外線穩定性
將培養濾液置于15W紫外燈下照射15、30、45、60min后用種子萌發法檢測其活性。
2 結果與分析
2.1 初始發酵培養基的篩選
小麥根腐病菌在5種培養液中的培養濾液對馬唐種子均有抑制作用(圖1),其中小麥根腐病菌在察氏培養液中產生的活性物質對馬唐種子的校正抑制率最高,達到86.67%。小麥根腐病菌在其他4種培養液中的培養濾液對馬唐種子的校正抑制率都低于80%,并且和察氏培養液具有顯著差異,所以察氏培養基是最適合小麥根腐病菌產生活性物質的培養基。
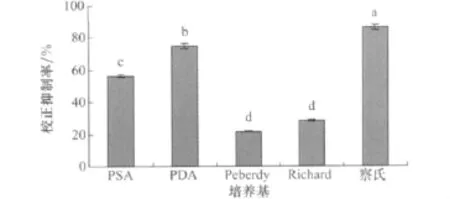
圖1 不同培養基對小麥根腐病菌發酵液除草活性的影響
2.2 發酵培養基成分優化
2.2.1 不同碳源、氮源、無機鹽對小麥根腐病菌除草活性的影響
添加不同的碳源對小麥根腐病菌除草活性物質的產生有一定的影響(圖2),以葡萄糖為碳源時校正抑制率最高,為86.67%。所以葡萄糖為適合小麥根腐病菌產生活性物質的碳源。
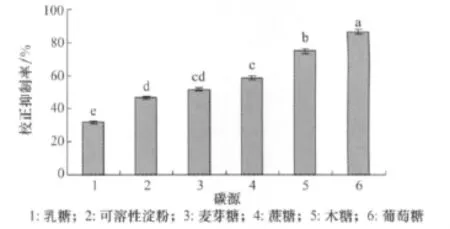
圖2 不同碳源對小麥根腐病菌發酵液除草活性的影響
由圖3可知,當培養液中添加的氮源為氯化銨時,小麥根腐病菌的發酵液對馬唐的校正抑制率達到88.33%,以硝酸銨為氮源時,校正抑制率達到83.33%,處理間差異不顯著。
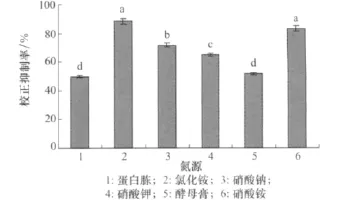
圖3 不同氮源對小麥根腐病菌發酵液除草活性的影響
由圖4可知添加不同無機鹽的培養濾液均具有一定的除草活性,其中培養基中添加KCl、K2HPO4、MgSO4·7H2O、FeSO4校正抑制率分別達到91.67%、90.00%、90.00%、90.00%,處理間差異不顯著。
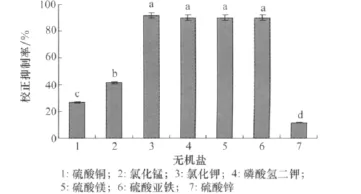
圖4 不同無機鹽對小麥根腐病菌菌株除草活性的影響
2.2.2 多因素正交試驗
以葡萄糖、氯化銨、氯化鉀、硫酸鎂、磷酸氫二鉀和硫酸亞鐵為變量,按L18(37)設計7因素3水平正交試驗。極差分析結果表明(表1、2、3),不同成分含量影響程度的R值:A>C>F>G>E>B>D,最佳水平組合為A2B2C2D3E3F1G1;方差分析結果表明因素A高度顯著,因素C顯著,因素B、D、E、F、G不顯著,從經濟方面考慮,選B1、D1、E1、F1、G1,所以最優水平組合為A2B1C2D1E1F1G1。
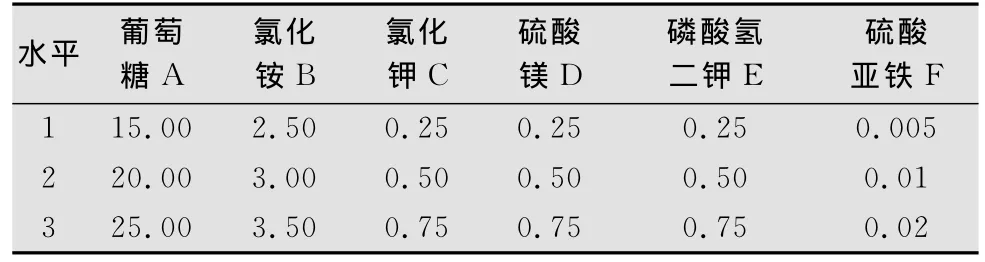
表1 培養基中各營養成分的正交試驗因素與水平
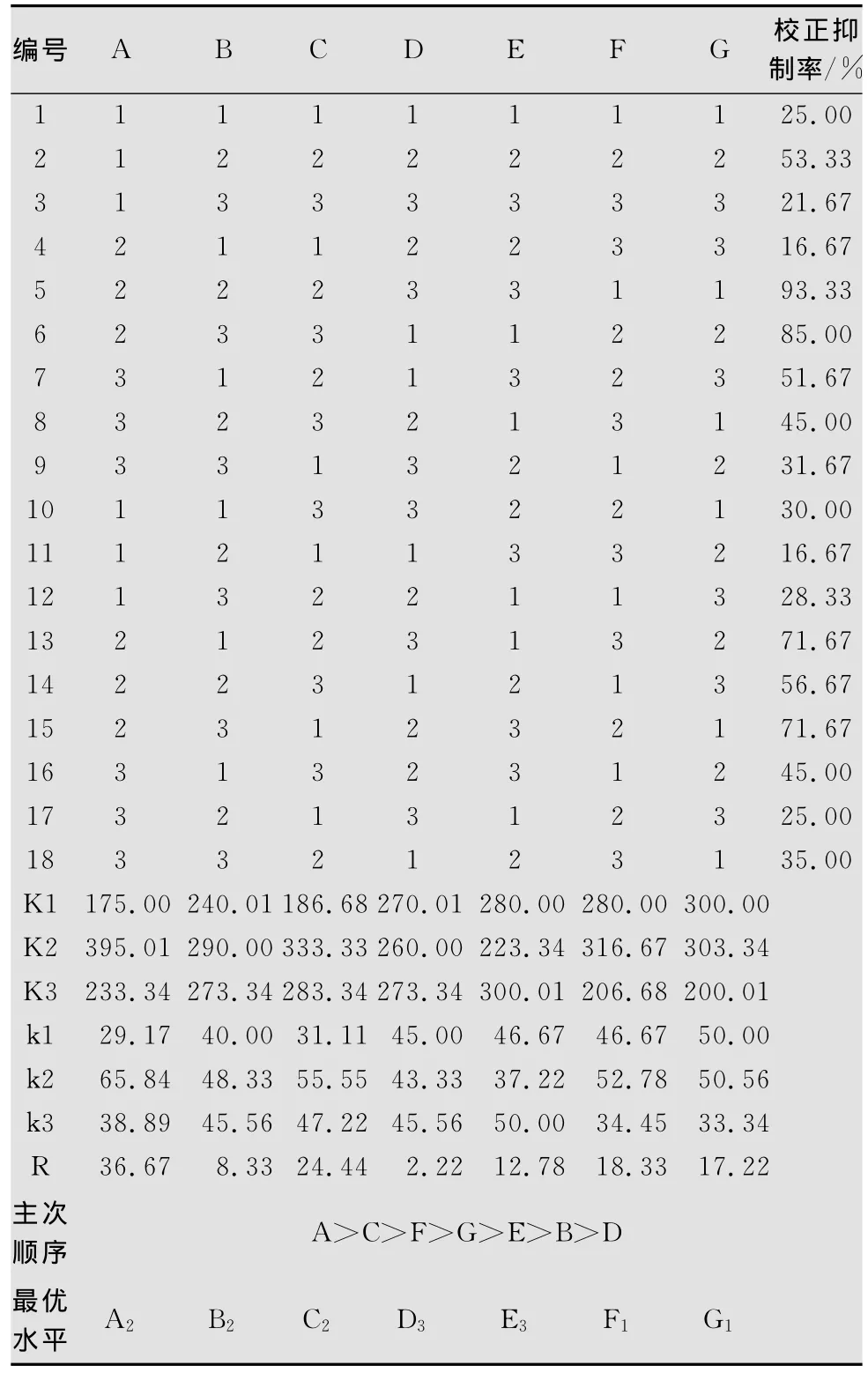
表2 培養基中各營養成分的正交試驗結果1)
2.3 不同發酵條件對小麥根腐病菌菌株發酵產物除草活性的影響
由圖5可知,小麥根腐病菌在強酸強堿環境下產生除草活性物質的量很少,對馬唐種子萌發的校正抑制率低。pH由強酸強堿性向中性變化時,校正抑制率逐漸提高,當初始培養液pH為7時,校正抑制率達到最高為93.33%。

表3 培養基中各營養成分的方差分析結果1)
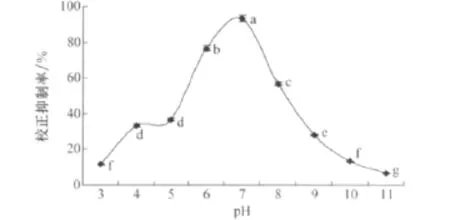
圖5 不同初始pH對小麥根腐病菌發酵液除草活性的影響
小麥根腐病菌在靜置條件下的發酵液對馬唐的校正抑制率最低,在動態培養條件下,隨著轉速的提高,校正抑制率有所提升,當轉速達到130r/min時,校正抑制率最高為93.33%,轉速高于130r/min時,校正抑制率下降(圖6)。
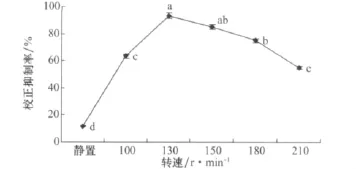
圖6 不同轉速對小麥根腐病菌發酵液除草活性的影響
由圖7可知,隨著溫度的升高,小麥根腐病菌菌株除草活性物質產量不斷增加,28℃時其發酵液對馬唐種子萌發的校正抑制率達到95%,當溫度高于28℃時,菌絲的生長速度明顯下降。
由圖8可知,隨著培養時間的延長,小麥根腐病菌除草活性物質產量逐漸增加,5d時產量達到高峰,發酵液對馬唐種子萌發的校正抑制率達到96.67%,當培養時間超過5d時,菌株的除草活性下降。
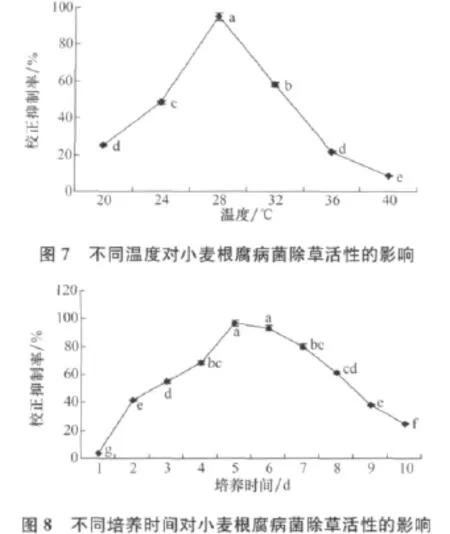
不同裝液量對小麥根腐病菌除草活性有一定的影響(圖9),裝液量為120mL/250mL時,校正抑制率達到最高為93.33%,裝液量再增加時,校正抑制率反而下降。
由圖10可知,接種量對小麥根腐病菌除草活性物質的產量有一定的影響,隨著接種量的增加,培養濾液活性逐漸增強,當接種量為6%時,校正抑制率達到95.00%。
2.4 小麥根腐病菌菌株發酵產物理化性質研究
(1)熱穩定性測定
將培養濾液分別于30、50、70、90、121℃處理30min后,培養濾液對馬唐種子萌發的抑制率分別為93.33%、95%、93.33%、96.67%、93.33%,但在121℃下處理60、90min后,培養濾液的抑制率下降到80%和68.33%(表4),說明培養濾液中的活性物質對溫度有一定的穩定性,但長時間的高溫處理,會破壞培養濾液中的活性物質。

表4 小麥根腐病菌菌株培養濾液的熱穩定性1)
(2)酸堿穩定性測定
培養濾液在pH5~7的范圍內變化時,其對馬唐種子的抑制率在90%以上,各處理和對照差異不顯著,pH為堿性時,抑制率有所下降,可見培養濾液在弱酸性和中性條件下穩定,在堿性條件下不穩定(圖11)。
(3)光照穩定性測定
小麥根腐病菌培養濾液在自然光和日光燈下分別照射,由圖12可知不同光照下菌株除草活性沒有顯著差異,說明該病菌的培養濾液具有很好的光照穩定性。
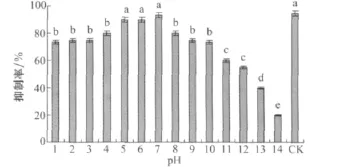
圖11 小麥根腐病菌菌株培養濾液的酸堿穩定性
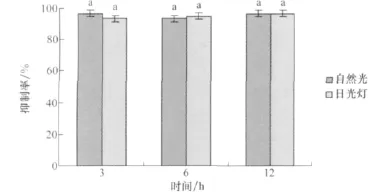
圖12 小麥根腐病菌菌株培養濾液的光照穩定性
(4)紫外線穩定性
培養濾液放在紫外燈下分別照射15、30min時,其對馬唐種子萌發的抑制率和對照差異不顯著,照射45、60min時抑制率下降到80%和78.33%,所以培養濾液在儲藏過程中要避免紫外照射(圖13)。
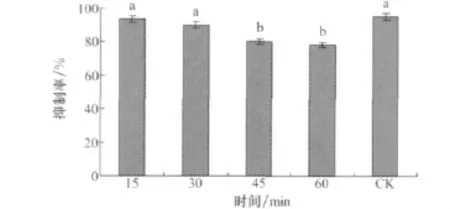
圖13 小麥根腐病菌菌株培養濾液的紫外穩定性
3 討論
微生物能產生很多代謝產物,這些產物中含有殺草活性物質,利用微生物所產生的對植物具有毒性的代謝產物進行雜草防除的除草劑稱為微生物源除草劑[7]。第一個開發成功的微生物源除草劑為雙丙氨膦,廣泛用于防除一年生和多年生禾本科雜草及闊葉雜草。姜述君[8]等從狹卵鏈格孢菌株AAEC0523中分離到一淡黃色的油狀毒素,對稗草的種子萌發和幼苗生長都有較強的抑制作用。谷祖敏[9]等從草莖點霉SYAU-06菌株中提取的毒素對鴨跖草胚根和芽的伸長有較強的抑制作用。
發酵是抗生素產業化的基礎,若缺乏合理的發酵工藝,也不能將其潛力充分發揮,抗生素發酵除受營養因素的限制以外,合適的發酵條件也是不可忽視的重要因素[10-11]。為了提高小麥根腐病菌發酵液活性物質的產量,本研究通過單因子試驗和正交試驗,對其發酵培養基成分及搖床發酵條件進行研究,以期得到最利于產生除草活性物質的發酵條件。本試驗得出的最佳碳源為葡萄糖,最適初始pH 7.0。康紹蘭等[12]的研究表明,最適合小麥根腐病菌菌株產生活性物質的碳源是淀粉,最適pH為4.0,這可能是因為微生物的次級代謝產物具有菌株特異性,且不同的發酵培養基配方或條件誘導不同的次級代謝產物的產生[13]。本試驗對于培養基配方對菌株活性物質產量的影響采用正交設計試驗,提高了工作效率和試驗結果的可靠性,后續試驗可對發酵濾液中的活性物質進行提取,以達到更好的效果。
[1]Li Y Q,Sun Z L,Zhuang X F,et al.Research progress on microbial herbicides[J].Crop Protection,2003,22(2):247-252.
[2]Charudattan R,Dinoor A.Biological control of weeds using plant pathogens:accomplishments and limitations[J].Crop Protection,2000,19(8-10):691-695.
[3]強勝,郭愛民,李揚漢.大批量生產百日草鏈格孢菌孢子的技術[J].中國生物防治,1997,13(4):169-172.
[4]張金林,董金皋,樊慕貞,等.蔥葉枯病菌Stemphylium botryosum 毒素的分離與除草活性研究[J].農藥學學報,2001,3(2):60-66.
[5]鄭蒙,徐擴,董金皋.灰葡萄孢BC7-3菌株除草活性組分的純化與結構鑒定[J].微生物學報,2008,48(10):1362-1366.
[6]Zhang J L,Zhang L H,Liu Y C,et al.The herbicidal activity of mutant isolates from Botrytis cinerea[J].Agricultural Sciences in China,2006,5(8):622-628.
[7]孫巍,張蕾,吳迪,等.微生物除草劑的研究進展與展望[J].微生物學雜志,2006,26(2):88-91.
[8]姜述君,范文艷,鞠世杰,等.狹卵鏈格孢菌株AAEC0523及毒素對稗草的致病性[J].植物保護學報,2007,34(3):283-288.
[9]谷祖敏,紀明山,張楊,等.草莖點酶粗毒素的除草活性和殺草譜研究[J].沈陽農業大學學報,2009,40(4):431-434.
[10]魏松紅,付丹妮,逄若霖,等.除草活性放線菌DN5發酵條件及發酵產物理化性質的研究[J].中國生物防治學報,2011,27(2):246-253.
[11]Saudagar P S,Singhal R S.Optimization of nutritional requirements and feeding strategies for clavulanic acid production by Streptomyces clavuligerus[J].Bioresource Technology,2006,98(10):2010-2017.
[12]康紹蘭,劉國勝,董金皋,等.幾種植物病原真菌致病毒素的初步研究(I)[J].河北農業大學學報,1995,18(4):105-111.
[13]王智文,劉訓理,何亮,等.Cp-S316菌株發酵培養基的優化及其對煙草赤星病菌的抑制作用[J].農業環境科學學報,2007,26(2):723-728.

