塞來昔布對急性白血病原代細胞凋亡的影響*
王瑞麗 阮林海 葛曉華
塞來昔布是一種選擇性環氧合酶-2(COX-2)的抑制劑,是目前唯一被FDA批準治療家族性腺瘤性息肉患者的輔助治療的非甾體抗炎藥,但塞來昔布的抗癌效果及分子機制尚不清楚。有研究表明,非甾體抗炎藥(NSAIDs)通過抑制環氧化酶(COX),而此酶是催化花生四烯酸向前列腺素轉化的關鍵酶,且誘導型環氧合酶-2(COX-2)的過表達與前 列腺素E的水平有關,從而抑制腫瘤細胞增殖、誘導細胞凋亡[1-2]。已有研究證實,COX-2在結腸癌、乳腺癌、肺癌、前列腺癌、皮膚癌、宮頸癌、胰腺癌、卵巢癌、膀胱癌和頭頸部惡性腫瘤中均呈高表達[3]。這表明COX-2在腫瘤細胞中的過度表達與各種癌癥的促進有關。目前,塞來昔布對血液系統腫瘤的研究較少,國外有學者研究塞來昔布對人類慢性髓系白血病細胞株的影響,結果表明塞來昔布在體外能誘導人慢性髓性白血病細胞系K562細胞凋亡,這說明塞來昔布在開發用于治療慢性粒細胞白血病抗癌藥物方面具有廣泛的前景[4]。但這些研究對象僅限于細胞系,且塞來昔布對急性白血病原代細胞的影響在國內外報道較少,因此,本研究以塞來昔布作用于急性白血病原代細胞,觀察其對白血病細胞增殖及凋亡的影響,以期更能反映其抗白血病的作用,為臨床尋找白血病新的藥物提供理論依據。
1 資料與方法
1.1 一般資料 收集2010年2月-2011年7月河南科技大學第一附屬醫院血液科初診未治的急性白血病患者16例,其中男10例,女6例,年齡5~68歲,中位年齡36歲。急性髓系白血病患者12例(M26例,M33例,M53例),急性淋巴細胞白血病患者4例(L13例,L21例),所有患者均符合國內診療標準[5],全部病例均除外合并心、肝、腎功能異常及合并感染,除外合并其他惡性腫瘤及自身免疫性疾病。Ficoll密度梯度離心法取患者骨髓單個核細胞分離,接種于含體積分數為10%滅活的胎牛血清的RPMI1640培養基中常規培養。
1.2 儀器與試劑:COX-2細胞培養箱(MCO-175日本SANYO)、普通及倒置顯微鏡(GIX-DH-40 45 德國Leica)、凈化工作臺(SP-DJ-2B 金壇榮華),酶標儀(ELX800 美國Bio-Tek)、COX-2抑制劑塞來昔布膠囊(系輝瑞公司生產)、改良型RPMI1640培養基(批號:NWBO377)、胎牛血清(TBD公司)、四甲基偶氮唑鹽(美國Sigma公司)、Annexin V-FITC試劑盒(美國Bender Medsystems公司)、流式細胞儀EPILSXL(Beckman-Coulter公司 )。
1.3 方法
1.3.1 MTT法測定塞來昔布對急性白血病原代細胞增殖的抑制作用 取急性白血病指數生長期的細胞,調整細胞濃度為1×105個/ml,接種于3個96孔板中,每孔細胞懸液100 μ1,加入用RPMI1640培養液稀釋的塞來昔布,使其終濃度分別為0、20、40、60、80、100、120 μmol/L,并各設 5個復孔,同時設對照組(0 μmol/L),每組細胞培養不同時間(24、48和72 h),實驗結束前4 h,每孔加入MTT(5 mg/ml)10 μl,再繼續培養4 h后從培養箱中取出,每孔各加入100 μl 10%十二烷基磺酸鈉(SDS)終止反應,37 ℃存放過夜,用酶標儀570 nm波長檢測A值。根據如下公式計算細胞抑制率:細胞生長抑制率 (對照組A值-實驗組A值)/對照組A值 100%。
1.3.2 80 μmoL/L的塞來昔布作用48 h后細胞形態學觀察在細胞培養瓶里,用倒置顯微鏡分別觀察對照組和實驗組的細胞生長狀況和形態學改變。
1.3.3 Annexin V/PI 雙標記法檢測細胞凋亡率 24 h后離心收集各組細胞,PBS洗滌,分別取6×105~10×105個細胞根據Annexin V-FITC試劑盒(美國Bender Medsystems 公司)說明書進行細胞凋亡檢測,用1∶4的binding buffer緩沖液180 μl重懸細胞,加入異硫氰酸熒光素(FITC)標記的AnnexinVFITC 5 μl和 20 μg/ml PI 10 μl,置冰上作用10 min,流式細胞儀檢測。
1.4 統計學處理 采用SPSS 13.0統計軟件對所有數據進行處理,實驗數據均以(s)表示,比較采用t檢驗,多組間比較采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1 塞來昔布對急性白血病原代細胞的生長抑制作用 藥物干預后,各濃度組細胞增殖均受到明顯抑制,呈劑量和時間依賴性(P<0.05),見圖1。
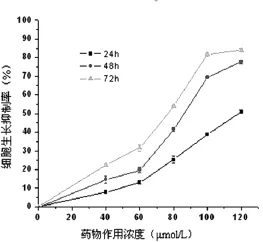
圖1 塞來昔布對急性白血病原代細胞的抑制
2.2 80 μmoL/L的塞來昔布作用48 h后細胞形態改變 對照組細胞呈圓形,輪廓清晰,胞體透亮,生長旺盛,懸浮成團呈“葡萄樣”生長,為典型的白血病細胞形態。實驗組細胞體積縮小,細胞皺縮,集落減少,細胞中顆粒增多,細胞碎片明顯增多。
2.3 塞來昔布對急性白血病原代細胞凋亡的影響 藥物作用24 h后,對照組細胞凋亡率為(3.98 0.6)%,實驗組40、60、80 μmol/L濃度的凋亡率分別為(8.1 0.9)%、(10.97 1.4)%、(19.78 2.3)%,與對照組相比實驗組凋亡率均明顯增高,差異具有統計學意義(P<0.01),見圖2。
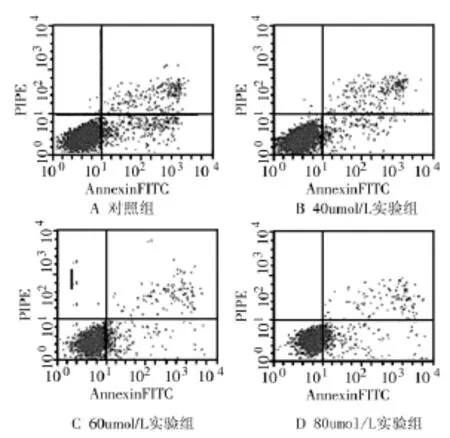
圖2 Annexin V-FITC/PI雙標記法檢測細胞凋亡
3 討論
事實上,目前大多數的化療藥物都是通過誘導細胞凋亡而清除腫瘤細胞的,在血液系統惡性腫瘤的治療上,目前常用的化療藥物如烷化劑、蒽環類、抗代謝類等都能引起相應瘤細胞凋亡,這可能與活化Caspase和鈣離子依賴性核酸酶有關。此外,紫杉醇是通過抑制微管解聚使腫瘤細胞有絲分裂終止促進腫瘤細胞凋亡達到抗腫瘤效應的。基于細胞凋亡異常在許多人體惡性腫瘤的發病學上占有十分重要的地位,有理由相信隨著對細胞凋亡發生機制的深入認識,可望在惡性腫瘤的治療學上取得新的突破,以選擇性地誘導腫瘤細胞凋亡為目標的凋亡干預技術很可能成為治療惡性腫瘤的基本策略。
研究表明,塞來昔布是高度選擇性的COX-2抑制劑,能夠誘導細胞發生凋亡,具有廣泛的抗腫瘤作用,其作用機制主要是調控癌基因和抑癌基因的表達,抑制COX-2的活性,誘導細胞周期停滯和細胞凋亡等途徑來誘導實體瘤細胞凋亡[6-7]。目前,特異性COX-2抑制劑塞來昔布對白血病的作用研究較少,且僅限于細胞系。因此,本實驗研究了塞來昔布干預下的急性白血病原代細胞增殖情況,MTT法發現塞來昔布對急性白血病原代細胞具有明顯增殖抑制作用,且隨著作用濃度和時間的增加,增殖抑制率從7.86%提高到83.89%,呈時間和劑量依賴關系(P<0.05)。形態學觀察發現80 μmol/L的塞來昔布作用48 h后細胞體積皺縮,集落減少,細胞中的顆粒增多,細胞碎片較對照組明顯增多。Annexin V-FITC/PI雙標記法檢測細胞經不同濃度的塞來昔布處理24 h后,對照組和實驗各組凋亡率有明顯的差異,且發現實驗組白血病原代細胞早期凋亡率隨著藥物濃度的增加,凋亡率呈逐漸增高趨勢,對照組為(3.98 0.6)%,實驗組從(8.1 0.9)%增加到(19.78 2.3)%,這說明塞來昔布能夠誘導白血病原代細胞的凋亡且具有劑量依賴性。細胞凋亡是一個復雜的程序,而Bcl-2基因是血液系統惡性腫瘤中最為重要的抗凋亡基因,在一些白血病中呈過度表達。原癌基因Bcl-2定位于18號染色體臂2區1帶,它的生理功能主要通過阻遏細胞凋亡而延長細胞的生存時間。此外,Bcl-2蛋白家族的成員通過阻止線粒體細胞色素C的釋放而發揮抗凋亡的作用,同時Bcl-2可與bax基因組成同源二聚體或異源二聚體來抑制Bcl-2的作用而發揮促進細胞凋亡的功能,這與細胞凋亡動態平衡有關[8-9]。Rudner等[10]用塞來昔布干預Jurkat淋巴瘤細胞后,發現抗凋亡Bcl-2相關蛋白有關的Mcl-1迅速降低,而Mcl-1的下降足以誘導細胞凋亡,同時指出塞來昔布除了抑制COX-2有關外,還可通過Bcl-2家族成員控制的內在途徑誘導細胞凋亡。Liu等[11]在塞來昔布誘導骨肉瘤細胞凋亡的研究中認為,塞來昔布發揮抗腫瘤效應與survivin和Bcl-2下調有關。Pyrko等[12]認為,塞來昔布發揮抗腫瘤的作用與下調survivin有關。目前認為,Caspases活性變化是調節細胞凋亡的重要機制,當凋亡過程啟動后,Caspases酶原變成有活性的Caspases,從而產生“瀑布式”效應,最終導致細胞凋亡,其中起核心作用的是Caspases-3,研究表明藥物或某些生物活性因子所誘導的白血病細胞凋亡中,Caspases-3活性變化起了重要的作用[13-14]。總之,塞來昔布誘導凋亡的作用機制非常復雜,需要進一步深入地研究。
然而筆者必須考慮到,本實驗研究進行的體外培養急性白血病細胞并不能完全代表復雜的體內環境,此外樣本數量有限,因此,塞來昔布誘導白血病細胞的凋亡的機制仍需深入研究。然而,本項研究證實了塞來昔布能夠誘導白血病細胞的凋亡,且隨著濃度的增加凋亡率升高,這將為臨床探討治療白血病新的藥物提供理論依據,同時也為白血病的治療方法提供一個新的思路。
[1]Husain S S,Szabo I L,Tamawski A.NSAID inhibiton of GI cancer growth:clinical implications and molecular mechanisms of action[J].Am J Gastroenterology,2002,97(3):542-553.
[2]Brown J R,DuBois R N.COX-2:a molecular target for colorectal cancer prevention[J].Clin Oncol,2005,23(12):2840-2855.
[3]Andrew J,Dannenberg N K,Altorki J O,et al.Subbaramaiah,Cyclo-oxygenase 2:a pharmacological target for the prevention of cancer[J]Lancet Oncol,2001,2(9):544-551.
[4]Subhashini J,Mahipal S V,Reddanna P.Anti-proliferative and apoptotic effects of celecoxib on human chronic myeloid leukemia in vitro[J].Cancer lett,2005,224(1):31-43.
[5]張之南,沈悌.血液病診斷及療效標準[M].第3版.北京:北京科學出版社.2007:131-134.
[6]Mustafa C,Suleyman B,Muzaffer D,et al.Overexpression of cyclooxy- genase-2 in multiple myeloma: aassociation with reduced survival[J].Am J of Hematology,2005,80(3):169-173.
[7]Wei C,Chang-hong YU,Ke-qin HU.In vitro and in vivo effects and mechanisms of celecoxib-induced growth inhibition of human hepatocellular carcinoma cells[J].Clin Cancer Res,2005,11(22):8213-8221.
[8]Adams J M,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J].Oncogene,2007,26(9):1324-1337.
[9]Yo R J,Strasser A.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
[10]Rudner J,Elsaesser S J,Jendrossek V.Anti-apoptotic Bcl-2 fails to form efficient complexes with pro-apoptotic Bak to protect from Celecoxib-induced apoptosis[J].Biochemical Pharmacology,2011,81(1):32-42.
[11]Liu B,Shi Z L,Feng J,et al.Celecoxib,a cyclooxygenase-2 inhibitor,induces apoptosis in human osteosarcoma cell line MG-63 via down-regulation of PI3K/Akt[J].Cell Biol int,2008,32(5):494-501.
[12]Pyrko P,Soriano N,Kardosh A,et al.Downregulation of survivin expression and concomitant induction of apoptosis by celecoxib and its non-cyclooxygenase-2 inhibitory analogdimethy-celecoxib(DMC),in tumor cells in vitro and in vivo[J].Mol Cancer,2006,5(19):1476-1478.
[13]Jerome K R,Sloan D D,Aubert M,et al.Measurement of CTL-induced cytotoxicity: the caspase 3 assay[J].Apoptosis,2003,8(6):563-571.
[14]Fujimura S,Suzumiya J,Yamada Y.Downregulation of Bcl-xL and activation of caspases during retinoic acid-induced apoptosis in an adult T-cell leukemia cell line[J].Hematol,2003,4(5):328-335.

