全反式維甲酸抑制兔頸動脈內皮損傷后內膜增殖和聚集素表達的研究
李彥飛 王愛民 鄭舒 董果雄
全反式維甲酸(all-trans retinoic acid,atRA)是維生素A的 天然衍生物,它可通過調節多種生物活性因子的表達、阻滯細胞周期進程從而抑制血管平滑肌細胞(smooth muscle cell,SMC)的遷移、增殖,并促進凋亡,發揮抗血管內膜增殖作用[1,2]。聚集素是一個多功能蛋白質,它具有促進細胞聚集的作用,能促進血管平滑肌細胞增殖,對內皮損傷后血管內膜增殖也有不利影響[3],本實驗旨在觀察血管內皮損傷后聚集素的表達情況和atRA對聚集素表達的影響,探討atRA對血管再狹窄的作用及機制。
1 材料與方法
1.1 材料 健康新西蘭雄性大白兔36只,4個月齡,體重(2.5±0.12)kg,購自青島市動物實驗中心。atRA(重慶華邦制藥公司),膽固醇(上海化學制劑公司),兔抗兔聚集素,SABC試劑盒(武漢博士德公司),鼠抗兔增殖細胞核抗原[(proliferating cell nuclear antigen,PCNA(北京中杉)],ElivisionTM plus試劑盒(福州邁新),Masson三色試劑盒(福州邁新),奧林巴斯BX50顯微鏡,Image-Pro Plus圖像分析系統。
1.2 方法
1.2.1 動物分組及模型制作:36只新西蘭大白兔按體重隨機分為6 組:治療組(A、B)、對照組(A、B)、假手術組(A、B),每組6只。治療組和對照組每天進食150 g高脂飼料,含6.0%豬油、1.5%膽固醇、92.5%基礎飼料;假手術組每天喂養150 g基礎飼料;均自由飲水。喂養2周后行頸動脈內膜空氣干燥術,假手術組手術但不損傷內膜。治療組術前3 d開始給予atRA 6mg·kg-1·d-1,溶于 1ml植物油中灌胃至處死,對照組、假手術組給予等量植物油灌胃。
內膜空氣干燥術:經耳緣靜脈注射0.25 kg/L的烏拉坦1.0 g/kg,麻醉良好后頸部脫毛消毒,取頸正中縱形切口,分離右頸總動脈2.0cm,選擇無分支段,動脈夾夾閉兩端,4.5 G針頭平行穿刺阻斷血管的兩端,0.9%氯化鈉溶液沖洗血管腔,向夾閉段的頸總動脈內以120ml/min速度注入空氣10min,管腔內重新注入0.9%氯化鈉溶液,放開動脈夾,壓迫穿刺處約10min止血,觀察血流通暢后逐層縫合。術后給予青霉素40萬 U,肌內注射,1次/d,連續3 d。
分別于術后第7天、28天處死A、B組動物,取病變部位血管等距切分4~5段,10%中性緩沖甲醛固定,石蠟包埋。血管標本橫截面連續切片,厚度4 μm,間隔100 μm再次切片,共切3個層面。
1.2.2 形態學測定:切片行HE染色及Masson染色,顯微鏡下觀察血管結構,用Image-Pro Plus進行圖像分析,每例動物觀察3張切片,測定每張切片上各個血管截面的內膜面積、中膜面積、內膜/中膜面積比、管腔狹窄度,管腔狹窄度=內膜面積/內彈力板下面積×100%,取平均值。
1.2.3 免疫組化檢測聚集素、PCNA表達:用SABC三步法進行聚集素免疫組化染色,3%過氧化氫滅酶,微波修復,一抗稀釋度1∶200,4℃過夜,DAB顯色,蘇木素復染,胞核及胞漿棕黃、棕褐色為陽性。PBS代替一抗作陰性對照。用IPP進行圖像分析,隨機測量每張切片中6個高倍視野的陽性部位平均光密度和陽性面積百分比,取其平均值,二者乘積乘以100為陽性表達指數。
二步法進行PCNA染色,微波修復,3%過氧化氫滅酶,一抗稀釋度1∶100,室溫孵育1 h,DAB顯色,蘇木素復染,胞核棕黃、棕褐色為陽性。PBS代替一抗作陰性對照。計數陽性胞核占總胞核比例,乘以陽性胞核平均光密度,二者乘積乘以100為PCNA陽性表達指數,其他分析過程同聚集素。
1.3 統計學分析應用SPSS 11.0統計軟件,計量資料以表示,采用t檢驗或方差分析,組間比較采用S-N-K法,P<0.05為差異有統計學意義。
2 結果
實驗動物無死亡或患病,未發現手術部位感染,切口愈合良好。
2.1 血管組織形態情況 假手術組兔頸動脈血管內皮細胞完整,內膜無增厚,7 d和28 d血管結構無明顯差別。對照組術后7 d時血管內皮再生,尚未完全覆蓋管腔,內彈力板多處斷裂,有SMC遷移入內膜,內膜開始增厚,可見泡沫細胞。28 d時血管腔表面凹凸不平,鏡下見動脈內膜明顯增厚,管腔狹窄,內膜層有大量SMC增生,排列紊亂,胞核形態不一。還可見到典型動脈粥樣硬化偏心性狹窄,內膜有泡沫細胞聚集,中膜亦有SMC向泡沫細胞轉變。治療組病變與對照組相似,但術后28 d時內膜增厚程度明顯輕于對照組,泡沫細胞較少。術后7 d時治療組的內膜面積、內膜/中膜面積比、管腔狹窄度與對照組比較,差異無統計學意義(t=1.004~1.502,P >0.05),術后28 d時治療組的內膜面積、內膜/中膜面積比、管腔狹窄度均低于對照組(t=4.770,t=5.092,t=3.802,P <0.01),術后7 d各組間、28 d各組間中膜面積差異無統計學意義(F=1.723、F=1.234,P >0.05)。見表 1。
表16 組血管形態學比較 n=6,
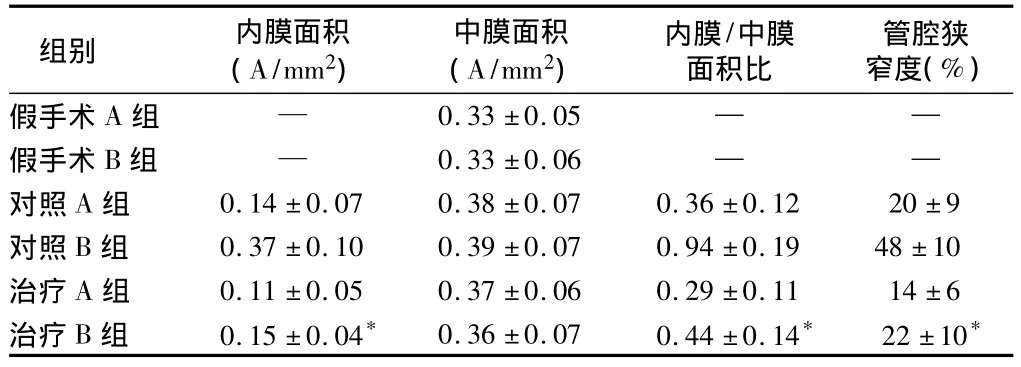
表16 組血管形態學比較 n=6,
注:與對照B組比較,*P <0.01
組別 內膜面積(A/mm2)中膜面積(A/mm2)內膜/中膜面積比管腔狹窄度(%)假手術A組 — 0.33±0.05— —假手術B組 — 0.33±0.06 — —對照 A 組 0.14 ±0.07 0.38 ±0.07 0.36 ±0.12 20 ±9對照 B 組 0.37 ±0.10 0.39 ±0.07 0.94 ±0.19 48 ±10治療 A 組 0.11 ±0.05 0.37 ±0.06 0.29 ±0.11 14 ±6治療 B 組 0.15 ±0.04* 0.36 ±0.07 0.44 ±0.14* 22 ±10*
2.2 atRA對聚集素、PCNA表達的影響 假手術組術后7 d、28 d未見聚集素表達。對照組術后7 d時,聚集素在新生內皮層和中膜SMC表達,術后28 d時(圖1)表達增強,血管各層均有表達,細胞間質也有表達,在新生內膜深面及中膜靠近內彈力板處、粥樣硬化斑塊部位明顯,可見泡沫細胞表達。治療組聚集素表達部位規律與對照組相同,但術后7 d、28 d時(圖1)陽性表達指數低于對照組。見表2。
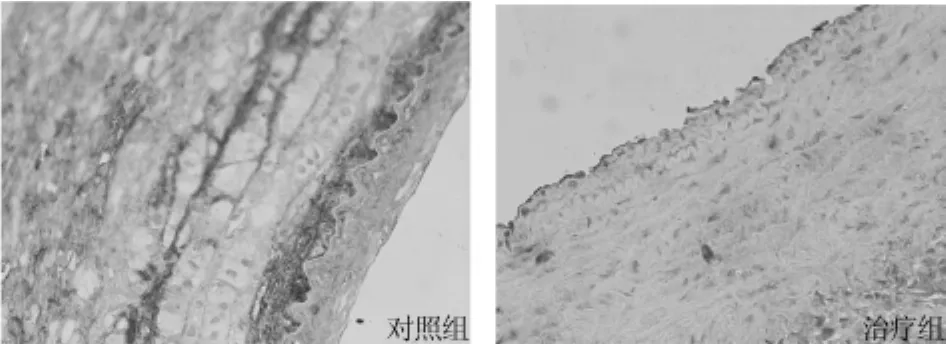
圖1 空氣干燥術后28 d聚集素表達(免疫組化×200)
2.3 假手術組偶見微量PCNA表達 對照組術后7 d時,PCNA在新生內膜和中膜強表達,陽性胞核體積較大,有異型性,術后28 d時陽性表達指數下降,內皮細胞、SMC及泡沫細胞表達。治療組表達部位規律與對照組一致,但7 d、28 d時表達均明顯低于對照組(P <0.05或 <0.01)。見表2。
表2 atRA對聚集素、PCNA陽性表達的影響 n=6,
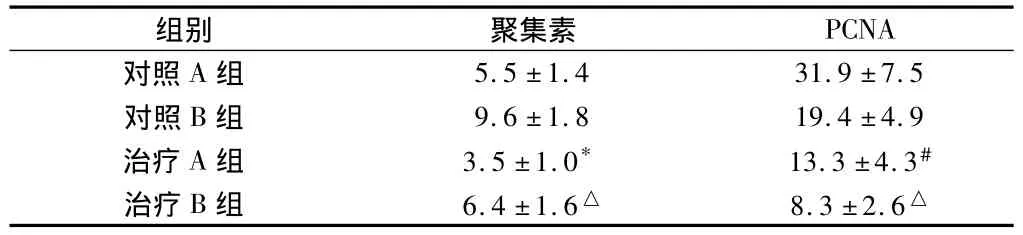
表2 atRA對聚集素、PCNA陽性表達的影響 n=6,
注:與對照 A 組比較,*P <0.05,#P <0.01;與對照 B 組比較,△P <0.01
PCNA對照A組組別 聚集素5.5 ±1.4 31.9 ±7.5對照 B 組 9.6 ±1.8 19.4 ±4.9治療 A 組 3.5 ±1.0* 13.3 ±4.3#治療B 組 6.4±1.6△ 8.3±2.6△
3 討論
在本實驗中我們應用PCNA來檢測細胞的增殖狀況,PCNA是DNA多聚酶δ的輔助蛋白,在DNA合成時促進DNA的延長,在G1期晚期和S期表達,是細胞進入并通過S期所必需的,可作為反映細胞增殖程度的可靠指標。
在高脂飲食和內皮損傷后,PCNA表達明顯增加,在28 d時有所下降仍顯著高于正常動脈,細胞呈現出一種過度增殖狀態。應用atRA后明顯減輕了血管PCNA的表達,表明atRA對血管壁的多種細胞、尤其SMC的增殖起到了抑制作用,進而下調了這種高增殖狀態。
聚集素是一個分泌型的糖蛋白,它作用廣泛,在體外具有促進細胞聚集的作用,和多種疾病如糖尿病、動脈硬化、腫瘤、腎臟及神經系統疾病有密切關系。Kim等[4]觀察到聚集素通過抑制TNF-a刺激MCP-1、ICAM-1、VCAM-1、MMP-9等的表達,抑制血管SMC的遷移,并能抑制血管SMC的DNA合成,腺病毒轉染聚集素可以抑制球囊損傷大鼠頸動脈的新生內膜增厚,認為在血管損傷后聚集素的上調可能起到了保護性作用。但更多證據表明聚集素具有促進SMC的增殖和遷移的作用,并能抑制細胞凋亡[3,5]。抑制聚集素表達可以減輕血管SMC的增殖,聚集素基因敲除還可以減輕大鼠的動脈粥樣硬化病變[6,7]。
我們觀察到在血管內皮損傷后聚集素開始表達,自術后7~28 d呈升高趨勢,強表達于新生內膜、中膜,細胞及細胞間質均有出現。在增生較重內膜、粥樣硬化斑塊部位最明顯,與PCNA表達一致,表明它的過度表達刺激了血管內膜、中膜細胞的大量增殖,推測細胞間質的聚集素對細胞的遷移、叢聚也起到了促進作用,最終導致了血管內膜增殖、血管重塑。應用atRA后明顯下調了聚集素的表達,與對照組比較差異顯著。通過抑制聚集素的促血管SMC遷移、增殖等作用,atRA改善了內皮損傷后的血管重塑。這與Orlandi等[5]的結果一致。研究表明聚集素和動脈粥樣硬化相關,血清聚集素水平可以作為冠心病的標記物之一[8]。其可行性有待進一步證實。
本實驗結果表明,高脂飲食及內皮損傷后,血管組織聚集素持續、過多地表達,刺激了SMC等細胞遷移、增殖,最終導致了血管再狹窄病變形成。應用atRA能明顯減輕內皮損傷后內膜增殖和血管再狹窄,抑制聚集素表達分泌是其機制之一。
1 褚現明,李冰,杜日映,等.P27對大鼠胸主動脈球囊損傷后管腔狹窄的作用.中國動脈硬化雜志,2006,14:417-421.
2 李彥飛,董果雄,張社華.全反式維甲酸對兔頸動脈內皮損傷后內膜增殖和VEGF及VCAM-1表達的影響.青島大學醫學院學報,2009,45:101-103.
3 Miyata M,Biro S,Kaieda H,et al.Apolipoprotein J/clusterin is induced in vascular smooth muscle cells after vascular injury.Circulation,2001,104:1407-1412.
4 Kim HJ,Yoo EK,Kim JY,et al.Protective role of clusterin/apolipoprotein J against neointimal hyperplasia via antiproliferative effect on vascular smooth muscle cells and cytoprotective effect on endothelial cells.Arterioscler Thromb Vasc Biol,2009,29:1558-1564.
5 Orlandi A,Pucci S,Ciucci A,et al.Modulation of clusterin isoforms is associated with all-trans retinoic acid-induced proliferative arrest and apoptosis of intimal smooth muscle cells.Arterioscler Thromb Vasc Biol,2005,25:348-353.
6 Shirasawa T,Miyata M,Eto H,et al.Deficiency of clusterin inhibits neointimal hyperplasia after vascular injury.J Atheroscler Thromb,2009,16:772-781.
7 Hamada N,Miyata M,Eto H,et al.Loss of clusterin limits atherosclerosis in apolipoprotein e-deficient mice via reduced expression of Egr-1 and TNF-α.J Atheroscler Thromb,2011,18:209-216.
8 Poulakou MV,Paraskevas KI,Wilson MR,et al.Apolipoprotein J and leptin levels in patients with coronary heart disease.In Vivo,2008,22:537-542.

