廢用狀態下大鼠骨骼肌再負荷對比目魚肌calpain活性和肌細胞膜通透性的影響*
何 越, 高云芳, 張少穎, 張揚媚, 孫小勇, 王慧平
(西北大學生命科學學院,陜西西安710069)
廢用(不活動、臥床與航天飛行等)狀態下2周左右,骨骼肌即可出現明顯的萎縮[1]。萎縮的骨骼肌不僅收縮張力下降、疲勞性增加[2],在再負荷時還會導致骨骼肌損傷[3-4],從而嚴重影響骨骼肌的再適應能力,威脅航天員的航天飛行安全,增加航天員返回地面時的受傷風險。相關研究表明,廢用引起的肌纖維橫截面積的減小和收縮蛋白的丟失是肌肉收縮功能下降的主要原因[5],但骨骼肌收縮蛋白的減少機制以及萎縮骨骼肌再負荷引發的骨骼肌損傷機制遠未明了。
鈣蛋白酶(calpain)是存在于胞質中的Ca2+依賴性的半胱氨酸蛋白水解酶,參與肌肉生長與分化、細胞周期調控和凋亡等重要生理過程,近年的相關研究還發現鈣蛋白酶與廢用性肌萎縮的發生有關[6]。肌肉萎縮會引起肌肉運動能力的下降,其中一個重要的因素是蛋白質合成減少和降解能力增強。泛素-蛋白酶體是廢用狀態下收縮蛋白降解的主要途徑,但是,它不能降解完整的肌原纖維,而是首先激活calpain以降解膜骨架蛋白,使肌原纖維從細胞骨架上脫落,從而完成蛋白降解,故可認為calpain是廢用狀態下骨骼肌蛋白降解的啟動子[7]。大鼠后肢去負荷2周后,骨骼肌出現明顯萎縮,肌細胞內鈣離子水平明顯上升,細胞內鈣水平的升高會促使calpain轉移至細胞膜上并激活,釋放出具有活性的催化亞單位,啟動并降解細胞骨架蛋白,如desmin、肌鈣蛋白等,繼而啟動泛素-蛋白酶體的蛋白水解途徑,造成肌纖維的損傷。有研究表明大鼠在經歷14 d模擬失重后的再負荷會產生離心樣損傷,如骨架蛋白降解、Z線結構破壞、過度扭曲等[3],但具體機制尚不明了。細胞膜通透性的異常改變是細胞微損傷的標志之一,故本實驗以骨骼肌細胞膜通透性與calpian活性為主要指標,探討廢用狀態及廢用后再負荷對大鼠比目魚肌的影響及骨骼肌的損傷機制。
材料和方法
1 動物與分組
健康SD雌性大鼠,7周齡,體重210~230 g(西安交通大學醫學院實驗動物中心提供,陜動字第08-005號),自由飲食飲水。分組前對大鼠進行跑臺能力測試,剔除不能適應跑臺運動的個體。按體重配對原則將48只合格大鼠隨機分為4組,正常對照組(control,CON)、正常運動組(CON+training,CON+T)、吊尾2周組(tail-suspension,TS)和吊尾2周后強迫運動組(TS+T),每組12只,6只用于膜通透性實驗,6只用于鈣蛋白酶活性測定。吊尾組采用尾部懸吊法建立大鼠后肢骨骼肌廢用模型[8]。運動組利用動物跑臺強迫大鼠運動,將大鼠置于跑臺上,通過電刺激和聲刺激驅使大鼠運動,跑臺速度設置為16 m/min,跑3次,每次10 min,間歇5 min。
2 廢用性肌萎縮模型的建立
大鼠尾部懸吊14 d,在干凈及干燥的尾部表面噴涂安息酊和松香酊,并吹干,用醫用膠布粘貼于大鼠干凈尾部的后半部,固定尾部,膠布另一頭連接在懸吊籠頂部可360°旋轉的轉接環上,保持大鼠身體與水平面呈30°,前肢著地自由活動,自由飲食飲水。大鼠單籠飼養,懸吊籠寬30 cm,長35 cm,高45 cm,四壁為有機玻璃。飼養室室溫20~25℃,人工控制室內照明,每晝夜均保持12 h光照與黑暗的循環交替。
3 主要試劑和儀器
伊文思藍(Evans blue,EB)和casein(Sigma);Mini-PROTEAN垂直電泳槽(Bio-Rad);DMI6000B倒置熒光顯微鏡及拍攝裝置、CM1850恒冷冰凍切片機(Leica);UV2550紫外分光光度計(島津);HZ66-Z動物跑臺(北京中西遠大有限公司);考馬斯亮藍法試劑盒(南京建成生物研究所)。
4實驗指標的測試
4.1 大鼠比目魚肌肌纖維橫截面積(cross-sectional area,CSA)和肌重體重比的測量 在進行后續實驗前用電子天平對取出的比目魚肌稱重,圖像分析儀測量比目魚肌切片圖像中單根肌纖維的橫截面積。
4.2 EB檢測膜通透性改變 大鼠稱重后,用45 mg/kg戊巴比妥鈉腹腔注射進行麻醉,然后通過頸靜脈插管注射3%EB熒光染液,待EB在大鼠體內循環2 h后取大鼠后肢比目魚肌,稱重,然后剪成4 mm×4 mm×4 mm的肌肉小塊,置于液氮預冷過的異戊烷內冷凍,然后用OCT包埋劑包埋,放入冷凍切片機內準備切片。
將OCT包埋的肌肉樣品連續切片,厚度為4μm,選擇比較好的切片粘貼到浸泡過多聚賴氨酸的載玻片上,使切片完全展開,然后放在冷丙酮中固定5~10 min,中性樹膠封片。在倒置熒光顯微鏡下以綠色激發光觀察、拍照,每個樣本進行多個視野測量,觀察EB在肌肉組織中的分布。
4.3 酪蛋白酶譜法測calpain活性 用相同方法將大鼠麻醉,取大鼠一側后肢比目魚肌,以1 g∶40 mL的比例加勻漿緩沖液(20 mmol/L Tris-HCl,5 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L DTT,pH7.4),在冰槽中剪碎,用勻漿器以30 000 r/min轉速制成組織勻漿,得到組織勻漿液,然后低溫8 000 r/min離心15 min,取上清存放于1.5 mL EP管中,置于-70℃存放備用。
考馬斯亮藍法測量各組樣品的蛋白濃度。每個樣品取80 μg蛋白與適量的 5×上樣緩沖液 (150 mmol/L Tris-HCl,20%glycerol,2 mmol/L 2-巰基乙醇,0.004%溴芬藍,pH 6.8)混勻。酪蛋白酶譜法分析calpain活性[9],稍作修改。配制12% 含casein的分離膠(Acr∶Bis=37.5∶1,0.2%casein,Tris-HCl 375 mmol/L,0.04%AP,0.28%TEMED,pH 8.8),濃縮膠成分為(Acr∶Bis=37.5∶1,Tris-HCl 330 mmol/L,0.04%AP,0.28%TEMED,pH 6.8),電泳緩沖液為(25 mmol/L Tris base,192 mmol/L glycine,1 mmol/L EDTA,1 mmol/L DTT,pH 8.3)。安裝好電泳系統,置于冰浴中,先125 V預電泳20 min,然后將等體積約80 μg蛋白樣品進行上樣,先80 V電泳30 min,然后轉至125 V電泳4.5 h,使calpain 1和F2分離開。在室溫下,將凝膠放在水解緩沖液(25 mmol/L Tris-HCl,10 mmol/L DTT,5 mmol/L CaCl2,pH 7.3)中漂洗2次,每次15 min,然后將凝膠在水解緩沖液中孵育20~24 h,同時輕輕搖動。反應結束后,在考馬斯亮藍(R-250)染色液中染色1 h,脫色液脫色2 h。含有calpain條帶的膠由于對酪蛋白的分解作用而染不上色,脫色后為淺色的分解條帶。通過紫外凝膠成像系統拍照,用ImageJ軟件分析凝膠條帶,以“淺染區”的水解條帶A值/蛋白上樣量反映calpain的水解活性。
5 統計學處理
數據采用SPSS 13.0統計軟件進行處理,采用單因素方差分析(One-way ANOVA)進行各組間的差異顯著性檢驗。對于不滿足方差齊性的,用ANOVA-Dunnett T3,進行各組間差異比較,以P<0.05為差異有統計學意義。
結果
1 比目魚肌單根肌纖維橫截面積和肌肉體重比的變化
正常組大鼠比目魚肌,細胞飽滿,富有彈性。吊尾組大鼠比目魚肌,呈長薄片狀,結締組織增多。吊尾組與正常組大鼠相比,比目魚肌濕重體重比減少了41.5%,肌纖維橫截面積也顯著減小(P<0.01),見表1。
2 比目魚肌肌纖維膜通透性的變化
EB與血液中的血清白蛋白結合物在綠色激發光下顯紅色,由圖1可以看出CON組(圖1A)和CON+T組(圖1B)的細胞形態飽滿、緊密,細胞間隙充有紅色熒光,毛細血管周圍有明顯染色,基本無EB染料進入細胞;TS組(圖1C),肌束間隙變大,結締組織增多,個別細胞充盈EB;TS+T組充盈EB的細胞數量明顯增多,有較多細胞出現EB的不完全進入(圖1D)。上述結果提示單純吊尾對肌纖維膜通透性的影響并不顯著,而吊尾后的強迫運動使膜通透性明顯升高,原本不能通過細胞膜的EB部分透過細胞膜進入細胞。
表1 吊尾和再負荷對大鼠比目魚肌重量和橫截面積的影響Table 1 .Effects of tail-suspension and reloading on the weight and cross-sectional area(CSA)of the soleus in rats (±s.n=6)
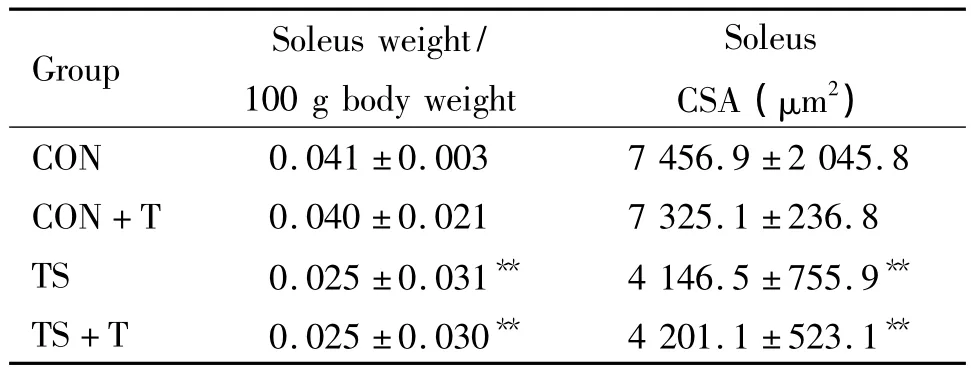
表1 吊尾和再負荷對大鼠比目魚肌重量和橫截面積的影響Table 1 .Effects of tail-suspension and reloading on the weight and cross-sectional area(CSA)of the soleus in rats (±s.n=6)
CON:control;T:training;TS:tail-suspension.**P<0.01 vs CON.
?
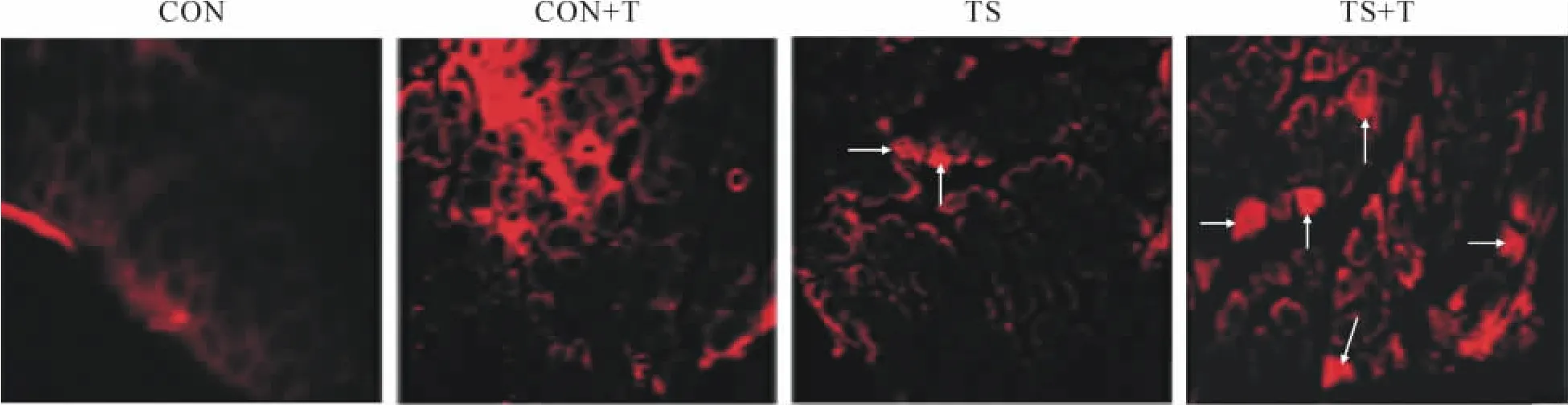
Figure 1.Changes of rat soleus muscle membrane integrity after tail-suspension and reloading detected by Evans blue(red fluorescence)tracing(×200).CON:control;T:training;TS:tail-suspension.The arrows indicate the cells stained by Evans blue.圖1 吊尾及再負荷對大鼠比目魚肌肌膜完整性的影響
3 比目魚肌calpain活性的變化
Calpain水解條帶顯示:單純吊尾和吊尾后強迫運動組的calpain 1和calpain 2活性均有不同程度的升高,見圖2。
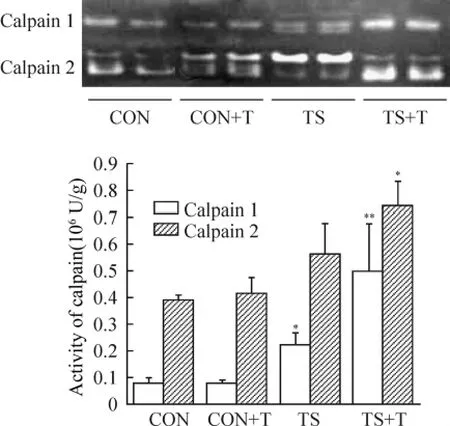
Figure 2.Changes of the activity calpain 1 and calpain 2 in rat soleus.±s.n=6.*P<0.05,**P<0.01 vs CON.圖2 大鼠比目魚肌calpain 1和calpain 2活性的變化
對calpain 1水解條帶的分析結果顯示,與正常對照組相比,吊尾組calpain 1的水解條帶吸光度明顯增加(P<0.05),最高可達到正常組的3倍,并有自激發條帶產生,表明calpain 1活性明顯升高;吊尾后強迫運動組的水解條帶更加明顯(P<0.01),表明廢用后再負荷可使calpain 1的活性進一步升高。
對calpain 2水解條帶的分析結果顯示,與正常組相比,吊尾組calpain 2的水解條帶吸光度增加,但差異無統計學意義(P>0.05),吊尾后強迫運動組的水解條帶吸光度有明顯升高(P<0.05),伴有自激發條帶的增強,表明廢用后再負荷使骨骼肌calpain 2的活性顯著升高。
討論
1 比目魚肌濕重體重比和肌纖維橫截面積的改變
大量研究表明,在廢用狀態下,肌肉萎縮最明顯的改變就是肌肉重量減輕。從本實驗結果看來,大鼠在經歷吊尾后,比目魚肌的重量明顯減小,肌纖維面積也大幅減小,這提示吊尾14 d后,大鼠的比目魚肌發生了明顯的萎縮。這也與前人以及本課題組以前的研究報道相一致。
2 比目魚肌肌纖維膜通透性的改變
EB是一種經典的示蹤劑,靜脈注射EB后,它可以與血清蛋白結合形成EB-白蛋白復合物,可用熒光顯微鏡在565 nm處檢測其分布。正常情況下該染料不能透過細胞膜,主要分布于細胞間隙,如果胞內出現EB,表明細胞膜的完整性破壞,出現微損傷,因此,這一熒光染料被廣泛用于檢測細胞膜的通透性[10]。
大鼠后肢骨骼肌在經歷14 d廢用狀態之后再負荷,引起了抗重力肌比目魚肌的損傷,使原本不能透過細胞膜的熒光染料EB可以透過細胞膜進入細胞,說明肌細胞膜的通透性發生了改變,膜的屏障功能受損。顯然,細胞膜損傷是廢用狀態及廢用后再負荷導致肌損傷的重要機制之一。這一結果為進一步探討萎縮骨骼肌的損傷機制提供了新的實驗資料。
3 比目魚肌calpain 1、2活性的改變
Calpain是一種依賴鈣離子的蛋白水解酶,迄今為止,在哺乳動物細胞內已經發現了至少14種calpain家族成員,其中,最主要的是calpain 1和calpain 2[11]。Calpain 1和2在體內都有一個最低鈣離子激活濃度,calpain 1為微摩爾級,calpain 2為毫摩爾級,calpain 1比2更易激活。已有研究表明多種因素可降低calpain激活所需的鈣離子濃度:(1)與細胞膜結合,有利于降解膜骨架蛋白;(2)內源性抑制劑calpastatin表達的減少;(3)提高Ca2+濃度,使calpain構象變化而表現蛋白水解酶活性;(4)calpain的自激活,自激活后,激活所需的鈣離子濃度則大幅降低,其機制尚不清楚。一個可能的原因是自激發后移去了其氨基端一段抑制酶活性的肽鏈而引起酶分子構象變化[12]。骨骼肌的廢用性萎縮,伴隨胞內鈣離子濃度的異常升高,當肌纖維內鈣離子濃度達到一定濃度時,激活calpains,釋放出具有活性的催化亞單位,進而降解骨架蛋白。使肌原纖維從細胞骨架上脫落,然后通過泛素-蛋白酶體降解途徑降解蛋白質,造成肌損傷。
本實驗通過酪蛋白酶譜法測定大鼠比目魚肌calpains的活性發現,廢用狀態下calpain 1、2的活性均高于正常對照組,這與Goll等[11]的研究相一致。有研究表明,大鼠后肢廢用后再負荷,肌纖維會發生進一步損傷,這可能是肌纖維進行離心樣收縮以及炎癥造成的[13]。本實驗也證實,在廢用狀態后再負荷時calpain活性的升高更加明顯,這可能與強迫運動造成胞內鈣離子濃度進一步升高以及由此誘發的鈣蛋白酶對蛋白降解的進行性增強有關[14]。其中calpain對膜骨架蛋白的降解可能是細胞膜完整性受損繼而導致細胞膜損傷的原因之一,但是,calpain對其底物的降解是否達到病理程度還需進一步驗證,這也是后續實驗需要完成的工作。
自上世紀90年代起,calpain活性的增加逐漸被認為是引發廢用性肌萎縮的關鍵因素之一[6,15],本研究為進一步認識calpain與廢用性肌萎縮的關系,特別是萎縮骨骼肌再負荷引發的肌損傷機制增加了新的實驗資料。
綜上所述,廢用狀態會造成大鼠比目魚肌萎縮,使大鼠比目魚肌calpain活性升高,但對比目魚肌肌細胞膜通透性影響較小;而骨骼肌廢用后的再負荷,會使calpain的活性進一步升高,對其作用底物的降解增強,比目魚肌肌細胞膜的通透性也明顯升高,膜的屏障功能受損。膜損傷是廢用狀態及廢用后再負荷導致肌損傷的重要表現之一,它可能與calpain水解肌細胞膜上的骨架蛋白有關。
[1] Williams D,Kuipers A,Mukai C,et al.Acclimation during space flight:effects on human physiology[J].CMAJ,2009,180(13):1317-1323.
[2] Leterme D,Falempin M.Contractile properties of rat soleus motor units following 14 days of hindlimb unloading[J].Pfluegers Arch,1996,432(2):313-319.
[3] Riley DA,Thompson JL,Krippendorf BB,et al.Review of spaceflight and hindlimb suspension unloading induced sarcomere damage and repair[J].Basic Appl Myol,1995,5(2):139-145.
[4] Lawler JM,Song W,Kwak HB.Differential response of heat shock proteins to hindlimb unloading and reloading in the soleus[J].Muscle Nerve,2006,33(2):200-207.
[5] Fitts RH,Widrick JJ,Riley DR.Physiology of a microgravity environment invited review:microgravity and skeletal muscle[J].J Appl Physiol,2000,89(2):823-839.
[6] Goll DE,Neti G,Mares SW,et al.Myofibrillar protein turnover:the proteasome and the calpains[J].J Anim Sci,2008,86(14 Suppl):E19-E35.
[7] Razeghi P,Volpini KC,Wang Mou-Er,et al.Mechanical unloading of the heart activates the calpain system[J].J Mol Cell Cardiol,2007,42(2):449-452.
[8] Morey-Holton ER,Globus RK.Hindlimb unloading rodent model:technical aspects[J].J Appl Physiol,2002,92 (4):1367-1377.
[9] Kadee JR,Avigail P,Kevin KW.Casein zymography:a method to study μ-calpain,m-calpain and their inhibitory agents[J].Arch Biochem Biophys,1995,319(1):211-216.
[10] Hamer PW,McGeachie JM,Davies MJ,et al.Evans blue dye as an in vivo marker of myofibre damage:optimising parameters for detecting initial myofibre membrane permeability[J].J Anat,2002,200(1):69-79.
[11] Goll DE,Thompson VF,Li H,et al.The calpain system[J].Physiol Rev,2003,83(3):731-801.
[12] Vermaelen M,Sirvent P,Raynaud F,et al.Differential localization of autolyzed calpains 1 and 2 in slow and fast skeletal muscles in the early phase of atrophy[J].Am J Physiol Cell Physiol,2007,292(5):C1723-C1731.
[13] Bigard AX,Merino D,Lienhard F.Muscle damage induced by running training during recovery from hindlimb suspension:the effect of dantrolene sodium[J].Eur J Appl Physiol Occup Physiol,1997,76(5):421-427.
[14] Li Y,Gazdoiu S,Zhen QP,et al.Stability of homologue of Slimb F-box protein is regulated by availability of its substrate[J].J Biol Chem,2004,279(12):11074-11080.
[15] Shenkman BS,Nemirovskaya TL.Calcium-dependent signaling mechanisms and soleus fiber remodeling under gravitational unloanding[J].J Muscle Res Cell Motil,2008,29(2):221-230.

