SDF-1/CXCR4軸通過調控間充質干細胞定向分化修復缺氧缺血性腦損傷*
余 勤, 林 潔, 劉麗珍, 王 艷, 宣曉波, 王 標, 單 威, 周麗萍, 劉 偉
(浙江中醫藥大學1生物工程學院,3第一臨床醫學院,浙江杭州310053; 2浙江大學醫學院附屬第一醫院骨髓移植中心,浙江杭州310003)
缺氧缺血性腦損傷(hypoxia-ischemia brain damage,HIBD)是嚴重威脅現代人健康的一大類疾病,死亡率和致殘率高。間充質干細胞(mesenchymal stem cells,MSCs)移植是修復缺氧缺血性腦損傷頗具前景的治療方法。MSCs可在特定條件下誘導分化為神經元樣細胞和神經膠質細胞[1]。我們前期研究結果中也顯示,大鼠間充質干細胞移植到缺氧缺血性腦損傷大鼠腦內可存活、遷移,并可明顯改善大鼠的學習、記憶能力[2]。但是目前對外源性間充質干細胞移植治療腦損傷的確切機制尚不明確,治療效率問題有待解決。
對于MSCs移植后修復腦損傷的研究,目前認為與基質細胞衍生因子-1(stromal cell-derived factor-1,SDF-1)/CXC趨化因子受體4(CXC chemokine receptor 4,CXCR4)軸有關。SDF-1和CXCR4廣泛地表達于多種組織和細胞中,體內SDF-1和CXCR4基因敲除將導致小鼠小腦、胃腸道和造血系統發育異常而至胚胎早期死亡[3]。在MSCs誘導向成骨細胞分化過程中,阻斷SDF-1/CXCR4信號可抑制骨形態發生蛋白2(bone morphogenetic protein 2,BMP2)誘導的成骨分化[3]。由此我們推測,SDF-1/CXCR4不僅參與干細胞的遷移,其在干細胞分化、組織器官發生及再生中也可能發揮著重要作用。
本研究旨在探討SDF-1/CXCR4軸在MSCs定向分化中的作用,明確MSCs體內輸注后修復腦損傷的確切機制,以提高MSCs治療的靶向性和高效性。
材料和方法
1 動物
大鼠間充質干細胞(rat mesenchymal stem cells,rMSCs)培養的骨髓供體為健康SD大鼠,體重(100 ±10)g,雄性,清潔級;用于HIBD模型的動物為健康幼年SD大鼠(4周齡左右),體重(80±10)g,雄性,清潔級;均購于浙江中醫藥大學實驗動物中心。
2 主要試劑與儀器
DMEM/F12 1∶1培養基(Invitrogen),胎牛血清(FBS,Gibco),1%O2、5%CO2和94%N2混合氣及8%O2和92%N2混合氣(杭州特種氣公司),β-巰基乙醇(Sigma),小鼠抗神經元特異性烯醇化酶(neuron-specific enolase,NSE;Enzo Life Sciences),兔抗SDF-1α(BioVision),兔抗CXCR4(BioVision),兔抗膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP;博士德產品),鼠源SDF-1α(Peprotech),Mozobil(AMD3100,Sigma),細胞計數試劑盒-8(Cell Counting Kit-8,凱基生物產品)。FACSCalibur型流式細胞儀(BD),Transwell小室(Greiner Bio-One),低氧培養盒(長沙長錦科技有限公司)。
3 主要方法
3.1 rMSCs的體外培養及低氧培養 取健康SD青年雄性大鼠,脫頸椎處死,無菌條件下取出股骨和脛骨,清除附著的肌肉組織,暴露骨骺端,用5 mL含10%胎牛血清的DMEM/F12 1∶1培養基沖出骨髓,離心后制成單細胞懸液,接種于一次性塑料培養瓶中,置CO2細胞培養箱中培養。低氧培養時,將70%~80%融合的細胞置于密封的低氧培養盒中,用低氧混合氣(1%O2、5%CO2和94%N2)平衡10 min (1 L/min),然后轉移到37℃、5%CO2孵箱中培養。3.2 AMD3100和SDF-1α對rMSCs生長抑制的影響檢測 取對數生長期的rMSCs,經0.25%胰酶-1mmol/L EDTA消化,計數,用含10 μg/L、100 μg/L SDF-1α和5 mg/L AMD3100的DMEM/F-12培養液分別制備細胞懸液,96孔培養板中每孔接種200 μL濃度為2.5×107/L的細胞懸液,加入20 μL Cell Counting Kit-8中的溶液,37℃、5%CO2、飽和濕度下培養2 h。570 nm和630 nm雙波長檢測各組吸光度(A570和A630);終吸光度(A)=A570-A630。計算細胞生長抑制率(cell growth inhibitory rate,IR),IR (%)=A對照組-A處理組/A對照組×100%。
3.3 HIBD動物模型的建立 4周齡雄性SD大鼠麻醉后,頸部備皮、消毒,剪開頸正中皮膚2~3 cm,分離皮下脂肪,于胸鎖乳突肌深部分離左頸總動脈,用5/0絲線結扎血管兩端(相互間隔一定距離),縫合切口。術后將麻醉未醒的大鼠放回原籠中休息2~3 h,蘇醒后置于通以8%O2和92%N2混合氣體的密閉容器中,以1.5~2 L/min的流量持續通氣2.5 h制成HIBD動物模型。
3.4 RT-PCR檢測 細胞樣本用Trizol提取法抽提總RNA,海馬組織樣本則在生物安全柜內根據大鼠腦部結構將海馬部剝離,液氮凍存海馬組織約25 mg,用時在液氮下用研缽、研杵(泡酸后清洗干凈,180℃烘烤2 h以上以去除RNA酶,備用)搗碎研磨,待液氮揮發后,加1 mL Trizol試劑,充分研磨直至試劑由結冰狀態變為澄清液體,液體澄清后立即移至1.5 mL離心管中,進行RNA定量,每個樣品各取RNA 1.0 μg,進行逆轉錄(根據TaKaRa公司PrimeScriptTMRT-PCR Kit試劑盒說明書進行操作),反應條件為37℃20 min,85℃5 s;PCR聚合酶鏈式反應根據Promega公司PCR Master Mix試劑盒說明書進行操作,反應條件為95℃ 2 min,58℃ 30 s,72℃ 5 min,30個循環。SDF-1α上游引物 5’-TCTTTGGCCTCCTGTAGAATGG-3’,下游引物5’-TCACGGCAAGATTCTGGCTTA-3’,產物240 bp; CXCR4上游引物 5’-AGCAGGTAGCAGTGACCCTCTGA-3’,下游引物5’-GAAGCAGGGTTCCTTGTTGGAGT-3’,產物149 bp;β-actin上游引物5’-GAACCCTAAGGCCAACC-3’,下游引物5’-TGTCACGCACGATTTCC-3’,產物371 bp。
3.5 Western blotting檢測 細胞樣本于冰上融化,加入細胞裂解液振蕩均勻,海馬組織制備操作步驟同RT-PCR檢測準備步驟,組織冰上研磨后加裂解液,4℃、14 000×g,離心20 min,取上清,BCA法蛋白定量。取100 μg蛋白樣品進行SDS聚丙烯酰胺凝膠(SDS-PAGE)電泳,再用電轉移到PVDF膜上; 5%脫脂奶封閉2 h后,加入Ⅰ抗(CXCR4 1∶1 000、SDF-1α 1∶200、NSE 1∶100和GFAP 1∶100),4℃孵育過夜;TBST液洗滌3次,加入辣根過氧化物酶標記的Ⅱ抗室溫孵育1 h;TBST液洗滌3次;在暗室將ECL發光劑加在膜上,X線膠片曝光,常規方法定影。
3.6 流式細胞術檢測rMSCs CXCR4的表達 細胞樣本用0.25%胰酶+1 mmol/L EDTA消化,細胞計數,使每例樣本的細胞數為1×106個;細胞重懸于5 mL PBS中洗滌,1 500 r/min離心8 min;棄去上清,加100 μL PBS重懸,與CXCR4Ⅰ抗孵育液(Ⅰ抗稀釋度為1∶1 000)常溫下孵育30 min;PBS洗滌2次(1 500 r/min離心8 min),加100 μL PBS重懸,與PE-Ⅱ抗(稀釋度為1∶1 000)4℃避光孵育30 min; PBS洗滌2次后(1 500 r/min離心8 min),棄去PBS,再加入400 μL 1%多聚甲醛重懸細胞,用流式細胞儀分析。
3.7 rMSCs誘導向神經細胞分化 當rMSCs爬片接近70% 融合狀態時,用含1 mmol/L β-巰基乙醇的DMEM/F12(20%FBS)預誘導24 h,更換培養液,PBS洗滌3次,再加入含5 mmol/L β-巰基乙醇的無血清DMEM/F12誘導3~6 h,光鏡下觀察細胞形態變化。
3.8 免疫細胞化學鑒定細胞分化 分化后的細胞爬片用4%多聚甲醛固定15 min,Ⅰ抗(NSE 1∶500,GFAP 1∶100)4℃孵育過夜,PBS(含0.05%Tween 20)沖洗,Ⅱ抗濕盒中孵育30 min,PBS沖洗,5 min× 3次,DAB顯色,蒸餾水沖洗以終止反應。隨機計數相應時點20個視野中陽性細胞,計算平均值。
4 統計學處理
結果
1 AMD3100和SDF-1α對rMSCs生長抑制的影響
5 mg/L AMD3100、10 μg/L和100 μg/L SDF-1α作用于rMSCs的IR均小于5%,見表1,表明它們對rMSCs的生長均無顯著抑制作用。
表1 各處理組的細胞生長抑制率Table 1 .The inhibitory rates(IR)of cell growth in different groups(%.±s.n=3)
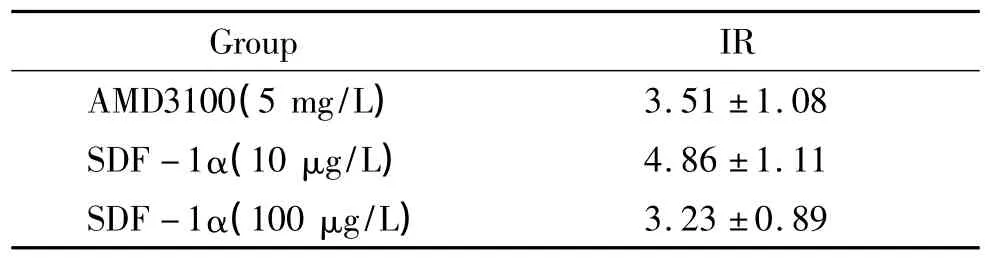
表1 各處理組的細胞生長抑制率Table 1 .The inhibitory rates(IR)of cell growth in different groups(%.±s.n=3)
?
2 低氧對rMSCs中CXCR4表達的影響
rMSCs低氧6 h與12 h CXCR4 mRNA表達水平均較0 h組明顯增加(P<0.01),在24 h顯著減小(P<0.05),48 h和72 h時CXCR4 mRNA的轉錄水平降低,見圖1A;rMSCs低氧各時點CXCR4蛋白表達水平均較0 h組增加,其中低氧6 h CXCR4蛋白表達增加最為顯著(P<0.01),12 h和24 h組與0 h組比較CXCR4蛋白表達增加有顯著差異(P<0.05),見圖1B;rMSCs低氧培養6 h、12 h、24 h、48 h、72 h,流式細胞術檢測結果顯示,低氧培養各時點rMSCs表面受體CXCR4表達均較對照組增加(P<0.05),見圖1C。
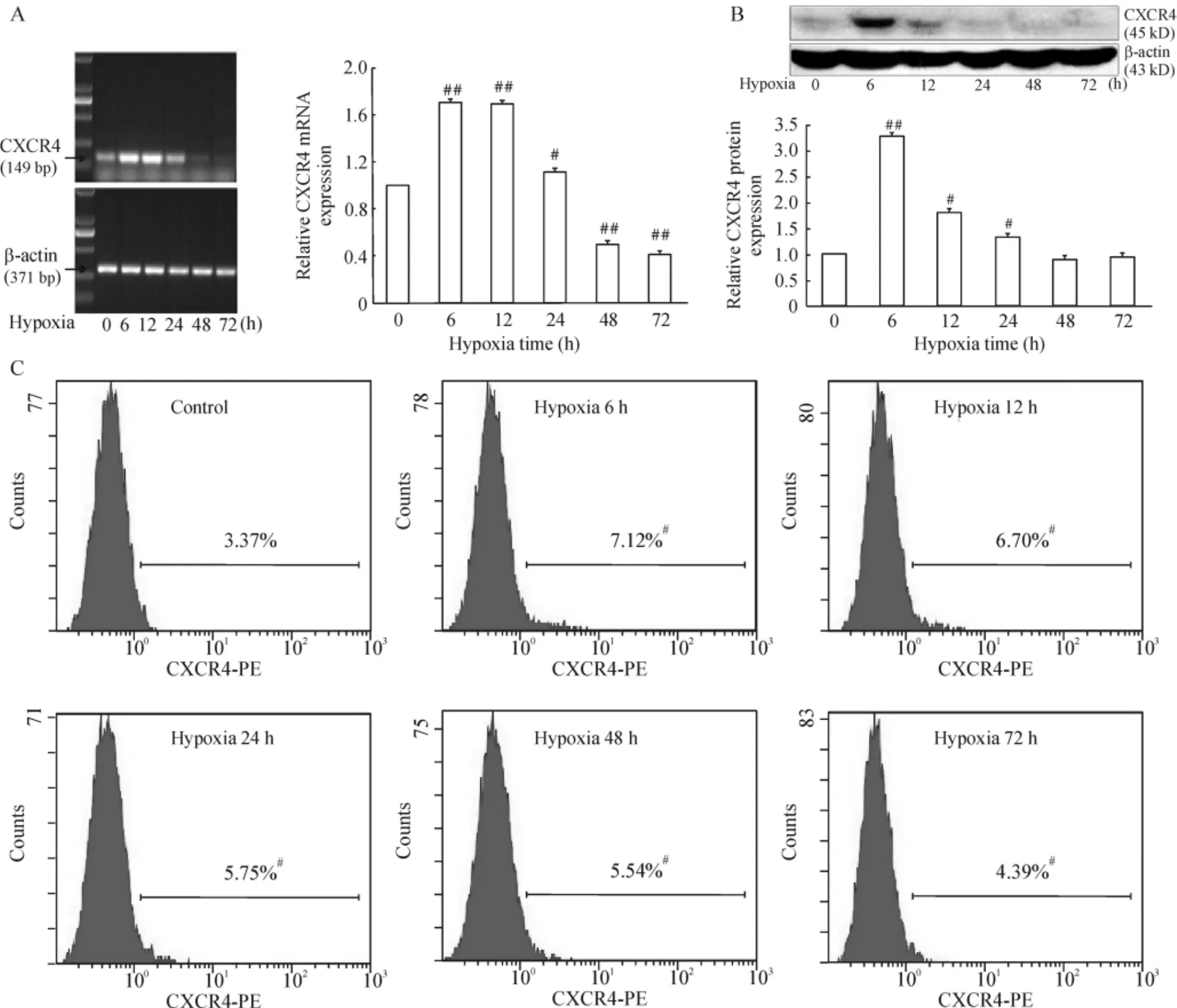
Figure 1.Hypoxia elevated the CXCR4 expression in rMSCs.A:mRNA expression detected by RT-PCR;B:protein expression detected by Western blotting;C:protein expression detected by flow cytometry.±s.n=3.#P<0.05,##P<0.01 vs control (0 h).圖1 缺氧促進rMSCs CXCR4的表達
3 SDF-1α及AMD3100對rMSCs中CXCR4表達的影響
10 μg/L SDF-1α處理rMSCs 2 d和5 mg/L AMD3100處理rMSCs 3 d后,RT-PCR、Western blotting及流式細胞術檢測CXCR4表達水平的結果顯示,SDF-1α處理后CXCR4 mRNA表達明顯增加(P<0.05),AMD3100處理后CXCR4 mRNA表達較對照組顯著下降(P<0.05),見圖2A;Western blotting及流式細胞術檢測結果與CXCR4 mRNA表達的趨勢一致,見圖2B、2C。
4 海馬組織中SDF-1α的表達
大鼠造模后1 d、3 d、5 d、7 d、14 d、21 d,各實驗組海馬組織SDF-1α mRNA和蛋白表達均較正常組有明顯增加,7 d時增加最為顯著(P<0.01),之后表達回落,持續到21 d仍有穩定表達,見圖3。
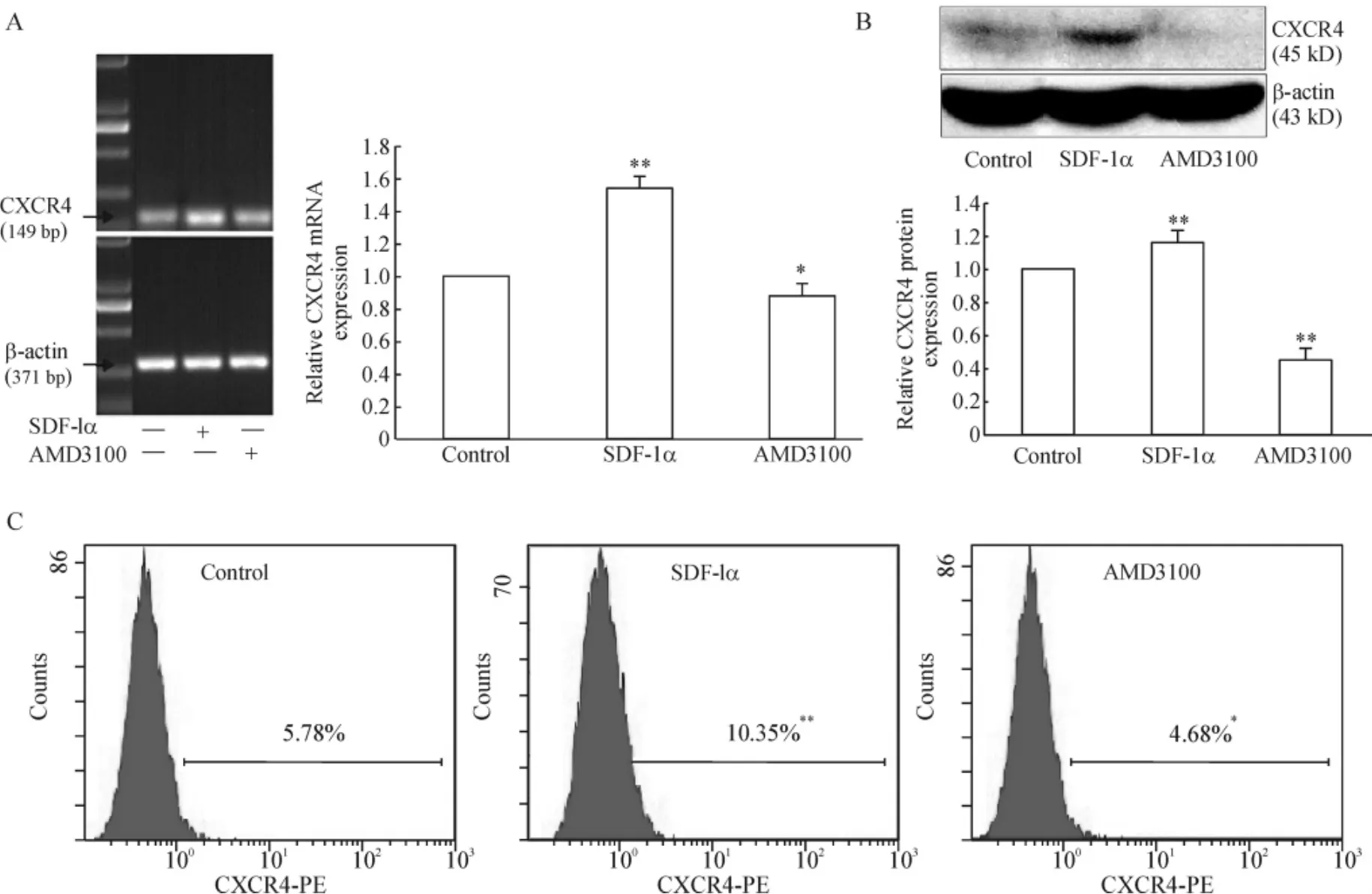
Figure 2.SDF-1α augmented the expression of CXCR4 in rMSCs.A:mRNA expression detected by RT-PCR;B:protein expression detected by Western blotting;C:protein expression detected by flow cytometry.±s.n=3.*P<0.05,**P<0.01 vs control.圖2 SDF-1α促進rMSCs CXCR4的表達
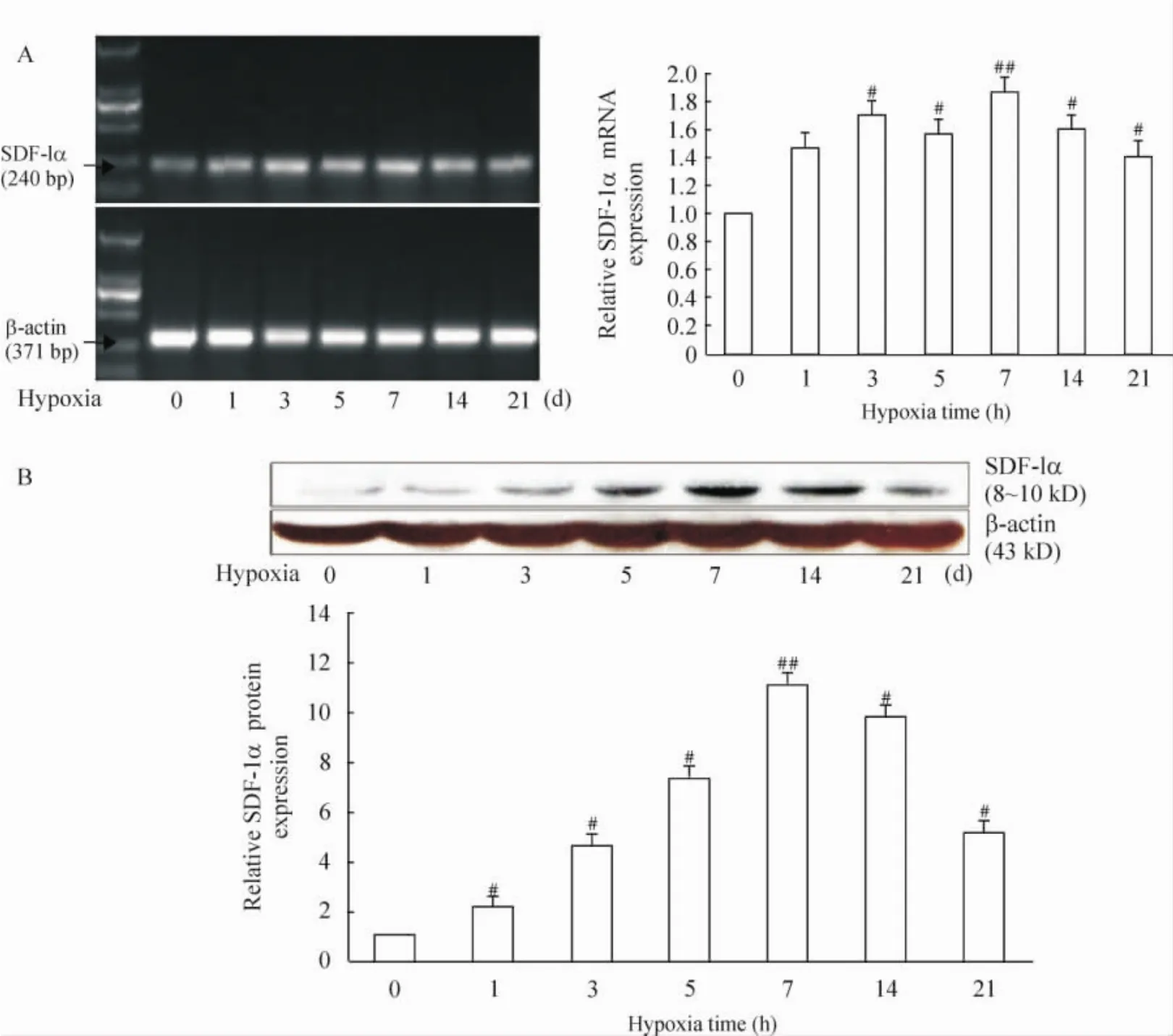
Figure 3.SDF-1α mRNA(A)and protein(B)expression changed in hippocampus tissues of HIBD rats.±s.n=3.#P<0.05,##P<0.01 vs control(0 d)group.圖3 缺血缺氧大鼠海馬組織SDF-1α表達的變化
5 免疫細胞化學鑒定細胞分化
正常rMSCs、AMD3100拮抗后的rMSCs經誘導向神經細胞分化,再用免疫細胞化學鑒定細胞分化,結果顯示,AMD3100拮抗后的分化細胞 NSE和GFAP陽性表達的細胞數明顯較正常分化的細胞少,見圖4。隨機計數相應時點20個視野中陽性細胞,計算平均值,見表2。
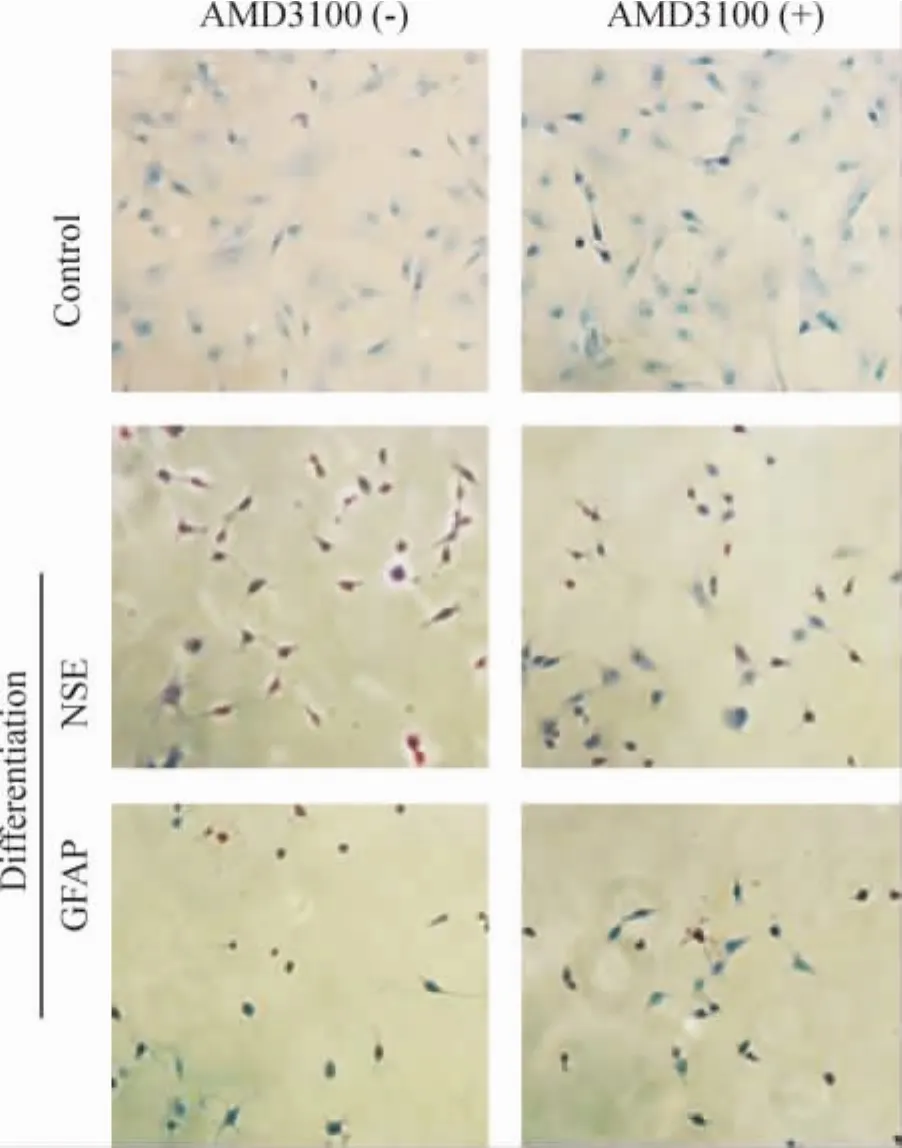
Figure 4.The expression of neural-specific markers in different groups(immunocytochemical staining,×200).圖4 不同處理組神經特異性標志物的表達
表2 rMSCs神經分化中NSE和GFAP陽性細胞數比較Table 2 .Comparison of NSE and GFAP positive cell numbers of rMSCs in neural differentiation(±s.n=3)

表2 rMSCs神經分化中NSE和GFAP陽性細胞數比較Table 2 .Comparison of NSE and GFAP positive cell numbers of rMSCs in neural differentiation(±s.n=3)
*P<0.05 vs AMD3100(-).
?
討論
腦缺氧缺血是造成神經功能缺損的常見原因,其誘導的腦損傷是一種彌漫性、進行性的神經元壞死和神經元程序性死亡。腦缺氧缺血損傷治療的關鍵在于挽救缺血半暗帶區瀕臨死亡的神經元和促進損傷后神經功能的恢復。目前治療主要是應用多種腦細胞活性藥物抑制腦細胞凋亡,但對已壞死的腦細胞則無作用。因此通過細胞移植使得損傷的腦組織及腦神經得到重建,改善腦功能,已成為該病治療一個新的研究熱點。間充質干細胞是具有多向分化潛能的成體干細胞[5],在一定條件下能夠分化為多種中胚層和神經外胚層發育來源的細胞[6]。Kopen等[7]將MSCs注入新生小鼠的側腦室,發現MSCs遷移遍及整個前腦和小腦,在紋狀體和海馬中MSCs表達GFAP,提示其已經分化為星形膠質細胞;在嗅覺小島、嗅球、小腦的內顆粒層發現大量的MSCs,其不但表達巢蛋白(nestein),還表達神經元的特異性表面標記NSE、神經元特異性核蛋白和神經元中絲蛋白,提示已經分化為神經元。另有研究顯示rMSCs移植可改善缺氧缺血性腦損傷大鼠腦部功能損傷[2]。由此,利用MSCs替代原來受損或功能缺陷的神經組織治療神經系統疾病是一種頗具前景的治療方法[8-9]。但是,在外源性MSCs移植治療中,由于修復的確切機制尚未明確,使得治療效率問題尚未真正得到解決。本課題旨在研究移植MSCs向神經細胞分化的確切機理,以提高MSCs治療的靶向性和高效性。
SDF-1是為數不多的表達于腦組織中的趨化因子之一,在正常神經系統中SDF-1量維持在較低水平,不發揮遷移趨化作用,主要由星形膠質細胞和神經元表達[10]。當中樞神經系統發生炎癥、缺血和低氧等病變后,可引起SDF-1水平的上調,趨化血液系統中的單核/巨噬細胞向損傷區遷移并發揮相應生物學效應。本研究對HIBD大鼠海馬組織中的SDF-1α的表達變化進行了檢測,結果顯示SDF-1α mRNA及蛋白的表達均隨低氧時間逐漸增加,7 d時達到頂峰持續到21 d仍有穩定表達,且較對照組表達明顯,提示HIBD大鼠腦中的SDF-1表達增加。
由于體外擴增的MSCs表面CXCR4的表達率要顯著低于骨髓中MSCs表達的CXCR4[11]。我們的實驗中用10 μg/L SDF-1α與rMSCs共孵育2 d,RT-PCR及Western免疫印跡結果顯示,SDF-1α處理組中CXCR4 mRNA及蛋白的表達均顯著增加,流式細胞術檢測也顯示rMSCs表面受體CXCR4表達率上升明顯。細胞表面CXCR4表達增加驗證了微小劑量的SDF-1α可誘導胞內CXCR4向細胞表面轉移的假設,使SDF-1/CXCR4軸介導的細胞生物學效應增強。
由于體內環境的氧濃度明顯低于體外,外源輸入的MSCs處于低氧狀態,實驗研究表面持續性低氧對MSCs增殖沒有抑制作用且具有促進作用[12-13]。同時本實驗同時發現,rMSCs缺氧6 h與12 h CXCR4 mRNA轉錄水平均較常氧組明顯增加(P< 0.01),24 h顯著減小。rMSCs低氧各時點CXCR4蛋白表達水平均較常氧組增加,其中低氧6 h CXCR4蛋白表達上調最為顯著,其它組與常氧組有顯著差異。另外,流式細胞術檢測進一步證實了rMSCs低氧培養時CXCR4表達增加這一結論,提示低氧環境不僅有助于細胞生長,且能提高SDF-1α的特異性受體CXCR4的表達。
以上結果提示在MSCs修復缺氧缺血性腦損傷中,低氧能形成適合干細胞生長的環境且使MSCs表面的CXCR4表達增加,同時促進腦內微環境中SDF-1表達增加,進而加強了SDF-1/CXCR4軸的生物學關聯。
而SDF-1/CXCR4軸在干細胞分化、組織器官發生及再生中也有重要作用。在MSCs誘導向成骨細胞分化過程中,SDF-1通過細胞內蛋白Smad和MAPK信號通路促進BMP2表達并誘導MSCs向成骨分化[4]。在神經發育的過程中,SDF-1是參與神經發育的重要蛋白,SDF-1/CXCR4信號通路在神經細胞生長、增殖、遷移、軸突形成等過程中均有重要作用。由此我們假設SDF-1/CXCR4軸可能在調控MSCs分裂增殖、啟動向神經細胞分化以及軸突的形成過程有關,但是目前對SDF-1/CXCR4軸對MSCs增殖和分化的影響及其機制尚不明確。本實驗用 SDF-1α特異性受體 CXCR4的拮抗劑AMD3100處理MSCs后進行體外神經分化誘導,比較其與正常rMSCs神經分化率的變化。實驗結果表明,在免疫細胞化學鑒定中,AMD3100拮抗后的rMSCs分化后NSE和GFAP陽性表達的細胞數較正常rMSCs明顯較少。
綜上所述,MSCs修復缺氧缺血性腦損傷中,腦部的低氧狀態能為MSCs提供適合存活的環境,并且使MSCs表面的CXCR4表達增加,同時缺血缺氧環境能促進腦內微環境中SDF-1表達的增加,進而加強SDF-1/CXCR4軸的生物學效應,而MSCs在表面受體CXCR4被拮抗的情況下向神經分化的能力下降,表明SDF-1/CXCR4軸具有調控rMSCs神經分化的作用,在rMSCs移植治療缺氧缺血性腦損傷中具有重要意義。
[1] Qi X,Shao M,Peng H,et al.In vitro differentiation of bone marrow stromal cells into neurons and glial cells and differential protein expression in a two-compartment bone marrow stromal cell/neuron co-culture system[J].J Clin Neurosci,2010,17(7):908-913.
[2] 余 勤,王 艷,連俊蘭,等.大鼠骨髓間質干細胞修復缺氧/缺血性腦損傷的研究[J].中國中西醫結合急救雜志,2009,16(1):34-37.
[3] Zou YR,Kottmann AH,Kuroda M,et al.Function of the chemokine receptor CXCR4 in hematopoiesis and in cerebellar development[J].Nature,1998,393(6685):595-599.
[4] Hosogane N,Huang Z,Rawlins BA,et al.Stromal derived factor-1 regulates bone morphogenetic protein 2-induced osteogenic differentiation of primary mesenchymal stem cells[J].Int J Biochem Cell Biol,2010,42(7): 1132-1141.
[5] Penny J,Harris P,Shakesheff KM,et al.The biology of equine mesenchymal stem cells:phenotypic characterization,cell surface markers and multilineage differentiation[J].Front Biosci,2012,17:892-908.
[6] Aldahmash A,Zaher W,Al-Nbaheen M,et al.Human stromal(mesenchymal)stem cells:basic biology and current clinical use for tissue regeneration[J].Ann Saudi Med,2012,32(1):68-77.
[7] Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mouse brains[J].Proc Natl Acad Sci U S A,1999,96(19):10711-10716.
[8] Siniscalco D,Giordano C,Galderisi U,et al.Long-lasting effects of human mesenchymal stem cell systemic administration on pain-like behaviors,cellular,and biomolecular modifications in neuropathic mice[J].Front Integr Neurosci,2011,5:79.
[9] Chang YK,Chen MH,Chiang YH,et al.Mesenchymal stem cell transplantation ameliorates motor function deterioration of spinocerebellar ataxia by rescuing cerebellar Purkinje cells[J].J Biomed Sci,2011,18:54.
[10] Merino JJ,Gutiérrez-Fernández M,Rodríguez-Frutos B,et al.CXCR4/SDF-1α-chemokine regulates neurogenesis and/or angiogenesis within the vascular niche of ischemic rats;however,does SDF-1α play a role in repair?[J].Int J Stroke,2011,6(5):466-467.
[11] Honczarenko M,Le Y,Swierkowski M,et al.Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors[J].Stem Cells,2006,24(4):1030-1041.
[12] Peterson KM,Aly A,Lerman A,et al.Improved survival of mesenchymal stromal cell after hypoxia preconditioning: role of oxidative stress[J].Life Sci,2011,88(1-2): 65-73.
[13] Chacko SM,Ahmed S,Selvendiran K,et al.Hypoxic preconditioning induces the expression of prosurvival and proangiogenic markers in mesenchymal stem cells[J].Am J Physiol Cell Physiol,2010,299(6):C1562-C1570.

