載脂蛋白E在ABCA1和ABCG1介導的膽固醇流出中的作用
盧彥珍, 張翠英, 張麗麗, 宋 娟, 賈建桃
(長治醫學院1病理生理學教研室,2生理學教研室,山西長治046000)
載脂蛋白E(apolipoprotein E,ApoE)是低密度脂蛋白受體(low-density lipoprotein receptor,LDLr)與肝細胞乳糜微粒殘粒受體的配體,主要介導血漿脂蛋白特別是乳糜微粒和低密度脂蛋白的代謝與清除,ApoE缺乏則會導致血液循環中富含膽固醇的物質增加。在ApoE基因敲除(ApoE-/-)的小鼠模型中,由于血漿中脂質代謝障礙,聚集的脂質被巨噬細胞吞噬后能夠誘導巨噬細胞轉化為泡沫樣細胞,出現早期動脈粥樣硬化(atherosclerosis,AS)斑塊的特征性改變[1]。
脂質攝入和流出的不平衡是脂質在巨噬細胞內聚集的一個重要原因[2]。ATP結合盒轉運蛋白A1 (ATP-binding cassette transporter A1,ABCA1)和G1 (ATP-binding cassette transporter G1,ABCG1)分別負責把細胞內的脂質轉運至細胞外的載脂蛋白A-I (apolipoprotein A-I,ApoA-I)和高密度脂蛋白(high-density lipoprotein,HDL),在維持細胞內膽固醇的動態平衡,進而阻止脂質在巨噬細胞內的聚集中發揮著重要作用[3-4]。因此,促進膽固醇流出已成為防治AS的靶點之一。本研究旨在通過觀察ApoE在巨噬細胞膽固醇流出中的作用,及其對膽固醇流出過程中ABCA1和ABCG1表達水平的調節,探討ApoE調節膽固醇流出的機制。
材料和方法
1 材料與試劑
RAW 264.7細胞系購自ATCC細胞庫,DMEM粉末培養基、新生牛血清(fetal bovine serum,FBS)和雙抗均購自Gibco。[1,2-3H(N)]-膽固醇購自PerkinElmer,人ApoA-I、HDL、牛血清白蛋白(bovine serum albumin,BSA)及 RIPA細胞裂解液均購自Sigma。ABCA1、ABCG1和β-actinⅠ抗及辣根過氧化物酶結合的Ⅱ抗購自Santa Cruz。高脂飼料購自北京科澳協力有限公司,含脂肪15%,膽固醇1.25%。游離膽固醇(free chol esterol,FC)和總膽固醇(total cholesterol,TC)檢測試劑盒購自普利萊基因技術有限公司。逆轉錄試劑盒購自TaKaRa,實時熒光定量PCR試劑購自ABI,BCA蛋白定量試劑購自Pierce。
2 方法
2.1 動物及脂蛋白分離 10只12周齡雄性ApoE-/-小鼠購自北京大學實驗動物中心,10只12周齡雄性LDLr基因敲除(LDLr-/-)小鼠購自南京大學模型動物研究所。所有實驗動物高脂飲食喂養4 d,禁食12 h后收集血漿,然后用兩步密度梯度離心法分離血漿低密度脂蛋白(low-density lipoprotein,LDL)[5]。分離得到的LDL經透析、過濾除菌和濃縮后,用聚丙烯酰胺凝膠電泳鑒定其純度,并用BCA法檢測蛋白濃度。
2.2 透射電鏡技術檢測脂蛋白在巨噬細胞內的聚集 分別用20 mg/L LDLr-/-小鼠脂蛋白、ApoE-/-小鼠脂蛋白和單純培養基處理生長在6孔板中的細胞,48 h后更換為不含任何脂蛋白的培養基平衡12 h。用二甲胂酸緩沖液洗滌細胞,將細胞收集至離心管中離心,吸棄上清后,沿管壁緩慢加入2.5%戊二醛固定液,使細胞團塊懸浮在固定液中,固定30 min,用二甲胂酸緩沖液充分洗滌后,加入1%四氧化鋨進行2次固定,對2次固定后的細胞團塊脫水,用環氧樹脂包埋后切60 nm薄片,用醋酸鈾和檸檬酸鉛雙染色后鏡下掃描。
2.3 細胞內脂質含量的檢測 細胞處理方法同上,用不含任何脂蛋白的培養基平衡12 h后,用PBS洗滌細胞2次,每孔細胞中加入1 mL蒸餾水,將細胞收集至離心管中。超聲破碎細胞,取10 μL用于蛋白濃度檢測,取500 μL樣品至15 mL離心管中,加入2 mL氯仿和甲醇混合物(2∶1),充分振蕩混勻后,離心分層溶液,轉移1 mL下層溶液至另一離心管中進行真空干燥,用100 μL含10%Triton X-100的異丙醇溶解脂質沉淀。然后根據FC和TC的檢測試劑盒的操作流程,根據標準曲線計算細胞FC和TC的含量,膽固醇酯(cholesterol ester,CE)的含量為TC與FC之差,即CE=TC-FC。
2.4 液閃儀技術檢測膽固醇流出變化 膽固醇流出實驗操作過程參考其它實驗室已經建立的方法,并進行了如下調整[6]:以4×104cells/well的密度將Raw 264.7接種至24孔板,每組設3個復孔,接種后第2 d,用濃度為18.5×107Bq/L的[1,2-3H(N)]-cholesterol標記細胞。[1,2-3H(N)]-cholesterol用含0.5%FBS的DMEM稀釋,每孔加300 μL,然后再加入終濃度為20 mg/L LDLr-/-小鼠或ApoE-/-小鼠脂蛋白;標記24 h后,用含有0.2%BSA的DMEM洗滌細胞2次,不含BSA的DMEM洗滌1次,然后用不含BSA的DMEM,或者含終濃度為20 mg/L ApoA-I或者HDL的DMEM繼續孵育細胞;孵育2 h后收集培養上清至離心管中,離心除去細胞碎片;細胞則用預冷的PBS洗滌2次,然后用0.5 mol/ L NaOH裂解;將細胞上清液和裂解液轉移至閃爍瓶中,加入適當比例的閃爍液(比例至少為1∶10),充分混勻后用液體閃爍儀計數;膽固醇流出用細胞上清液中的計數除以總計數(上清液和細胞裂解液計數的總和)表示。ApoA-I或者HDL介導的膽固醇流出以含有ApoA-I或HDL的膽固醇流出值減去不含ApoA-I或HDL的膽固醇流出值表示。
2.5 Western blotting檢測ABCA1和ABCG1在3組中的表達變化 脂蛋白處理細胞6 h后吸棄培養基,用PBS洗滌細胞1次,每孔細胞加入預冷的RIPA裂解液[含50 mmol/L Tris-HCl(pH 7.4),150 mmol/L NaCl,0.25% 脫氧膽酸鈉(Na-deoxycholate),1% NP40,1 mmol/L苯甲基磺酰氟(PMSF),1×蛋白酶抑制劑混合物(protease inhibitor cocktail)],冰上裂解5 min后收集細胞至離心管中,全速離心10 min后轉移上清至另一離心管,并采用BCA法測定蛋白濃度。用蛋白上樣緩沖液處理樣品后取等量蛋白上樣,待蛋白充分分離后,將SDS-PAGE膠中的蛋白電轉移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。然后將PVDF膜順次置于含5%脫脂奶粉的TBST(20 mmol/L Tris-HCl,150 mmol/L NaCl,0.1%Tween 20)中室溫封閉1h,封閉液稀釋的ABCA1和ABCG1Ⅰ抗(1∶1 000)中4℃過夜,之后用TBST清洗10 min×3次,在封閉液稀釋的Ⅱ抗(1∶5 000)中室溫孵育1 h,TBST清洗15 min×3次后與ECL反應1 min,置于X線膠片暗盒中顯影,根據蛋白表達的情況決定曝光時間。然后用洗脫液洗脫上述PVDF膜上的蛋白顯影信號,重新封閉后,用含βactin的Ⅰ抗(1∶5 000)4℃孵育過夜,并按照上述過程進行顯影,作為上樣參照。顯影結果用Bio-Rad公司提供的Quantity One軟件測定蛋白條帶的光密度進行定量分析。
2.6 實時定量RT-PCR技術檢測ABCA1和ABCG1在3組中的表達變化 脂蛋白處理細胞6 h后吸棄培養基,每孔細胞加入1 mL Trizol試劑,按照操作說明提取細胞總RNA,經NanoDrop檢測RNA濃度和純度。取400 ng總RNA用逆轉錄試劑盒,按照操作說明,將RNA逆轉錄為cDNA。目的基因ABCA1和ABCG1擴增時,分別稀釋cDNA至10 mg/L和1 mg/L作為擴增ABCA1、ABCG1和內參照GAPDH的模板,按照實時熒光定量PCR試劑和ABIPRISM?7900HT的操作說明進行實時定量PCR反應。總反應體系為10 μL,包括2×SYBR? Premix Ex TaqTMII 5 μL,10 μmol/L引物0.8 μL,模板1 μL,DEPC水3.2 μL。反應條件為:95℃ 30 s;95℃ 5 s,60℃ 30 s,40個循環;72℃ 30 s。利用Sequence Detection System(SDS)Software 2.4對實驗數據進行分析,計算ABCA1和ABCG1相對于內參照GAPDH的表達量。實驗中使用的引物分別為:ABCA1上游引物5’-AACATGGACATCCTGAAGCC-3’,下游引物5’-ATGTCGCTCCAGCTCTTTGT-3’;ABCG1上游引物5’-TCAACAGTGGAGAGCTGGTG-3’,下游引物5’-TGAACAGTGAGGTGAGGCAG-3’。
3 統計學處理
結果
1 ApoE-/-小鼠脂蛋白在巨噬細胞內聚集
透射電鏡顯示,與對照組相比,用LDLr-/-小鼠脂蛋白處理后細胞內脂滴數量及體積并未明顯改變,但是用ApoE-/-小鼠脂蛋白處理48 h后,細胞內脂滴數量明顯增加,脂滴體積明顯增大,提示用ApoE-/-小鼠脂蛋白處理后,巨噬細胞已經呈現泡沫樣變化,見圖1。

Figure 1.The accumulation of ApoE-/-mouse lipoprotein in macrophages.圖1 ApoE-/-小鼠脂蛋白在巨噬細胞內的聚集
圖2所示,與對照組相比,用LDLr-/-小鼠脂蛋白處理后細胞內脂質含量并未明顯改變,但是用ApoE-/-小鼠脂蛋白處理48 h后,細胞內CE增加了60%;細胞內FC含量無明顯變化。
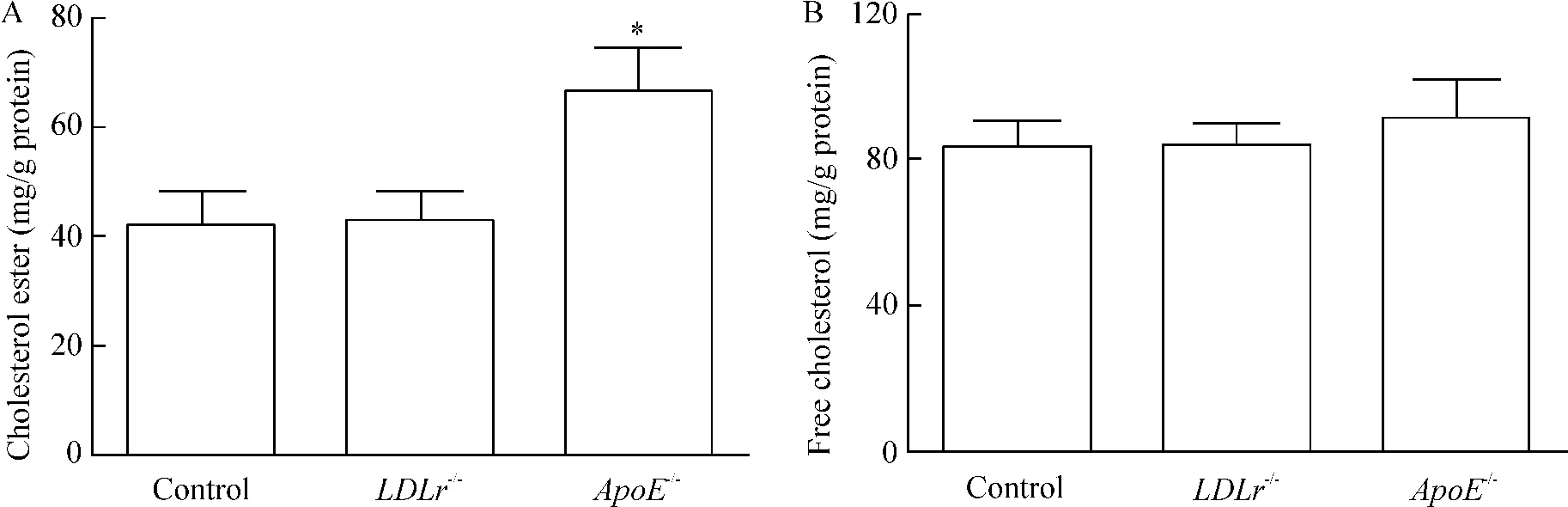
Figure 2.The accumulation of ApoE-/-mouse lipoprotein in macrophages.A:cholesterol ester;B:free cholesterol.±s.n=3.*P<0.05 vs control group.圖2 ApoE-/-小鼠脂蛋白在巨噬細胞內的聚集
2 ApoE-/-小鼠脂蛋白降低巨噬細胞膽固醇流出
圖3所示,與LDLr-/-小鼠脂蛋白處理組相比,用ApoE-/-小鼠脂蛋白處理后,巨噬細胞膽固醇流出至ApoA-I和HDL的量均明顯降低,表明ApoE-/-小鼠脂蛋白在巨噬細胞內的聚集與膽固醇流出降低有關。
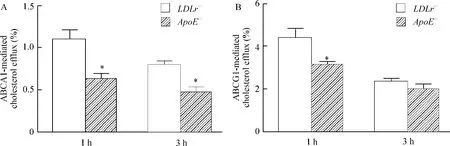
Figure 3.Cholesterol efflux mediated by ABCA1(A)and ABCG1(B).±s.n=3*P<0.05 vs LDLr-/-group.圖3ABCA1和ABCG1介導的膽固醇流出
3 ApoE-/-小鼠脂蛋白降低ABCA1和ABCG1的蛋白表達
如圖4所示,與對照組相比,LDLr-/-小鼠脂蛋白和ApoE-/-小鼠脂蛋白處理顯著增加ABCA1和 ABCG1的蛋白表達,但是 ApoE-/-小鼠脂蛋白對ABCA1和ABCG1蛋白表達的誘導程度明顯低于LDLr-/-小鼠脂蛋白處理組細胞,說明低水平的蛋白表達與低水平的膽固醇流出是相一致的。
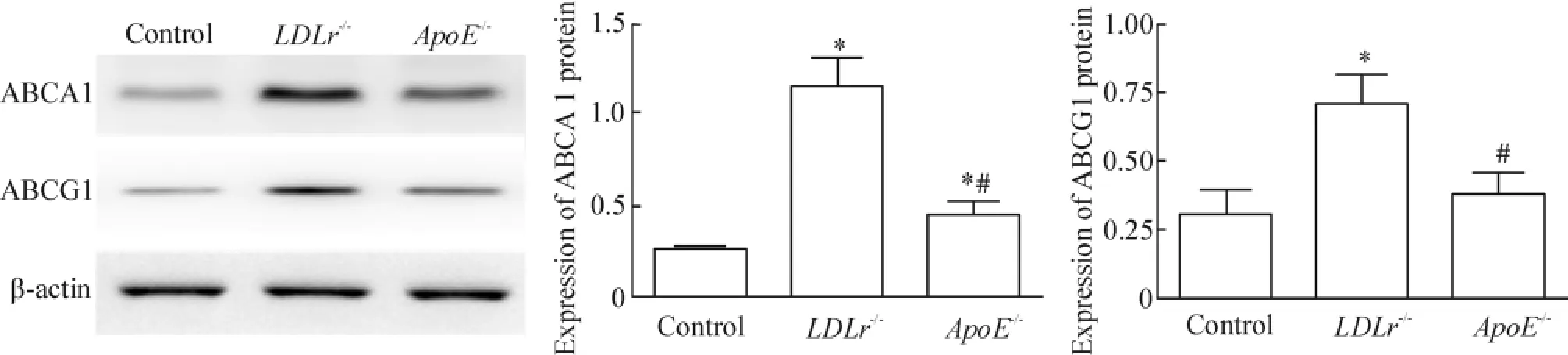
Figure 4.The protein expression of ABCA1 and ABCG1.±s.n=3.*P<0.05 vs control group;#P<0.05 vs LDLr-/-group.圖4ABCA1和ABCG1的蛋白表達
4 ApoE-/-小鼠脂蛋白降低ABCA1和ABCG1的mRNA水平
如圖5所示,LDLr-/-小鼠脂蛋白和ApoE-/-小鼠脂蛋白處理顯著增加ABCA1和ABCG1的mRNA水平,但是ApoE-/-小鼠脂蛋白對ABCA1和ABCG1 mRNA水平的誘導程度明顯低于LDLr-/-小鼠脂蛋白處理組細胞。
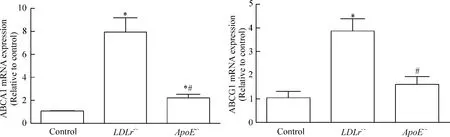
Figure 5.The mRNA levels of ABCA1 and ABCG1.±s.n=3.*P<0.05 vs control group;#P<0.05 vs LDLr-/-group.圖5 ApoE-/-小鼠脂蛋白從轉錄水平對ABCA1和ABCG1表達的調節
討論
脂質在巨噬細胞內聚集引起巨噬細胞泡沫樣改變是AS的特征性病理變化。脂質攝入和流出的不平衡是脂質在巨噬細胞內聚集的一個重要原因[2]。本次研究中,我們主要觀察到ApoE-/-小鼠脂蛋白顯著降低膽固醇流出至ApoA-I和HDL,引起脂質在巨噬細胞內聚集。同時我們也觀察到,ApoE-/-小鼠脂蛋白導致膽固醇流出的減少與ABCA1和ABCG1的蛋白表達水平降低有關。
膽固醇從巨噬細胞內流出是膽固醇逆向轉運過程中最關鍵的一個步驟,如果膽固醇從巨噬細胞內流出至細胞外接受體ApoA-I和HDL的過程發生障礙,會引起大量膽固醇在細胞內聚集[7]。Tangier疾病是一種罕見的遺傳性疾病,Tangier疾病患者的肝臟、脾臟以及其它許多組織器官的巨噬細胞內均可發現膽固醇和膽固醇酯聚集,這主要是由于那些患者ABCA1突變而喪失轉運膽固醇的功能所致[8]。Yvan-Charvet等[9]研究發現,與Tangier疾病患者相似,ABCA1和ABCG1基因敲除小鼠也因巨噬細胞膽固醇流出至ApoA-I和HDL的水平降低而加速小鼠AS的進程。Lu等[10]在最近的一項研究中指出,促紅細胞生成素能夠促進巨噬細胞膽固醇流出,進而抑制脂質在巨噬細胞內的聚集,阻止巨噬細胞發生泡沫樣改變;與此相反,當抑制細胞膽固醇流出過程后,則有大量的脂質在巨噬細胞內聚集。我們本次的研究結果也證實膽固醇流出在維持巨噬細胞內膽固醇動態平衡中的作用,同時我們也發現,用ApoE-/-小鼠脂蛋白處理細胞后,流出至ApoA-I和HDL的膽固醇量明顯降低,表明ApoE缺失在一定程度上抑制膽固醇流出,進而導致脂質在巨噬細胞內的聚集。
膽固醇流出與ABCA1和ABCG1的表達水平密切相關。Lu等[10]的研究主要集中在促紅細胞生成素通過增加ABCA1和ABCG1的表達進而調節巨噬細胞的膽固醇流出狀況,提示ABCA1和ABCG1作為轉運體發揮作用,在細胞受到外來干擾時盡量把細胞內多余的脂質轉運出去,達到保護細胞的目的。與上述觀察相一致,我們的實驗結果也顯示,當用脂蛋白處理巨噬細胞時,細胞表面ABCA1和ABCG1的蛋白表達都上調,只是上調程度有差異。諸如,LDLr-/-小鼠脂蛋白和ApoE-/-小鼠脂蛋白處理顯著增加ABCA1和ABCG1的蛋白表達,但是ApoE-/-小鼠脂蛋白對ABCA1和ABCG1蛋白表達的誘導程度明顯低于LDLr-/-小鼠脂蛋白處理組細胞。這表明,ApoE在調節ABCA1和ABCG1蛋白表達水平進而維持膽固醇從巨噬細胞內流出平衡的過程中發揮了重要作用,本實驗中對ABCA1和ABCG1轉錄水平的研究進一步支持了上述觀點。
[1] Kolovou G,Anagnostopoulou K,Mikhailidis DP,et al.Apolipoprotein E knockout models[J].Curr Pharm Des,2008,14(4):338-351.
[2] Wang N,Silver DL,Costet P,et al.Specific binding of ApoA-I,enhanced cholesterol efflux,and altered plasma membrane morphology in cells expressing ABC1[J].J Biol Chem,2000,275(42):33053-33058.
[3] Rust S,Rosier M,Funke H,et al.Tangier disease is caused by mutations in the gene encoding ATP-binding cassette transporter 1[J].Nat Genet,1999,22(4):352-355.
[4] Out R,Hoekstra M,Hildebrand RB,et al.Macrophage ABCG1 deletion disrupts lipid homeostasis in alveolar macrophages and moderately influences atherosclerotic lesion development in LDL receptor-deficient mice[J].Arterioscler Throm Vasc Biol,2006,26(10):2295-2300.
[5] 王淳本,宗義強,吳萬生,等.兩步超速離心法快速分離大量血漿極低密度脂蛋白及低密度脂蛋白[J].同濟醫科大學學報,1995,24(3):169-171.
[6] Dove DE,Su YR,Zhang W,et al.ACAT1 deficiency disrupts cholesterol efflux and alters cellular morphology in macrophages[J].Arterioscler Thromb Vasc Biol,2005,25(1):128-134.
[7] von Eckardstein A,Nofer JR,Assmann G.High density lipoproteins and arteriosclerosis:role of cholesterol efflux and reverse cholesterol transport[J].Arterioscler Throm Vasc Biol,2001,21(1):13-27.
[8] Brooks-Wilson A,Marcil M,Clee SM,et al.Mutations in ABC1 in Tangier disease and familial high-density lipoprotein deficiency[J].Nat Genet,1999,22(4):336-345.
[9] Yvan-Charvet L,Ranalletta M,Wang N,et al.Combined deficiency of ABCA1 and ABCG1 promotes foam cell accumulation and accelerates atherosclerosis in mice[J].J Clin Invest,2007,117(12):3900-3908.
[10] Lu KY,Ching LC,Su KH,et al.Erythropoietin suppresses the formation of macrophage foam cells:role of liver X receptor α[J].Circulation,2010,121(16):1828-1837.

