siRNA特異性沉默septin 2基因抑制大腸癌LoVo細胞遷移
代新珍, 黃學平, 鐘 琳, 陳少紅, 韓西群, 張 玉, 朱梅剛, 趙 彤,△
(南方醫科大學1附屬南方醫院病理科,2基礎醫學院病理學系,廣東廣州510515)
Septins是一類具有GTP酶活性的基因家族,最早在酵母中發現。該基因家族分布廣泛,存在于除植物外幾乎所有的真核生物中[1]。Septins家族除了與細胞胞質分裂、細胞內物質轉運、凋亡等細胞生理過程有關外,還發現在胚胎發育過程中控制細胞的遷移[2]。Septin 2作為septins家族成員,它與纖維狀肌動蛋白(F-actin)共同參與細胞骨架的組裝,在細胞超微結構即應力纖維和片狀偽足中表現為共定位表達,septin 2表達被干擾后,纖維狀肌動蛋白表達也明顯減弱[3]。而骨架蛋白調節細胞遷移方面的作用,目前研究較多的是細胞分裂周期蛋白42(cell division cycle 42),它可以通過誘導細胞肌動蛋白聚合,對肌動蛋白細胞骨架發揮調節細胞遷移的作用,septin 2在調控細胞遷移方面的研究未見報道,septin 2作為一新型骨架蛋白在結直腸癌中的表達水平及調節細胞遷移的作用仍不清楚。為此,本研究首先檢測septin 2在4株不同轉移能力的人結直腸癌細胞株中的表達,篩選出高表達細胞株后,采用siRNA干擾方法沉默該株細胞septin 2基因,比較沉默前后該基因在結直腸癌細胞遷移中的作用,為結直腸癌轉移相關機制的研究提供新的理論依據。
材料和方法
1 主要試劑和儀器
RPMI-1640培養液購自吉諾生物醫藥技術有限公司;胎牛血清為杭州四季青生物工程材料有限公司產品;RNAisoTMPlus Total RNA提取試劑盒和實時熒光定量RT-PCR試劑盒均購自TaKaRa;蛋白提取試劑盒和蛋白質濃度測定試劑盒購自上海申能博彩生物科技有限公司;SDS-PAGE凝膠配制試劑盒、蛋白上樣緩沖液(5×)和BeyoECL Plus發光試劑盒購自碧云天公司;兔抗人septin 2多克隆抗體購自Novus Biologicals;α-tubulin鼠抗人單克隆抗體、FITC-羊抗兔IgGⅡ抗、羊抗鼠Ⅱ抗和羊抗兔Ⅱ抗購自北京中衫金橋生物技術有限公司。LipofectamineTM2000轉染試劑和 Opti-MEM培養基購自Invitrogen;FRTC標記的鬼筆環肽購自Sigma。
二氧化碳培養箱為Thermo產品;倒置相差顯微鏡和FV-1000型共聚焦顯微鏡為Olympus產品; 680型酶標分析儀和垂直凝膠電泳槽為Bio-Rad產品;高速冷凍離心機為Heraeus Beckman產品;紫外分光光度計為Beckman產品;7500 Fast Real-Time PCR System為ABI產品。
2 細胞系來源和培養
人高轉移潛能結直腸癌細胞株LoVo和低轉移潛能結直腸癌細胞株HT-29、SW480及HCT-116均由南方醫科大學基礎醫學院病理系提供,細胞用含10%胎牛血清的RPMI-1640培養基,37℃、5%CO2、飽和濕度的培養箱內常規培養,不加任何抗生素。
3 方法
3.1 實時熒光定量RT-PCR檢測4株不同轉移能力的結直腸癌細胞株中septin 2 mRN的表達 取對數生長期的4株人結直腸癌細胞株LoVo、HT-29、HCT-116和SW480,嚴格按照 RNAisoTMPlus Total RNA提取試劑盒的說明書進行RNA提取。提取的總RNA按照說明書進行逆轉錄和實時熒光定量PCR擴增。根據GenBank中相應的序列,以Primer Premier 5.0軟件設計引物,由上海英駿生物技術有限公司合成。septin 2基因引物序列:上游引物5’-CACCGAAAATCACTGAAAAAAGG-3’,下游引物5’-GCTGTTTATGAGAGTCGATTTTCCT-3’,擴增片段長度為876 bp;內參照GAPDH引物序列:上游引物5’-GCTGAGTA-TGTCGTGGAGTCT-3’,下游引物5’-GTTCACACCCATCACAAACAT-3’,擴增片段長度為146 bp。每個樣品設3個復孔,反應總體系20 μL。PCR反應條件:95℃30 s,95℃5 s,53.5℃ 34 s,72℃ 30 s,40個循環。然后進行數據分析:各目的基因表達水平的變異用變化倍率(2-ΔΔCt)來表示。
3.2 Western blotting法檢測4株細胞株中septin 2蛋白的表達 采用RIPA裂解液提取細胞總蛋白,用BCA法測定蛋白質濃度,每孔蛋白上樣50 μg,進行12%SDS-PAGE電泳,100 mA電轉PVDF膜2 h,5%脫脂奶粉室溫封閉2 h。兔抗人septin 2多克隆抗體(1∶2 000)及小鼠抗人α-tubulin單克隆抗體(1∶500)Ⅰ抗4℃過夜,Ⅱ抗為辣根過氧化酶標記山羊抗兔IgG(1∶5 000),山羊抗鼠IgG(1∶5 000)37℃與膜共孵育1 h,BeyoECL Plus發光。以Image-Pro Plus 6.0軟件分析各組灰度值,α-tubulin為內參照進行校正,以對照組面積灰度值為100%與實驗組進行比較。
3.3 脂質體轉染細胞并定性定量檢測干擾效率細胞
將LoVo細胞接種于6孔板中培養24 h。待細胞生長至80%~90%,按照脂質體轉染說明書進行操作。實驗組為4組:siRNA/832、siRNA/663、control siRNA (CON)和LoVo細胞(NC)。取轉染后的細胞用于免疫熒光及劃痕實驗。12 h后熒光顯微鏡下定性觀察轉染效果,24 h后實時熒光定量RT-PCR檢測干擾效率。各干擾序列均由上海吉瑪制藥技術有限公司合成。Scrambled siRNA引物,正義鏈5’-UUCUCCGAACGUGUC-3’,反義鏈5’-ACGUGACACGUUCGGAGAATT-3’。siRNA/832序列:正義鏈 5’-GGCGGCACAUCAUUGAUAATT-3’,反義鏈5’-UUAUCAAUGAUGUGCCGCCTT-3’。siRNA/663序列:正義鏈5’-GAGGCUUCAACUGUUGAAATT-3’,反義鏈5’-UUUCAACAGUUGAAGCCUCTT-3’。
3.4 免疫熒光激光共聚焦實驗 取轉染24 h后的4組細胞:siRNA/832、siRNA/663、CON和NC。接種于6孔培養板中,每組設3個復孔,培養板中預先置入高壓消毒的蓋玻片,常規培養24 h。取出蓋玻片,PBS沖洗3次。4%多聚甲醛室溫固定30 min,PBS沖洗3次。0.1%Triton X-100通透15 min,PBS沖洗3次。用3%BSA于室溫下封閉1 h;傾去封閉液,加septin 2抗體(1∶75)4℃孵育過夜,滴加Ⅱ抗(1∶100,含FITC-羊抗兔IgG),室溫避光孵育30 min;PBS洗3次,滴加2.5 mg/L FRTC-鬼筆環肽[由鬼筆鵝膏真菌產生的一種環肽,可與纖維狀肌動蛋白(F-actin)結合,使纖維狀肌動蛋白保持穩定,其熒光標記物是鑒定F-actin的重要試劑],37℃潮濕暗盒中靜置60 min。PBS清洗后再加DAPI室溫避光染色5 min,PBS沖洗,瀝干,置于潔凈無熒光載玻片上,于激光共聚焦顯微鏡下觀察并拍照。
3.5 細胞劃痕實驗 取轉染24 h后的3組細胞: siRNA/832、siRNA/663和 CON,每組設3個復孔。0.25%胰酶消化細胞,將細胞重懸于常規培養基中,調整細胞密度為1×109/L。按5×105cells/well接種細胞到12孔板中,用10 μL的槍頭給12孔板中的細胞劃痕,常規培養24 h,分別于劃痕后0 h、12 h、24 h每個孔取4個視野拍照,觀察劃痕愈合能力。
4 統計學處理
采用SPSS 13.0軟件進行統計分析,組間比較采用單因素方差分析(One-way ANOVA)。以P<0.05為差異有統計學意義。
結果
1 4株人結直腸癌細胞septin 2 mRNA的表達
LoVo細胞株中septin 2 mRNA的表達明顯高于HT-29、SW480和HCT-116細胞株,差異均有統計學意義(P<0.01);septin 2 mRNA在 HT-29、SW480和HCT-116細胞中均低表達,但差異沒有統計學意義(P>0.05),見圖1。
2 Western blotting檢測septin 2蛋白在不同大腸癌細胞株中的表達
Septin 2蛋白在 LoVo細胞中表達明顯強于SW480、HCT-116和HT-29細胞,差異有統計學意義(P<0.01);septin 2蛋白在HT-29、SW480和HCT-116中表達均較低,但各組間比較差異無統計學意義(P>0.05),見圖2。
3 定性定量檢測轉染效率
LoVo細胞轉染12 h后,普通熒光顯微鏡下約有70%的細胞轉入了干擾片段,見圖3。轉染24 h后,實時熒光定量RT-PCR結果顯示,與CON組相比,septin 2 mRNA的相對表達量分別下調了32.045%(siRNA/663)和67.955%(siRNA/832);與CON組相比,siRNA/663和siRNA/832組均有統計學意義(P<0.05),而與NC組之間沒有統計學意義,見圖4。
4 LoVo細胞septin 2干擾前后骨架蛋白的變化
激光共聚焦顯微鏡下觀察septin 2干擾前后細胞骨架的變化,綠色FITC和紅色FRTC分別標記septin 2及鬼筆環肽F-actin,而藍色DAPI染料復染細胞核。NC組細胞中septin 2與F-actin主要環繞細胞周邊,形成周邊肌動蛋白絲帶,septin 2表達的部位,F-actin為陽性表達,二者部位基本重合,構成微絲骨架應力纖維及片狀偽足主要成分;siRNA/832組septin 2表達減弱,相應部位的纖維狀肌動蛋白表達也減弱,見圖5。相對于CON組和siRNA/663和 siRNA/832組LoVo細胞應力纖維減少,熒光減弱,片狀偽足少而短,明顯變細,見圖6。
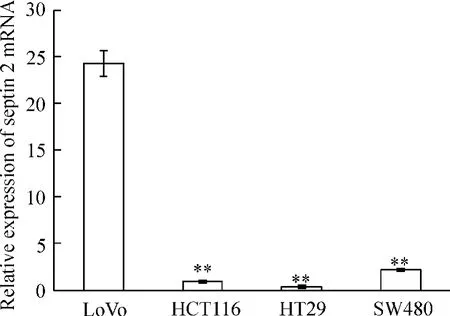
Figure 1.Expression of septin 2 mRNA in the indicated colorectal cell lines determined by real-time fluorescence quantitative RT-PCR.±s.n=3.**P<0.01 vs LoVo.圖1 實時熒光定量RT-PCR檢測septin 2 mRNA在不同大腸癌細胞株中的表達
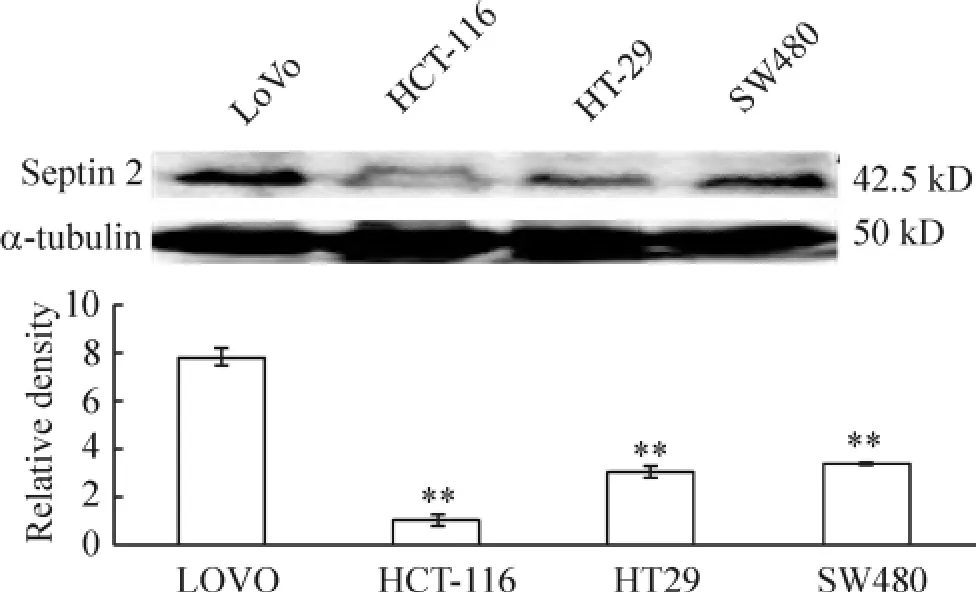
Figure 2.Expression of septin 2 protein in the indicated colorectal cell lines determined by Western blotting.The corresponding α-tubulin was shown as loading control.±s.n=3.**P<0.01 vs LoVo.圖2 Western blotting檢測septin 2蛋白在不同大腸癌細胞株中的表達

Figure 3.The effecacy of transfection was confirmed by fluorescence microscopy 12 h after transfection(×400).圖3 轉染12 h后熒光顯微鏡下觀察轉染效果
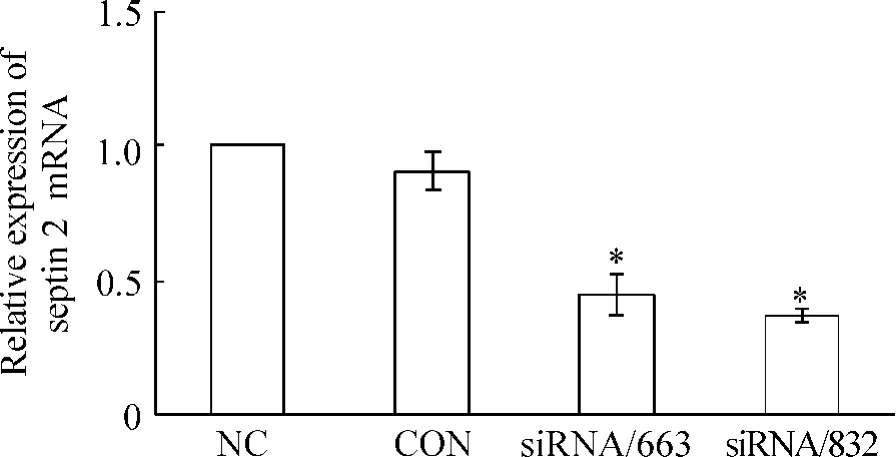
Figure 4.Expression of septin 2 mRNA in the four groups determined by real-time fluorescence quantitative RT-PCR 24 h after transfection.±s.n=3.*P<0.05 vs CON.圖4 轉染24 h后各組細胞septin 2 mRNA的變化
5 Septin 2蛋白下調后LoVo細胞的遷移能力
定向干擾septin 2基因后,與CON組相比,siRNA/663和siRNA/832組從劃痕后12 h時遷移能力變化不明顯(P>0.05),而到24 h時CON組細胞大部分“傷口”已接近愈合,而siRNA/663和siRNA/ 832組則傷口愈合不明顯,愈合能力差異具有統計學意義(P<0.01),見圖7。
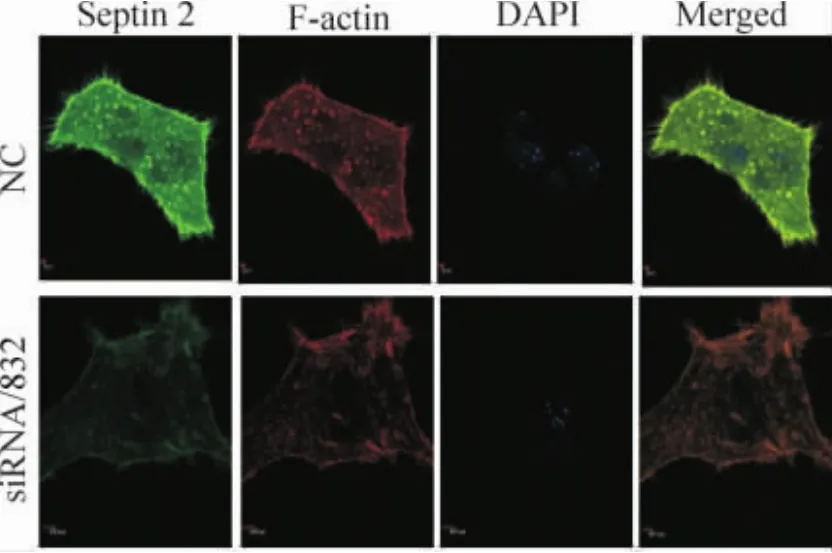
Figure 5.Co-localization of septin 2 and F-actin in LoVo cells observed by immunofluorescence and laser scanning confocal microscopy.Scale bars:2 μm.圖5 septin 2與F-actin共定位的免疫熒光共聚焦結果
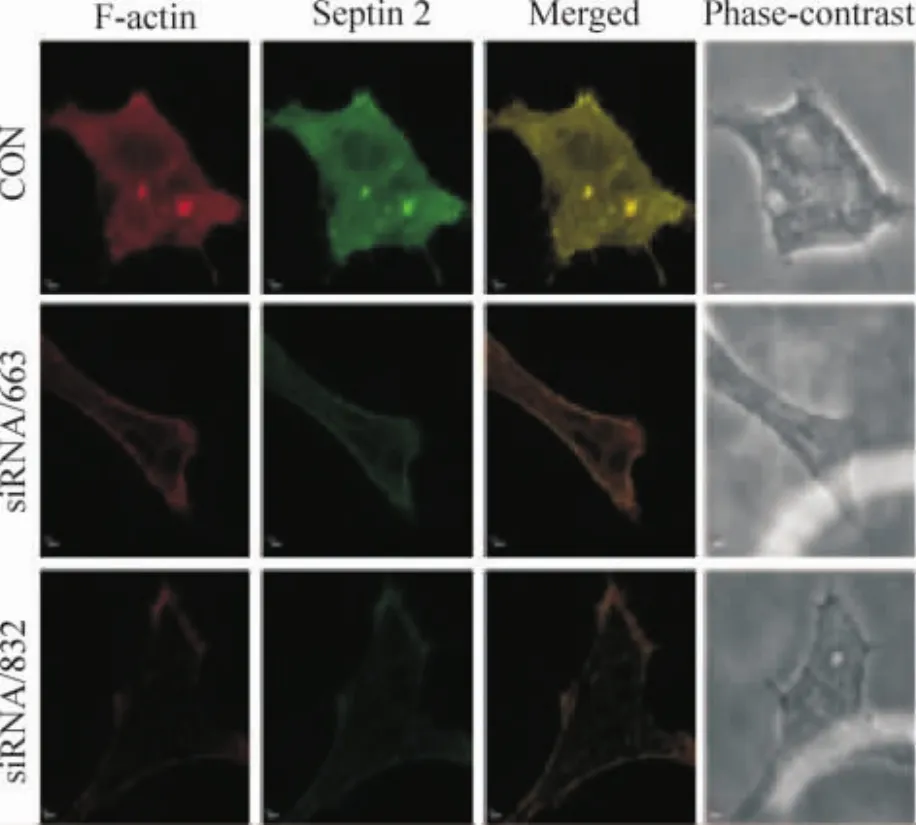
Figure 6.Silencing of septin 2 expression disturbed F-actin assembly 48 h after transfection,which was observed by immunofluorescence and laser scanning confocal microscopy.Scale bars:2 μm.圖6 siRNA靶向沉默septin 2表達后擾亂F-actin組裝的免疫熒光共聚焦結果
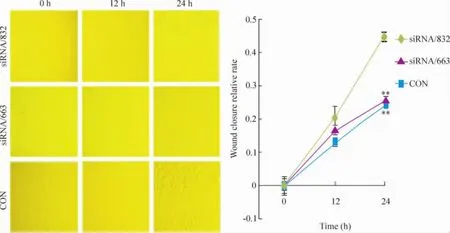
Figure 7.Effect of septin 2 silencing on wound closure of LoVo cells(×100).±s.n=3.**P<0.01 vs CON.圖7 Septin 2蛋白表達降低對細胞劃痕愈合能力的影響
討論
細胞骨架(cytoskeleton)是細胞漿中一組由細纖維網狀物質組成的網架結構,不僅具有維持細胞形狀、運動的功能,而且在蛋白質合成的調節、大分子和細胞器的運輸以及細胞代謝的協調中均發揮著重要作用。細胞骨架的異常直接影響細胞的結構和功能。新近研究發現septins與細胞骨架蛋白如肌動蛋白(actin)和α-微管蛋白(α-tubulin)等成份相互作用,被認為是一種新的細胞骨架成份[4-5]。
Septins參與細胞多種重要生理過程,包括細胞胞質分裂,細胞內物質轉運,凋亡和腫瘤的發生,在腫瘤發生過程中可能起著癌基因或抑癌基因的作用[6]。而且越來越多的證據表明,septins異常表達于某些腫瘤中,這種異常表達可能與腫瘤發生學有關[7]。截止到目前,在哺乳動物中已發現了14種septins[8]。Liu等[9]分析了14種septins在35種人類腫瘤中的表達情況,發現在大多數腫瘤中,septin 2,septin 8和septin 9,septin 11的表達顯著升高,septin 4和septin 10的表達明顯下降。
Septin 2作為一種新型骨架蛋白廣泛表達于腦腫瘤組織中[10]。本研究通過實時熒光定量 RTPCR和Western blotting檢測septin 2在4株不同轉移能力的結直腸癌細胞株LoVo、HT-29、SW480和HCT-116中的表達情況,發現septin 2在4株癌細胞中均有表達,但在高轉移株LoVo細胞的表達較低轉移株HT-29、SW480和HCT-116細胞的表達明顯增高;免疫熒光實驗檢測septin 2在LoVo細胞中的表達形態特點及其與骨架蛋白F-actin的關系,結果顯示septin 2與F-actin主要環繞在癌細胞周邊,形成周邊肌動蛋白絲帶,septin 2表達部位與F-actin表達部位基本重合,構成了微絲骨架應力纖維及片狀偽足的主要成分,在干擾了setpin 2在LoVo中的表達后,F-actin的表達也明顯減弱,兩者共同參與結直腸癌細胞的骨架組裝,兩者間存在著相互作用,這與Kremer等[3]的研究結果一致。在細胞遷移過程中,首先是細胞骨架前端伸出片狀或絲狀偽足,通過與細胞外基質建立新的黏附來維持伸展狀態;接著,細胞借助肌動蛋白、肌球蛋白調節細胞體收縮使細胞向前運動;最后,細胞尾部與基質分離并縮回,影響瘤細胞的黏附、侵襲及轉移能力[4-5,11],可見細胞骨架在細胞遷移中充當非常重要的角色。而septin 2僅在高轉移能力的結直腸癌細胞株LoVo中有高表達,并且參與細胞骨架的組裝,可能與LoVo的高轉移功能有關。本研究通過劃痕實驗檢測沉默LoVo細胞株septin 2表達前后細胞遷移能力的改變,發現定向沉默septin 2基因后,與CON組相比,siRNA/663和siRNA/832組從劃痕后12 h遷移能力變化不明顯,而到24 h時siRNA/663和siRNA/832組傷口愈合不明顯,而CON組細胞大部分“傷口”已接近愈合,結果顯示septin 2具有促進細胞遷移的作用,沉默septin 2的表達后細胞的遷移能力明顯下降。
[1] Field CM,Kellogg D.Septins:cytoskeletal polymers or signalling GTPases?[J].Trends Cell Biol,1999,9 (10):387-394.
[2] Kim SK,Shindo A,Park TJ,et al.Planar cell polarity acts through septins to control collective cell movement and ciliogenesis[J].Science,2010,329(5997):1337-1340.
[3] Kremer BE,Adang LA,Macara IG.Septins regulate actin organization and cell-cycle arrest through nuclear accumulation of NCK mediated by SOCS7[J].Cell,2007,130(5):837-850.
[4] Spiliotis ET,Hunt SJ,Hu Q,et al.Epithelial polarity requires septin coupling of vesicle transport to polyglutamylated microtubules[J].J Cell Biol,2008,180(2):295-303.
[5] Hu Q,Nelson WJ,Spiliotis ET.Forchlorfenuron alters mammalian septin assembly,organization,and dynamics[J].J Biol Chem,2008,283(43):29563-29571.
[6] Hsu SC,Hazuka CD,Roth R,et al.Subunit composition,protein interactions,and structures of the mammalian brain sec6/8 complex and septin filaments[J].Neuron,1998,20(6):1111–1122.
[7] Connolly D,Abdesselam I,Verdier-Pinard P,et al.Septin roles in tumorigenesis[J].J Biol Chem,2011,392 (8-9):725-738.
[8] Weirich CS,Erzberger JP,Barral Y.The septin family of GTPases:architecture and dynamics[J].Nat Rev Mol Cell Biol,2008,9(6):478-489.
[9] Liu M,Shen S,Chen F,et al.Linking the septin expression with carcinogenesis[J].Mol Biol Rep,2010,37 (7):3601-3608.
[10] Kim DS,Hubbard SL,Peraud A,et al.Analysis of mammalian septin expression in human malignant brain tumors[J].Neoplasia,2004,6(2):168-178.
[11] 徐菊玲,邵圣文.Cdc42蛋白與細胞遷移、極化以及細胞骨架調節的關系[J].現代預防醫學,2011,38(6): 1148-1149,1158.

