番茄黃化曲葉病毒對B型和Q型煙粉虱雌蟲體長及卵大小的影響
徐艷霞 王相晶 焦曉國 潘慧鵬 王少麗 謝 文 吳青君張友軍*
(1 東北農業大學生命科學學院,黑龍江哈爾濱 150030;2 中國農業科學院蔬菜花卉研究所,北京100081)
煙粉虱〔Bemisia tabaci(Gennadius)〕屬半翅目粉虱科,可通過取食植物韌皮部汁液,傳播植物雙生病毒,通過引起植物生理代謝紊亂、分泌蜜露、誘發真菌病害等方式對作物生產造成巨大的經濟損失(Inbar & Gerling,2007)。最新的系統發育分析、雜交試驗和交配行為觀察結果表明,煙粉虱是由至少24 個隱種構成的復合種(欒軍波和劉樹生,2010;de Barro & Ahmed,2011),由于隱種的命名尚未解決,本試驗依舊以近年來文獻中采用的生物型代替隱種的名稱。煙粉虱不同生物型之間其內共生菌的組成、抗藥性、傳播植物雙生病毒的能力等方面存在很大的差異(Luo et al.,2010;Wang et al.,2010;Chu et al.,2011)。在已知的煙粉虱生物型中,B型和Q 型是目前危害最為嚴重的兩種生物型,前者自20世紀80年代在美國造成危害以來在許多國家均有發現,是國際公認的超級害蟲;而后者則是20世紀90年代在伊比利亞半島首先發現,近年來在世界各地迅速擴散成為新的致害生物型(Guirao et al.,1997)。目前,發現Q 型和B 型煙粉虱在許多國家或地區同域發生并造成危害,如西班牙東南部地區和以色列等(褚棟 等,2007)。在我國,B 型煙粉虱于20世紀90年代入侵(羅晨 等,2002),并且迅速擴散,對我國的作物生產造成了巨大的經濟損失。Q 型煙粉虱于2003年在云南發現(褚棟 等,2005),而后逐漸取代B 型煙粉虱成為優勢生物型(Pan et al.,2011),但是有關其取代機制尚不清晰,目前備受學術界重視(褚棟 等,2007)。
番茄黃化曲葉病毒(Tomato yellow leaf curl virus,TYLCV)屬于菜豆金黃花葉病毒屬,由煙粉虱以可循環持久性的傳播方式傳播(Brown & Czosnek,2002)。在我國,TYLCV 于2005年在上海首次發現(Wu et al.,2006),隨后在浙江、江蘇、山東、北京以及河北等地均檢測到(Mugiira et al.,2008;孫作文 等,2009;張愛紅 等,2010;周濤 等,2010),對番茄生產造成了巨大的經濟損失。在植物—病毒—煙粉虱這個互作體系中,一方面,病毒對煙粉虱的生物學特性、生理生化特性等產生影響(Colvin et al.,2006;Jiu et al.,2007;劉劍,2009),并能改變其發育歷期及解毒酶等相關生化指標(劉劍,2009;歐陽志剛,2010);另一方面,病毒的存在可以誘導植物應答而改變植物體內物質,這使得取食病毒侵染的植物的昆蟲間接受到影響,從而相應影響到了植食性昆蟲的許多特性(李萌,2010)。TYLCV 是否對B 型煙粉虱與Q 型煙粉虱具有影響,這些影響是否能夠影響B 型與Q 型煙粉虱的競爭取代,目前尚不清楚。對昆蟲而言,卵的大小具有較大可塑性,且與昆蟲對環境適應性有極顯著關聯,直接影響其后代的存活率。在環境脅迫條件下,昆蟲一般產生大而少的卵,以增加幼蟲存活率;相反,在環境適宜條件下,昆蟲一般產生小而多的卵,以利于占有更適宜的生境(Duyck et al.,2006)。如單帶弄蝶雌蟲可根據寄主植物質量差異調整所產卵的大小(Mizumoto & Nakasuji,2007)。此外,病毒的感染可能對煙粉虱的生物學特性產生影響(歐陽志剛,2010)。本試驗比較研究了感染TYLCV的B 型和Q 型煙粉虱以及無毒B 型和Q 型煙粉虱在健康番茄苗上所產卵的長度和寬度的差異,并對感染此病毒的雌蟲與無毒雌蟲進行體長的比較,旨在探討B 型和Q 型煙粉虱對TYLCV 的適應性差異,進而探討TYLCV 在B 型和Q 型煙粉虱競爭取代過程中的作用。
1 材料與方法
1.1 供試蟲源
B 型煙粉虱于2004年采自中國農業科學院蔬菜花卉研究所北圃場甘藍上,然后在甘藍上繼代飼養;Q 型煙粉虱于2009年采自中蔬大森林花卉市場一品紅上,而后在一品紅上繼代飼養。
本試驗開始前,把B 型和Q 型煙粉虱分別轉接到健康和感染TYLCV 的番茄苗上隔離飼養,建立了4 個煙粉虱品系,本試驗使用時已經飼養了6 代。
1.2 供試植物
健康番茄苗:中雜9 號番茄,為中國農業科學院蔬菜花卉研究所溫室培育的未接觸任何農藥的無蟲苗。
TYLCV 感染番茄苗:菌液制備參見李萌(2010)的方法。取3 片復葉期的番茄幼苗,在莖部、葉柄部韌皮部用1 mL 一次性無菌注射器多點注射侵染性克隆菌液,每株注射0.2 mL。接種植株置于可控溫室內,一般注射25 d 后即可觀察到發病癥狀。
1.3 試驗方法
將健康番茄苗分別放置于實驗室隔離飼養6 代的4 個煙粉虱品系的養蟲籠內,飼養條件為相對濕度60%~70%,溫度30 ℃。其中包括帶毒B 型、Q 型煙粉虱番茄種群和無毒B 型、Q 型煙粉虱番茄種群,各種群數量約2 000 頭。每養蟲籠放置3 株10~12 片真葉期的健康番茄苗。待4 個品系的煙粉虱在健康番茄苗上產卵24 h 后,清除煙粉虱成蟲,每株番茄苗上隨機取10片葉,每片葉上隨機取10 個卵(發現每片葉上卵的數量均多于10 粒),在Leica 顯微鏡下用解剖針把卵剝離,依次測量每個卵的長度和寬度。另取帶毒B 型、Q 型煙粉虱品系和無毒B 型、Q 型煙粉虱品系各30 頭初羽化雌蟲,-20 ℃存放20 min,而后在Leica 顯微鏡下測量其體長。
1.4 PCR 擴增及電泳
利用Shatters 等(2009)設計的B 型、Q 型煙粉虱mtDNA COⅠ基因片段PCR 擴增特異性引物和PCR 熱循環程序鑒定B 型、Q 型煙粉虱。Q 型煙粉虱mtDNA COⅠ基因片段PCR 擴增特異性引物分別為5′CTTGGTAACTCTTCTGTAGATGTGTGTT 3′和5′CCTTCCCGCAGAAGAAATT TTGTTC 3′;B 型煙粉虱mtDNA COⅠ基因片段PCR 擴增特異性引物分別為5′CTAGGGTTTATTG TTTGAGGTCATCATATATTC 3′和5′AATATCGACGAGGCATTCCCCCT 3′;TYLCV 基因片段擴增特異性引物分別為 5′CGGAATTCATTATGGCGAAACGTCC 3′和 5′CGGGATCCTGAATGGAACA ATAGATGT 3′。PCR 熱循環程序為:95 ℃ 3 min,94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,共35 個循環,最后72 ℃延伸10 min,擴增產物大小為413 bp(Ghanim et al.,2007)。PCR 產物用1.0%瓊脂糖(0.5×TBE)電泳檢測,Biorad 凝膠成像儀觀察,記錄結果。
1.5 數據處理
采用SPSS17.0 統計軟件中獨立樣本t檢驗進行處理間試驗數據的差異顯著性分析,利用SigmaPlot 軟件對所分析數據做柱形圖。
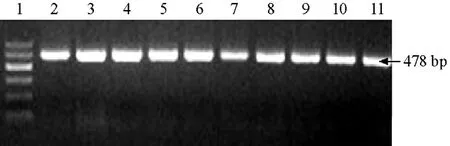
圖1 B型煙粉虱特異性引物對實驗室無毒B型煙粉虱番茄種群的擴增結果
2 結果與分析
2.1 B 型和Q 型煙粉虱特異性引物擴增結果
應用B 型煙粉虱的特異性引物從本實驗室飼養的無毒B 型煙粉虱番茄種群中擴增到1條478 bp 大小的mtDNA COⅠ基因片段(圖1);使用Q 型煙粉虱的特異性引物亦從本實驗室飼養的無毒Q 型煙粉虱番茄種群中擴增到1條303 bp 大小的mtDNA COⅠ基因片段(圖2)。應用B 型煙粉虱的特異性引物無法擴增到無毒Q型煙粉虱的此基因片段,使用Q 型煙粉虱的特異性引物亦無法擴增到無毒B 型煙粉虱的此基因片段。
2.2 TYLCV 特異性引物擴增結果
應用TYLCV 的特異性引物從本實驗室飼養的帶毒B 型、Q 型煙粉虱番茄種群中擴增到1 條413 bp 大小的TYLCV 基因片段(圖3)。
2.3 TYLCV 對B 型、Q 型煙粉虱雌蟲體長的影響
帶毒B 型與無毒B 型煙粉虱雌蟲體長分別為0.876 8 mm 和0.899 9 mm,帶毒Q 型與無毒Q 型煙粉虱雌蟲體長分別為0.863 1 mm和0.899 2 mm(圖4),表明帶毒B 型煙粉虱雌蟲體長小于無毒B 型煙粉虱(t=1.446,df=33,P=0.158),帶毒Q 型煙粉虱雌蟲體長小于無毒Q 型煙粉虱(t=1.29,df=34,P=0.206),但均無顯著差異。
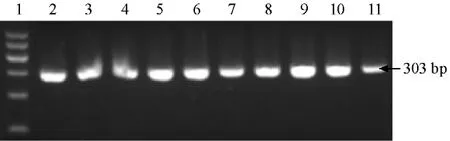
圖2 Q 型煙粉虱特異性引物對實驗室無毒Q 型煙粉虱番茄種群的擴增結果
2.4 TYLCV 對B 型煙粉虱卵長和卵寬的影響
通過對帶毒和無毒B 型煙粉虱所產卵的長度和寬度進行比較,帶毒B 型煙粉虱卵長與卵寬分別為0.178 8 mm 和0.085 0 mm,無毒B型煙粉虱卵長與卵寬分別為 0.172 2 mm 和0.082 8 mm(圖5),發現帶毒B 型煙粉虱所產卵長顯著高于無毒B 型煙粉虱(t=-2.745,df=179,P=0.007),帶毒B 型煙粉虱所產卵寬顯著高于無毒B 型煙粉虱(t=-2.613,df=179,P=0.01)。
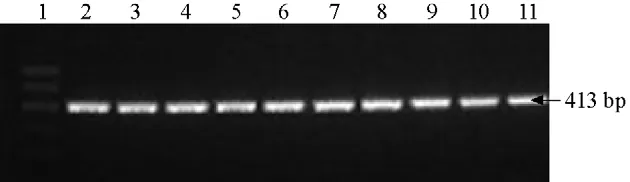
圖3 TYLCV特異性引物對實驗室帶毒B型、Q 型煙粉虱番茄種群的擴增結果
2.5 TYLCV 對Q 型煙粉虱卵長和卵寬的影響
通過對帶毒和無毒Q 型煙粉虱所產卵的長度和寬度進行比較,帶毒Q 型煙粉虱的卵長與卵寬分別為0.181 9 mm 和0.082 9 mm,無毒Q 型煙粉虱的卵長和卵寬分別為0.188 0 mm 和0.086 3 mm(圖6),發現帶毒Q 型煙粉虱所產卵的長度顯著低于無毒 Q 型煙粉虱(t=3.802,df=240,P<0.001),帶毒Q 型煙粉虱所產卵的寬度顯著低于無毒Q 型煙粉虱(t=2.836,df=240,P=0.005)。
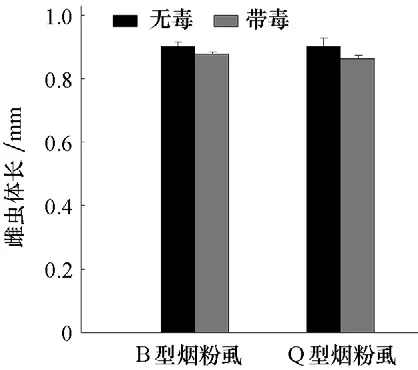
圖4 帶毒和無毒B型、Q 型煙粉虱雌蟲體長的比較
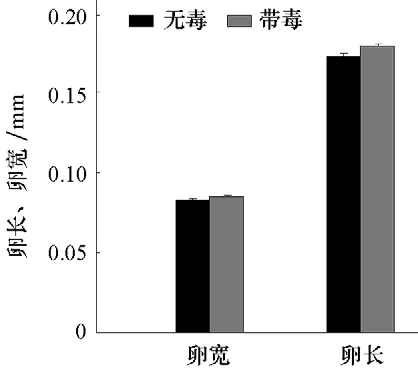
圖5 帶毒和無毒B型煙粉虱卵長和卵寬的比較
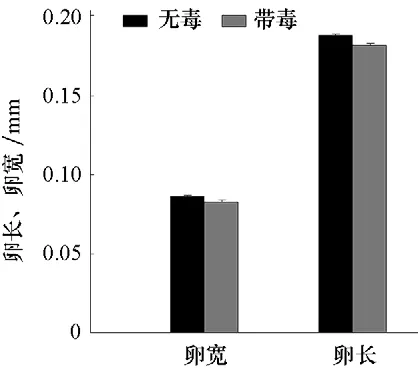
圖6 帶毒和無毒Q 型煙粉虱卵長和卵寬的比較
3 結論與討論
昆蟲在不同自然環境下對所產卵大小表現出明顯可塑性,卵的大小直接影響其后代存活率及對環境的適應性(Fox,1994;Mizumoto & Nakasuji,2007)。研究發現,許多因素可以影響植食性昆蟲所產卵粒的大小(Landa,1992;Kawecki,1995;Awmack & Leather,2002;Fischer et al.,2004)。目前普遍認為:當昆蟲處于幼蟲存活率低、低營養供應、高捕食風險的脅迫條件下時,會相應減少在寄主植物上的產卵數量,但會增加卵粒大小來調整產卵行為,這是昆蟲適應環境的一種表現(Parker & Begon,1986;Sibly et al.,1988;Kawecki,1995)。溫度是影響昆蟲產卵的常見外部因素,在非洲蝴蝶適宜的產卵溫度范圍內,該蝶在低溫條件下所產卵粒較高溫條件下所產卵粒大(Fischer et al.,2004)。Mizumoto 和Nakasuji(2007)將單帶弄蝶的卵按大小(大于0.19 mm 的L 組和小于0.16 mm 的S 組)分成兩組,在同等條件下培養發現L 組卵的存活率顯著高于S 組,L 組卵的發育歷期和蛹期顯著低于S 組,且L 組的雌蟲繁殖力較高并能產生較大后代。此外,植物的營養狀態如:碳水化合物、含氮量、植物次生代謝物質也可能影響植食性昆蟲所產卵粒的大小(Awmack & Leather,2002),且寄主植物不同器官在不同季節亦可以影響植食性昆蟲所產卵粒的大小(Landa,1992)。根據生活史理論,當后代要經歷強烈的資源競爭時,昆蟲會產出較大的卵,以增加競爭力(Mizumoto & Nakasuji,2007)。研究表明,象甲雌蟲在幼蟲或成蟲密度較高的環境中會產出較大的卵粒,以提高其適應性(Kawecki,1995)。有些植食性昆蟲雌蟲依據宿主植物質量不同而產出大小不同的卵,如單帶弄蝶會根據寄主植物表面粗糙度的差異而調整所產卵的大小(Mizumoto & Nakasuji,2007)。Skippers(Lepidoptera:Hesperiidae)也會根據宿主特異性和葉片粗糙度產出不同大小的卵(Nakasuji,1987)。
一般說來,昆蟲產生大的卵粒,由卵孵化出的幼蟲相應也大,卵期也相應短,這樣可以增加幼蟲的存活率和適應性(Fox,1994;Dukas et al.,2001)。本試驗結果發現,帶毒B 型煙粉虱在番茄上所產卵的長度和寬度均顯著大于無毒B 型煙粉虱,而帶毒Q 型煙粉虱在番茄上所產卵的長度和寬度均顯著小于無毒Q 型煙粉虱,且TYLCV 對B 型、Q 型煙粉虱雌蟲體長并無顯著影響。推測可能是TYLCV 感染對B 型和Q 型煙粉虱產卵行為產生不同修飾作用。TYLCV 感染可能對B 型煙粉虱帶來負面影響,B 型煙粉虱產生大的卵粒;相反Q 型煙粉虱適應TYLCV 的感染,感染后產生小的卵粒。目前只測定、比較了B 型和Q 型煙粉虱在感染TYLCV 和健康番茄苗上的雌蟲體長和卵粒大小,要想闡明TYLCV 在B 型和Q 型煙粉虱競爭取代中的作用,還需比較TYLCV 感染對B 型和Q 型煙粉虱生物學特性的影響及B 型和Q 型煙粉虱在健康和感染TYLCV 的番茄苗上的競爭取代。
褚棟,張友軍,叢斌,徐寶云,吳青君,朱國仁.2005.煙粉虱不同地理種群的mtDNA COI 基因序列分析及其系統發育.中國農業科學,38(1):76-85.
褚棟,劉國霞,陶云荔,萬方浩,張友軍.2007.煙粉虱Q 型與B 型種群動態及其影響因子研究進展.植物保護學報,34(3):326-330.
李萌.2010.煙粉虱—雙生病毒—寄主植物互作及植物防御機制研究〔博士論文〕.杭州:浙江大學.
羅晨,姚遠,王戎疆,閻鳳鳴,胡敦孝,張芝利.2002.利用mtDNA COI 基因序列鑒定我國煙粉虱的生物型.昆蟲學報,45(6):759-763.
劉劍.2009.煙粉虱—中國番茄黃曲葉病毒—寄主植物互作關系與營養機制的研究〔博士論文〕.杭州:浙江大學.
欒軍波,劉樹生.2010.媒介昆蟲—病毒—植物互作對生物入侵的影響.生物多樣性,18(6):598-604.
歐陽志剛.2010.雙生病毒的檢測及對煙粉虱生物學特性的影響〔碩士論文〕.福州:福建農林科技大學.
孫作文,楊進緒,張美珍,李向東.2009.山東省番茄黃化曲葉病毒的發生及其防治.中國蔬菜,(21):5-6.
張愛紅,張書敏,劉帥,邸墊平,苗洪芹.2010.2009年河北省番茄黃化曲葉病毒病發生危害和分布.植物保護,36(4):127-129.
周濤,師迎春,陳笑瑜,范在豐.2010.北京地區番茄黃化曲葉病毒病的鑒定及防治對策.植物保護,36(2):116-118.
Awmack C S,Leather S R.2002.Host plant quality and fecundity in herbivorous insects.Annual Review of Entomology,47:817-844.
Brown J K,Czosnek H.2002.Whitefly transmission of plant viruses.Advances in Botanical Research Incorporating Advances in Plant Pathology,36:65-76.
Chu D,Gao C S,de Barro P,Zhang Y J,Wan F H,Khan I A.2011.Further insights into the strange role of bacterial endosymbionts in whitefly,Bemisia tabaci:comparison of secondary symbionts from biotypes B and Q in China.Bulletin of Entomological Research,101:477-486.
Colvin J,Omongo C A,Govindappa M R,Stevenson P C,Maruthi M N,Gibson G,Seal S E,Muniyappal V.2006.Host-plant viral infection effects on arthropod-vector population growth,development and behaviour:management and epidemiological implications.Advances in Virus Research,67:419-452.
de Barro P,Ahmed M Z.2011.Genetic networking of theBemisia tabacicryptic species complex reveals pattern of biological invasions.PLoS One,6(10):25579.
Dukas R,Prokopy R J,Jian J D.2001.Effects of larval competition on survival and growth in Mediterranean fruit flies.Ecological Entomology,26:587-593.
Duyck P F,David P,Junod G,Brunel C,Dupont R,Quilici S.2006.Importance of competition mechanisms in successive invasions by polyphagous tephritids in La Réunion.Ecology,87(7):1770-1780.
Fischer K,Bot A N M,Zwaan B J,Brakefield P M.2004.Genetic and environmental sources of egg size variation in the butterflyBicyclus anynana.Heredity,92:163-169.
Fox C W.1994.The influence of egg size on offspring performance in the seed beetle,Callosobruchus maculates.Oikos,71:321-325.
Ghanim M,Sobol I,Ghanim M,Czosnek H.2007.Horizontal transmission of begomoviruses betweenBemisia tabacibiotypes.Arthropod-Plant Interactions,1(3):195-204.
Guirao P,Beitia F,Cenis J L.1997.Biotype determination of Spanish populations ofBemisia tabaci(Hemiptera:Aleyrodidae).Bulletin of Entomological Research,87(6):587-593.
Inbar M,Gerling D.2007.Plant-mediated interactions between whiteflies,herbivores,and natural enemies.Annual Review of Entomology,53:431-448.
Jiu M,Zhou X P,Tong L,Xu J,Yang X,Wan F H,Liu S S.2007.Vector-virus mutualism accelerates population increase of an invasive whitefly.PloS One,2:182.
Kawecki T J.1995.Adaptive plasticity of egg size in response to competition in the cowpea weevil,Callosobruchus maculatus(Coleoptera:Bruchidae).Oecologia,102:81-85.
Landa K.1992.Adaptive seasonal variation in grasshopper offspring size.Evolution,46:1553-1558.
Luo C,Jones C M,Devin G,Zhang F,Denholm I,Gorman K.2010.Insecticide resistance inBemisia tabacibiotype Q(Hemiptera:Aleyrodidae)from China.Crop Protection,29:429-434.
Mizumoto M,Nakasuji F.2007.Egg size manipulation in the migrant skipper,Parnara guttata guttata(Lepidoptera:Hesperiidae),in response to different host plants.Population Ecology,49:135-140.
Mugiira R B,Liu S S,Zhou X P.2008.Tomato yellow leaf curl virusandTomato leaf curl Taiwan virusinvade south-east coast of China.Journal of Phytopathol,156:217-221.
Nakasuji F.1987.Egg size of skippers(Lepidoptera:Hesperiidae)in relation to their host specificity and to leaf toughness of host plants.Ecological Research,2:175-183.
Pan H P,Chu D,Ge D Q,Wang S L,Wu Q J,Xie W,Jiao X G,Liu B M,Yang X,Yang N N,Su Q,Xu B Y,Zhang Y J.2011.Further spread of and domination byBemisia tabacibiotype Q on field crops in China.Journal of Economic Entomology,104:978-985.
Parker G A,Begon M.1986.Optimal egg size and clutch size:effects of environment and maternal phenotype.American Naturalist,128:573-592.
Shatters R G J,Powell C A,Boykin L M,Liansheng H,McKenzie C L.2009.Improved DNA barcoding method forBemisia tabaciand related Aleyrodidae:development of universal andBemisia tabacibiotype-specific mitochondrial cytochrome c oxidase I polymerase chain reaction primers.Journal of Economic Entomology,102(2):750-758.
Sibly R,Calow P,Smith R H.1988.Optimal size in seasonal breeders.Journal of Theoretical Biology,133(1):13-21.
Wang Z Y,Yan H F,Yang Y H,Wu Y.2010.Biotype and insecticide resistance status of the whiteflyBemisia tabacifrom China.Pest Management Science,66:1360-1366.
Wu J B,Dai F M,Zhou X P.2006.First report ofTomato yellow leaf curl virusin China.Annals of Applied Biology,155:439-448.

