基于光激活定位顯微鏡的膜蛋白鑒定技術
黃麗,方維煥,,俞盈,宋厚輝
1 浙江農林大學動物科技學院,浙江 臨安 311300
2 浙江大學動物預防醫學研究所 浙江省動物預防醫學重點實驗室,浙江 杭州 310058
光激活定位顯微成像技術 (Photo-activated localization microscopy,PALM) 是最近幾年來才逐漸發展起來的、可以在活體水平進行的、且分辨率達到納米級別、并優于激光共聚焦和雙光子顯微鏡的新一代三維成像技術[1-2]。該技術的原理是采用熒光基團修飾技術,將各種常見的熒光蛋白進行突變,突變后的蛋白在光束下 (一般為405 nm激光或者紫外) 被活化,并釋放出光子信號,然后利用光激活定位顯微鏡進行捕獲和識別,最終可以捕捉到單分子信號,分辨率達到5~20 nm或者更高[2],其中分辨率的高低取決于熒光蛋白的特性。目前可以被光子激活(Photoactivatable,PA) 的熒光蛋白有:PAGFP[3]、 PAmCherry[4]、mEos2[5]、PATagRFP[6]等。如果這些蛋白不被405 nm激光激活,在普通熒光顯微鏡下不呈現任何熒光 (mEos2除外),在光激活定位顯微鏡下也不釋放任何信號。但是這些熒光蛋白一旦被激活,PAGFP[3]、PAmCherry[4]、PATagRFP[6]等在普通顯微鏡下將呈現熒光,例如:PAGFP被激活后,在熒光顯微鏡下為綠色熒光。但對于在普通熒光顯微鏡下呈現綠色熒光的mEos2,被405 nm激光激活后,將表現出紅色熒光 (即出現光轉換現象,Photoconvertable),隨著激發時間延長,綠色熒光越來越弱,而紅色熒光越來越強,且釋放出光子。
病原菌膜蛋白作為潛在的藥物靶位、細胞受體和納米通道越來越受到研究者的關注[7-9]。對于未知功能的膜蛋白,在研究的初始階段仍然需要依賴生物信息學軟件,通過已公布的基因組學信息,對蛋白結構和功能進行預測,進而通過實驗設計進行驗證,包括:膜蛋白表達、純化、鑒定、分離和定位研究等[10]。其中,對細菌膜蛋白定位的研究,目前已經公布的方法有蛋白酶K實驗和全細胞 ELISA實驗[10-11]。這兩種方法的原理是:如果膜蛋白暴露在細胞外部,將會被蛋白酶K裂解或者被相應的抗體識別。但是這兩種方法共有的缺陷是:如果膜蛋白具有蛋白酶抗性;或者被多糖、脂類等包裹,利用蛋白酶K實驗和全細胞ELISA鑒定膜蛋白都是無效的[11]。因此,如何設計一種精確的實驗對細菌膜蛋白的定位進行直接觀察,一直是困擾研究者的難題。
結核分枝桿菌 (Mycobacterium tuberculosis,Mtb) 是引起肺結核 (Tuberculosis, TB) 的致病菌,目前全球大約有1/3人口為結核陽性。根據WHO最新報告,2010年全球大約有145萬人口死于TB[12]。由于Mtb可以通過空氣傳播,且需要嚴格的生物安全三級實驗室才能進行病原學研究,為了加快Mtb蛋白組學的研究進展,研究人員往往采取非致病性的恥垢分枝桿菌(Mycobacterium smegmatis, Msmeg) 或者卡介苗分枝桿菌(M. bovis BCG) 作為模式菌,通過在非致病菌中表達Mtb蛋白,來間接研究Mtb蛋白功能[10,13-14]。
為了能夠精確地對 Mtb膜蛋白的定位情況進行原位追蹤,本研究采用無致病性的 Msmeg作為模式菌,以結核分枝桿菌外膜蛋白OmpA作為參考蛋白,應用光激活蛋白mEos2和光激活定位顯微成像技術研究膜蛋白的定位。這是目前為止采用光激活定位顯微成像技術研究膜蛋白定位的首次報道。
1 材料與方法
1.1 材料
1.1.1 化學試劑、菌株和質粒
本實驗室所用的化學試劑均為分析純,購自Sigma、USP和BD等公司。恥垢分枝桿菌Mc2155為本實驗室保存。大腸桿菌克隆用菌株為DH5α。
1.1.2 細菌培養
大腸桿菌培養基為LB培養基,37 ℃培養。恥垢分枝桿菌培養基為 7H9培養基 (液體) 和7H10培養基 (固體),37 ℃培養。篩選用抗生素濃度:Hygromycin (潮霉素,50~200 mg/L)。
1.2 蛋白酶K實驗
蛋白酶 K實驗采用本實驗室已報道的方法進行[10]。即:將pML003 (表達結核分枝桿菌外膜蛋白 OmpA) 質粒[10]轉化入能夠表達內膜蛋白PhoA (堿性磷酸酶) 的恥垢分枝桿菌ML1301中[15],裂解或者不裂解細菌,用蛋白酶 K處理后,分別用對應的抗體通過Western blotting檢測OmpA (結核分枝桿菌外膜蛋白A)、PhoA (內膜蛋白,堿性磷酸酶)、MspA[16](恥垢分枝桿菌外膜蛋白,porin) 和RNA聚合酶 (RNAP,胞內蛋白) 的完整性。
1.3 mEos2和OmpA的融合表達
1.3.1 mEos2的基因修飾
由于分枝桿菌為高GC含量細菌,外源基因一般很難在其內進行表達。為此,我們將mEos2蛋白按照恥垢分枝桿菌密碼子進行優化,在 3¢端加入了HA標簽 (由GenScript公司進行合成),并命名為mEos2m。為了便于克隆,在mEos2m基因5¢和3¢端分別加入了PacⅠ和Hind Ⅲ酶切位點,直接克隆入pUC57載體中,命名為pUC57-mEos2m (由GenScript公司直接提供)。
1.3.2 mEos2m表達載體以及 mEos2m-OmpA融合表達載體的構建
mEos2m表達載體的構建:通過PacⅠ/Hind Ⅲ雙酶切,將mEos2m片段從pUC57-mEos2m中切下,連接到pML003載體[10](含有分枝桿菌強啟動子psmyc) 中,得到mEos2m表達載體pSL004。
OmpA-mEos2m融合表達載體的構建:采用OmpA-up-PacⅠ/OmpA linker-rev引物對,以pML003作為模板,PCR擴增OmpA片段;然后采用linker mEos2m-fwd/Eos2m-seq2引物對,以pUC57-mEos2m為模板,PCR擴增mEos2m片段;最后采用融合 PCR技術,以 OmpA-up-PacⅠ/ Eos2m-seq2為引物,以 OmpA片段和 mEos2m片段為模板,擴增OmpA-mEos2m片段。融合片段以 PacⅠ和 Hind Ⅲ酶切位點克隆入 pML003載體[10],得到 OmpA-mEos2m融合表達載體pSL005,其中OmpA和mEos2m片段之間含有柔性接頭氨基酸:GSSGSSG。引物名稱和序列如表1所示。

表1 引物名稱和序列Table1 Primers used in this study
1.4 分枝桿菌感受態細胞的制備和轉化
恥垢分枝桿菌感受態細胞的制備和電穿孔轉化采用本實驗室報道的方法進行[17]。即:將分枝桿菌在 100 mL 7H9液體培養基中培養至OD600為0.5,離心收獲菌體,用10%預冷的甘油將菌體洗滌3次,最后用1 mL 10%甘油懸浮菌體 (感受態細胞)。電穿孔轉換參數為:1 000 ?,2.5 kV,25 μF。電擊杯寬度為4 mm。
1.5 細菌的玻片固定
對于體視顯微鏡,細菌菌落不需要固定,可以直接進行觀察。但是對于熒光顯微鏡和光激活定位顯微鏡,樣品需要經過固定后才能進行觀察。固定方法如下:準備200 μL新鮮的細菌液,10 000 r/min離心1 min,收集菌體,然后用PBS (8 g NaCl,0.2 g KCl,1.44 g Na2HPO4,0.24 g KH2PO4,定容至 1 L,pH 7.4) 洗滌 2次。用200 μL PBS (含 2%多聚甲醛+0.2%戊二醛) 懸浮細菌。室溫靜置10 min,離心收集菌體,并用PBS洗滌2次。用200 μL PBS (含0.1%硼氫化鈉,在1 min內完成配制過程,直接使用) 懸浮細菌。室溫靜置7 min,離心收集菌體,并用PBS洗滌 2次,然后用 200 μL PBS懸浮細菌。取100 μL滴在多聚賴氨酸處理的載玻片 (Fisher公司) 上,室溫靜置15 min。用PBS輕輕洗滌載玻片,洗去未被吸附的菌體,覆上蓋玻片。用擦鏡紙壓拭蓋玻片,輕輕拭去多余的液體。用凡士林封片后,直接用熒光顯微鏡和光激活定位顯微鏡進行觀察。
1.6 顯微成像技術
本實驗用的顯微鏡有:Zeiss體視熒光顯微鏡 (Stemi2000),Zeiss正置熒光顯微鏡 (Axio)和PALM光激活定位顯微鏡 (由美國HHMI的Hess實驗室搭建,詳細配置見文獻[1])。光激活采用405 nm LED自制光源 (針對體視熒光顯微鏡和正置熒光顯微鏡) 或者 405 nm激光 (針對光激活定位顯微鏡)。mEos2m蛋白光轉換吸收波峰為573 nm,發射波峰為584 nm。
2 結果與分析
2.1 外膜蛋白OmpA (細胞外loop) 和MspA對蛋白酶K不敏感
外膜蛋白通常會有部分 loop區域暴露在細胞外面并與外部環境接觸。如果該loop區域被蛋白酶K降解,外膜蛋白將因失去完整性而失去活性。為此,我們利用經典的蛋白酶 K 實驗[11-18]驗證在分枝桿菌中已經被證實的兩個外膜蛋白OmpA[19]和MspA[16]的細胞外部分是否會被蛋白酶K降解,從而推斷其在細胞膜上的定位情況。結果發現:雖然暴露在細胞外面的OmpA的loop區域可以被 OmpA抗體識別[19],但是裸露在細胞外部的loop并不能被蛋白酶K降解 (圖1A,“whole”)。同樣,對于熱穩定性的八聚體外膜蛋白MspA,用蛋白酶K直接處理裂解的細胞,MspA也不會被降解 (圖1D,“lysed”);這說明多聚體蛋白本身對蛋白酶K不敏感。而超聲波裂解細胞中的OmpA (圖1A,“lysed”),內膜蛋白PhoA (圖1B,“lysed”) 和胞內蛋白RNAP (圖1C,“lysed”) 對蛋白酶K都是敏感的。這說明蛋白酶 K實驗并不能作為一個通用方法檢測膜蛋白的表面接觸性能,需要進一步開發新的鑒定膜蛋白的方法。
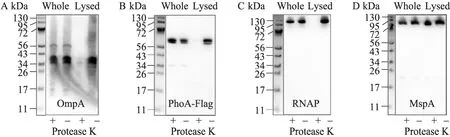
圖1 蛋白酶K敏感性試驗Fig. 1 Protease K sensitivity assay. M. smegmatis ML1301 (PhoA, OmpA and MspA expressing strain) whole cells (indicated with “whole”) and lysed cells (indicated with “lysed”) were treated with (indicated with “+”) or without (indicated with “-”) protease K. The reactions were terminated by adding protease K inhibitor cocktails. All samples were boiled for 10 min in the presence of protein loading buffer and separated on 10% SDS-PAGE, detected by anti-OmpA, anti-Flag, anti-RNAP and anti-MspA antibodies respectively.
2.2 光激活熒光蛋白 mEos2m和普通綠色熒光蛋白GFP在恥垢分枝桿菌中的表達
mEos2m進行了密碼子優化,通過 pSL004 (mEos2m表達載體)、pSL005 (OmpA-mEos2m融合表達載體) 在恥垢分枝桿菌中進行表達。為了更直觀地區別 mEos2m和普通的綠色熒光蛋白GFP的不同,我們將pMN406 (GFP) 和pML1429 (OmpA-GFP) 在恥垢分枝桿菌中進行表達。通過熒光體視顯微鏡 (圖2),發現mEos2m及其融合蛋白在分枝桿菌中完全可以實現表達,在光激活之前 (圖2,“Before PA”)呈現綠色熒光,在光激活之后呈現紅色熒光 (圖2,“After PA”)。而普通的GFP及其融合蛋白,在光激活之前呈現綠色熒光;在光激活后熒光不發生轉換 (圖2)。
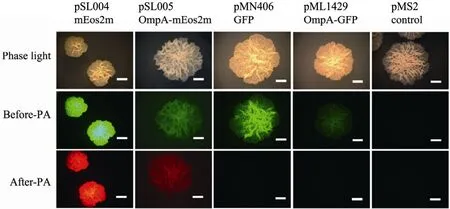
圖2 光激活蛋白mEos2m和普通綠色熒光蛋白在恥垢分枝桿菌中的表達Fig. 2 Expression of photoactivatable mEos2m and regular GFP in M. smegmatis. The colonies were visualized under Zeiss fluorescent stereomicroscope before being activated under 405 nm LED light (“Before-PA”) or thereafter (“After-PA). The plasmid and corresponding proteins are indicated on top panel. pMS2, an empty plasmid without any inserts, was used as control. 16-fold magnification was employed under microscope. Scale bar=1 mm.
這說明光激活熒光蛋白 mEos2m及其融合蛋白可以在恥垢分枝桿菌中正確表達且具有光激活現象。這也是進行光激活定位顯微鏡操作之前的準備工作,即:開啟光激活定位顯微鏡之前,必須先用普通的熒光體視顯微鏡或者正置熒光顯微鏡觀察目的蛋白是否具有熒光且呈現光激活現象。這是因為光激活定位顯微鏡捕捉的是單分子信號,只有這些單分子信號達到一定數量之后,才能呈現高分辨率圖像,因此需要的成像時間更長。比如:普通熒光顯微鏡從觀察、鎖定圖像到拍照僅需要幾分鐘時間,而通過光激活定位顯微鏡,每個樣品從上機調試到鎖定圖像和拍照至少需要2 h或者更長。因此,如果對樣品特性不了解,直接利用PALM調試,無論在時間還是金錢上都是一種浪費。
2.3 光激活熒光蛋白 mEos2m對恥垢分枝桿菌形態的影響
mEos2m與OmpA融合表達后,融合蛋白將會被牽引到細胞膜上,此時細胞的形態可能會發生變化。為了進一步研究光激活熒光蛋白mEos2m對單個細菌形態的影響,我們在正置顯微鏡下對菌落形態進行了觀察 (圖3)。由于圖2中的 GFP為普通的綠色熒光蛋白,不呈現任何光激活現象,無法進行隨后的PALM分析。所以,我們僅采用mEos2m (pSL004) 和OmpA-mEos2m (pSL005) 融合蛋白表達菌株進行熒光和光激活分析。對于僅表達mEos2m的分枝桿菌,表達的mEos2m蛋白聚集于細胞內部;從形態上可以看到表達 OmpA-mEos2m融合蛋白的分枝桿菌(圖3B) 比表達mEos2m單一蛋白的分枝桿菌更“胖”(圖3A,3B),這一點與預期一致。
普通的熒光顯微鏡 (包括激光共聚焦) 對熒光信號僅能對熒光進行定性觀察,不能進行光子捕捉,其最高分辨率僅能達到200 nm左右,而光激活定位顯微鏡的分辨率已經超過了20 nm[1]。這也是本研究采用超分辨率 PALM進行膜蛋定位研究的另一目的。
2.4 光激活定位顯微鏡下的膜蛋白
為了進一步驗證 PALM是否可以用于膜蛋白定位研究,以及膜蛋白在分枝桿菌細胞膜上的準確定位,將含有光激活蛋白的分枝桿菌固定于多聚賴氨酸載玻片后,用405 nm激光激發,然后用PALM觀察 (圖4)。在PALM顯微鏡下,所有的熒光信號都將以光子的形式釋放出來,每一個亮點代表一個單分子信號 (圖4)。圖像中的彩色斑點代表光子信號距離拍攝鏡頭的遠近。按照七種色彩,紅橙黃綠青藍紫依次代表光子距離拍攝鏡頭由近到遠。然后通過計算機軟件計算出光子在物體上的分布。由于OmpA-mEos2m融合蛋白主要定位于細胞膜上,所以通過縱切面 (Y-Z軸,圖4D) 可以看到所有光子信號形成一個“桶狀”(Barrel-like) 或者“帶狀”(Belt-like) 結構,而單一的 mEos2m蛋白,由于位于細胞內,在Y-Z縱切面圖中將呈現均勻分布 (圖 4G)。值得一提的是,PALM顯微鏡下的X-Y (橫切面) 和Y-Z (縱切面) 并不需要對細菌進行物理切割,而是通過軟件轉換實現三維成像。目前,PALM還處于不斷革新和完善之中,對光學配件、計算機硬件和軟件系統等都有特殊要求,雖然Zeiss和Nikon等公司已經有商品化樣機出售,但是價格是激光共聚焦顯微鏡的數倍。本實驗室使用的PALM 為自行搭建的顯微鏡平臺,軟件也是在Metlab的基礎上進行自主開發。上述實驗表明:PALM可以用于膜蛋白的精準定位研究。
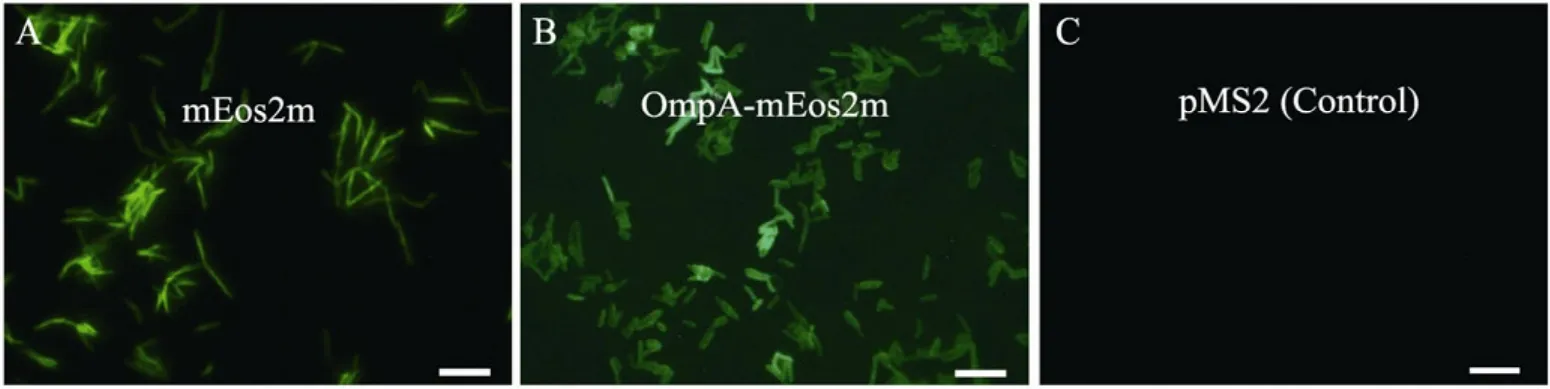
圖3 光激活蛋白mEos2m在恥垢分枝桿菌中的表達Fig. 3 Expression of photoactivatable mEos2m in M. smegmatis. The bacterial cells expressing mEos2m (A) and OmpA-mEos2m (B) were fixed on slides and visualized under Zeiss fluorescent research microscope. pMS2, an empty plasmid without any inserts, was used as control (C). Scale bar=5 μm.

圖4 外膜蛋白OmpA在恥垢分枝桿菌細胞膜上的定位Fig. 4 Localization of OmpA in the membrane region of M. smegmatis. The bacterial cells expressing photoactivatable OmpA-mEos2m (A-D) and mEos2m (E-G) were fixed on slides, activated by 405 nm laser, and visualized under a self-built photoactivated localization microscope (PALM).
3 討論
基于光激活原理的超分辨率 PALM顯微成像技術,也稱為 STORM (Stochastic optical reconstruction microscopy)[20-22],該技術通過控制熒光基團來實現超分辨率成像,克服了傳統光學顯微鏡中存在的諸如衍射等瓶頸問題[23]。目前在PALM 技術方面走在國際前沿的實驗室有哈佛大學Zhuang實驗室、美國HHMI Hess實驗室、美國 NIH兒童健康和發育研究所的 Lippincott-Schwartz實驗室等。本實驗室利用PALM技術首次實現了膜蛋白的定位研究,并在恥垢分枝桿菌中成功表達了mEos2m及其融合蛋白,為下一步利用細菌感染宿主細胞,進行細菌追蹤、定位和活體成像奠定了基礎。
除了mEos2m之外,本實驗室還在分枝桿菌中表達了具有光激活特性的 PAmCherry,PATagRFP及其與OmpA的融合蛋白,這些光激活蛋白都可以作為膜蛋白的標記分子,其中mEos2m在單位時間內釋放的光子最多,因此我們選用mEos2m進行了詳細闡述。
除了OmpA外膜蛋白之外,MspA也是在分枝桿菌中被廣泛關注的外膜蛋白。與 OmpA不同,MspA是一種孔道蛋白,可以形成在煮沸條件下也不會失去活性的八聚體蛋白[16],主要負責各種親水性營養物質[24]、無機鹽[15]和小分子藥物轉運[25],目前正被用作新型納米通道進行核酸納米測序研究[7]。我們發現完整的MspA八聚體結構是其功能和定位得以實現的前提,當MspA與mEos2m等任意熒光蛋白融合后,將破壞其八聚體結構的形成,表現為在平板上的菌落形態與mspA基因敲除株類似 (結果未列出),這說明八聚體機構被破壞后,喪失了對各種營養物的攝取能力。這從另一個角度也說明對于自身可以形成多聚體的膜蛋白,與其他蛋白融合表達時將可能失去其原有的空間結構。此外,由于MspA對蛋白酶K不敏感 (圖1A),無論利用蛋白酶K實驗還是PALM,MspA都不是一個很好的參考蛋白。這也是在膜蛋白研究領域中的一個共識:沒有一種方法對所有膜蛋白都適合。
PALM作為一種新的三維成像技術,其優點是“超分辨率”;這種超分辨率必須借助具有光激活特性的熒光蛋白和能夠捕捉光子的顯微鏡才能實現,而普通的綠色熒光蛋白和普通的熒光顯微鏡和激光共聚焦都無法達到這種效果。但是PALM技術本身也有“缺點”,主要體現在:1) 實際操作時間長。一般對每個樣品光信號捕獲需要的時間為2~3 h或者更長。2) 價格昂貴。目前在全球也只有少數幾個實驗室才能擁有,基本上都是自行搭建的平臺。但是作為一種新型技術以及科研發展的需求尤其是納米技術發展的需要,超分辨率成像技術將是未來科學發展的趨勢。尤其是近幾年Zeiss和Nikon等公司推出商品化的樣機以來,相信PALM將很快在國內普及。
綜上,本實驗室通過光激活蛋白mEos2m成功建立了一種直接用于膜蛋白定位的研究方法,并以非致病性的恥垢分枝桿菌為模型研究致病性的結核分枝桿菌膜蛋白定位和功能,為膜蛋白的研究提供了新的思路。
REFERENCES
[1] Shtengel G, Galbraith JA, Galbraith CG, et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. Proc Natl Acad Sci USA, 2009, 106(9): 3125?3130.
[2] Betzig E, Patterson GH, Sougrat R, et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science, 2006, 313(5793): 1642?1645.
[3] Testa I, Parazzoli D, Barozzi S et al. Spatial control of pa-GFP photoactivation in living cells. J Microsc, 2008, 230(Pt 1): 48?60.
[4] Subach FV, Patterson GH, Manley S et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods, 2009, 6(2): 153?159.
[5] Baker SM, Buckheit RW, Falk MM. Green-to-red photoconvertible fluorescent proteins: tracking cell and protein dynamics on standard wide-field mercury arc-based microscopes. BMC Cell Biol, 2010, 11(1): 15.
[6] Subach FV, Patterson GH, Renz M, et al. Bright monomeric photoactivatable red fluorescent protein for two-color super-resolution sptPALM of live cells. J Am Chem Soc, 2010, 132(18): 6481?6491.
[7] Derrington IM, Butler TZ, Collins MD, et al. Nanopore DNA sequencing with MspA. Proc Natl Acad Sci USA, 2010, 107(37): 16060?16065.
[8] Butler TZ, Pavlenok M, Derrington IM, et al. Single-molecule DNA detection with an engineered MspA protein nanopore. Proc Natl Acad Sci USA, 2008, 105(52): 20647?20652.
[9] Svetliíková Z, ?kovierová H, Niederweis M, et al. Role of porins in the susceptibility of Mycobacterium smegmatis and Mycobacterium chelonae to aldehyde-based disinfectants and drugs. Antimicrob Agents Chemother, 2009, 53(9): 4015?4018.
[10] Song HH, Sandie R, Wang Y, et al. Identification of outer membrane proteins of Mycobacterium tuberculosis. Tuberculosis, 2008, 88(6): 526?544.
[11] Brok R, van Gelder P, Winterhalter M, et al. The C-terminal domain of the Pseudomonas secretin XcpQ forms oligomeric rings with pore activity. J Mol Biol, 1999, 294(5): 1169?1179.
[12] WHO report 2011 global tuberculosis control[EB/OL]. [2012-04-18]. http://www.who.int/ tb/publications/global_report/en/.
[13] Wolschendorf F, Ackart D, Shrestha TB, et al. Copper resistance is essential for virulence of Mycobacterium tuberculosis. Proc Natl Acad Sci USA, 2011, 108(4): 1621?1626.
[14] Siroy A, Mailaender C, Harder D, et al. Rv1698 of Mycobacterium tuberculosis represents a new class of channel-forming outer membrane proteins. J Biol Chem, 2008, 283(26): 17827?17837.
[15] Wolschendorf F, Mahfoud M, Niederweis M. Porins are required for uptake of phosphates by Mycobacterium smegmatis. J Bacteriol, 2007, 189(6): 2435?2442.
[16] Faller M, Niederweis M, Schulz GE. The structure of a mycobacterial outer-membrane channel. Science, 2004, 303(5661): 1189?1192.
[17] Song HH, Wolschendorf F, Niederweis M. Construction of unmarked deletion mutants in mycobacteria//Parish T, Brown A. Mycobacteria Protocols. Ottawa: Humana Press, 2008: 279?295.
[18] M?ller JV, Ning G, Maunsbach AB, et al. Probing of the membrane topology of sarcoplasmic reticulum Ca2+-ATPase with sequence-specific antibodies. Evidence for plasticity of the C-terminal domain. J Biol Chem, 1997, 272(46): 29015?29032.
[19] Song HH, Huff J, Janik K, et al. Expression of the ompATb operon accelerates ammonia secretion and adaptation of Mycobacterium tuberculosis to acidic environments. Mol Microbiol, 2011, 80(4): 900?918.
[20] Huang B, Jones SA, Brandenburg B, et al. Whole-cell 3D STORM reveals interactions between cellular structures with nanometer-scale resolution. Nat Methods, 2008, 5(12): 1047?1052.
[21] Bates M, Huang B, Dempsey GT, et al. Multicolor super-resolution imaging with photo-switchable fluorescent probes. Science, 2007, 317(5845): 1749?1753.
[22] Rust MJ, Bates M, Zhuang XW. Sub-diffractionlimit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods, 2006, 3(10): 793?795.
[23] Huang B, Babcock H, Zhuang X. Breaking the diffraction barrier: super-resolution imaging of cells. Cell, 2010, 143(7): 1047?1058.
[24] Song HH, Niederweis M. Uptake of sulfate but not phosphate by Mycobacterium tuberculosis is slower than that for Mycobacterium smegmatis. J Bacteriol, 2012, 194(5): 956?964.
[25] Danilchanka O, Pavlenok M, Niederweis M. Role of porins for uptake of antibiotics by Mycobacterium smegmatis. Antimicrob Agents Chemother, 2008, 52(9): 3127?3134.

