魚腥草素鈉對銅綠假單胞菌生物被膜的清除作用
程惠娟,汪長中,胡躍龍,盧文波,高磊,李露天
(安徽中醫學院,安徽合肥230038)
銅綠假單胞菌Pseudomonas aeruginosa是呼吸道重要的生物被膜菌,生物被膜菌最顯著的特征是高度的耐藥性。因此,常引起難治性呼吸道生物被膜病。尋找抗細菌生物膜的藥物,防治細菌生物膜病已成為全球關注的重大難題,是目前研究的前沿和熱點。中藥有效成分魚腥草素鈉在臨床治療慢性支氣管炎及其他上呼吸道感染性疾病中有較好療效,其機理未明。本課題研究魚腥草素鈉對銅綠假單胞菌早期生物被膜及成熟期生物被膜的清除作用,以進一步闡明魚腥草素鈉的療效機制,為臨床治療提供依據。
1 材料
1.1 菌株和藥物標準菌株ATCC27853(中國藥品生物制品檢定所),魚腥草素鈉標準品(中國藥品生物制品檢定所批號100247-199601)。
1.2 主要試劑和儀器LB培養基、胰酶大豆肉湯培養基(TSB,杭州微生物試劑有限公司);四甲基偶氮唑鹽(MTT,Sigma公司);二甲基亞砜(DMSO,天津市光復精細化工研究所,分析純);自配pH7.4的PBS溶液。318酶標儀(上海三科儀器有限公司);96孔微量培養板(杭州生友生物技術有限公司);DPH—9162型電熱恒溫培養箱(上海一恒科技有限公司);CX21型光學顯微鏡(日本Olympus公司);Sirion200型場掃描電鏡(美國FEI公司)。
2 方法
2.1 銅綠假單胞菌生物被膜形成的觀察挑選過夜培養的菌落4個接種于LB肉湯培養基中37℃孵育6 h,培養液經離心、無菌生理鹽水洗滌后,比濁到0.5麥氏濁度標準(1.5×108cfu/mL),再經TSB液體培養基稀釋200倍加入到96孔平底微量培養板每孔200 μL,37℃孵育。根據Sauer K等[1]報道,設3 d、7 d兩個時間點,作為早期生物被膜階段、成熟期生物被膜階段的觀察,每個時間點4個復孔,并設不含菌培養基作為空白對照,每隔24 h棄培養基,用PBS清洗浮游菌,重新加入新鮮培養基。各時間點取出培養板,MTT法,即50 μL的MTT溶液(貯存液含5 mg/mL PBS,臨用前用預溫的0.15 mol/L PBS按1∶5稀釋)加入每孔中,37℃孵育5 h。棄去含MTT的培養基,PBS洗3遍,加入DMSO 100 μL,振蕩5 min,在酶標儀492 nm波長下檢測吸光度。
2.2 魚腥草素鈉對銅綠假單胞菌生物被膜的清除作用菌液制備同生物被膜形成的觀察。將菌液加入到96孔平底微量培養板1~11列各孔中,每孔100 μL,37℃孵育3 d、7 d作為早期生物被膜和成熟期生物被膜的清除作用觀察。到觀察時間點后棄去培養液,用PBS多次清洗未吸附菌。魚腥草素鈉經吐溫80和甘油溶解后,用TSB液體培養基對倍稀釋10個最終質量濃度500、250、125、62.5、31.25、15.6、7.8、3.9、1.95、0.98 mg/L,各質量濃度分別加入1~10列孔中,每孔100 μL,每個質量濃度設4個復孔,11、12列各孔中加入不含藥培養基,分別作為陰性和培養基對照。給藥1 d后,MTT法,在酶標儀492 nm波長下檢測吸光度,吸光度在陰性對照孔50%為SMEC50。
2.3 魚腥草素鈉對受試菌生物被膜的形態結構影響蓋玻片經高壓滅菌后置入無菌6孔平底培養板中每孔1片,加入2 mL TSB培養基,將200 μL的1×104cfu/mL銅綠假單胞菌的菌體混懸液加入六孔板中,37℃孵育3 d、7 d作為早期生物被膜和成熟期生物被膜的清除作用的形態觀察,同時設不加藥物的陰性對照組,在兩個時間點取出蓋玻片用15 mL PBS 3次充分清洗后重新置入6孔平底培養板中,實驗組加入2 mL含藥物質量濃度為250 mg/L TSB液體培養基,陰性對照組加不含藥培養基,37℃繼續孵育24 h后取出蓋玻片,PBS清洗后鍍銀染色,掃描電鏡下觀察形態結構變化。
2.4 數據處理采用SPSS11.0 for Windows軟件處理,用兩獨立樣本方差分析對相關數據進行統計,以均數(x±s)表示。
3 結果
3.1 銅綠假單胞菌生物被膜形成的過程見圖1。
從圖1觀察到細菌培養3 d形成早期生物被膜,在這過程中生物被膜產量最高,從早期到成熟生物被膜過程中生物被膜僅有少量增多。
3.2 魚腥草素鈉對銅綠假單胞菌生物被膜的清除作用見圖2、圖3。圖2、圖3顯示魚腥草素鈉同樣藥物質量濃度對早期生物被膜的作用強于成熟生物被膜,清除作用隨藥物質量濃度增加而加強。SMEC50早期生物被膜為15.6 mg/L、成熟期生物被膜為250 mg/L,與對照組相比差異顯著,P=0.01和P=0.000,早期生物被膜發展到成熟生物被膜過程中SMEC50都為250 mg/L。見圖4。
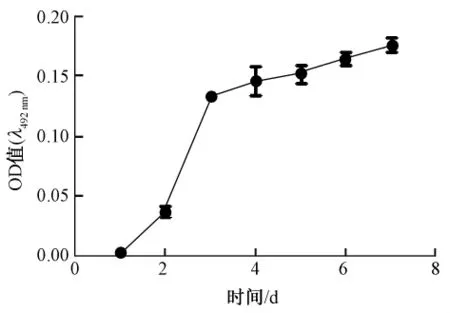
圖1 銅綠假單胞菌生物被膜形成的動態過程(n=4,±s)Fig.1 Dynam ic process of Psedomonas aeruginosa biofilm formation(n=4,±s)
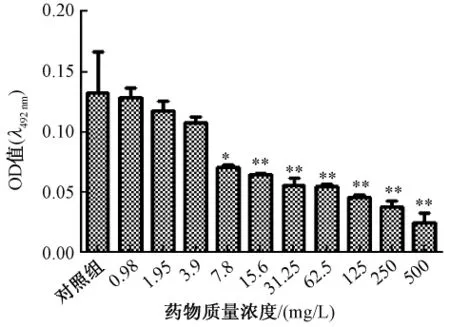
圖2 各質量濃度魚腥草素鈉對銅綠假單胞菌早期生物被膜作用的比較(n=4,±s)Fig.2 Com parison of different houttuyfonate sodium concentrations on eradicating initial Psedomonas aeruginosa biofilm s(n=4,±s)
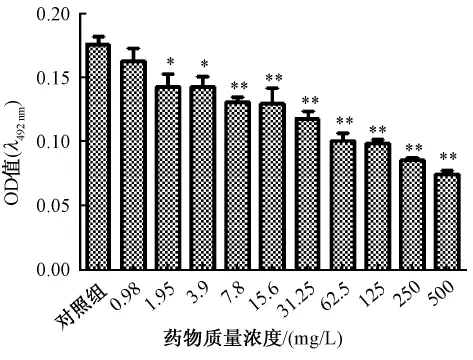
圖3 各質量濃度魚腥草素鈉對銅綠假單胞菌成熟期生物被膜作用的比較(n=4,±s)Fig.3 Com parison of different houttuyfonate sodium concentrations on eradicating mature Psedomonas aeruginosa biofilms(n=4,±s)
3.3 魚腥草素鈉對受試菌生物被膜的形態結構影響見圖5。
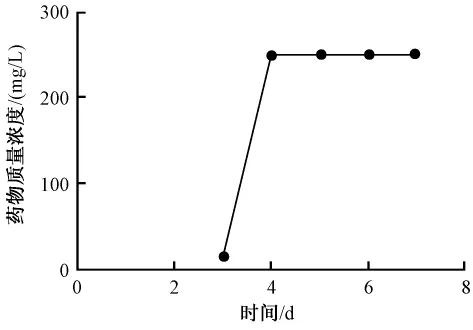
圖4 魚腥草素鈉對銅綠假單胞菌生物被膜形成各階段SMEC50Fig.4 MEC50 of houttuyfonate sodium for Psedomonas aeruginosa biofilms formed at different phases
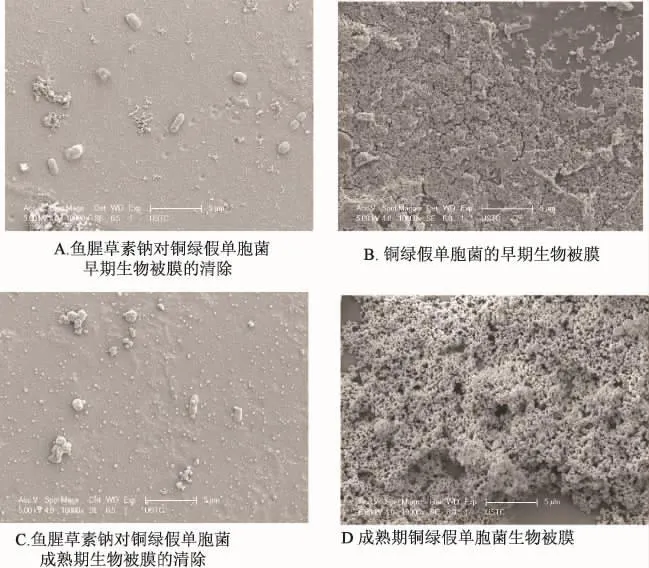
圖5 掃描電鏡下觀察魚腥草素清除銅綠假單胞菌生物被膜的作用(×10 000)Fig.5 Effects of houttuyfonate sodium d on eradicating Psedomonas aeruginosa biofilms observed by SEM(×10 000)
掃描電鏡下觀察到銅綠假單胞菌早期的生物被膜,由密集的胞外基質形成黏液層,大部分細菌已被包裹在有胞外基質形成的黏液層下,少量細菌鑲嵌在黏液層之間,成熟期的生物被膜黏液層明顯增厚如蘑菇狀形態,其內部有相互交織的孔道,細菌被胞外基質完全覆蓋。而由250 mg/L藥物質量濃度作用過的載體,早期生物被膜形成階段和成熟生物被膜階段,均未觀察到明顯的生物被膜結構,僅見載體上存在散在的黏液,分布著少量的細菌,早期生物被膜階段的細菌菌體光滑,成熟期生物被膜階段的細菌,菌體表面較粗糙,藥物作用過的載體上細菌形態發生變異,由桿狀變成球桿狀。
4 討論
魚腥草素鈉是天然植物三白草蕺菜屬植物魚腥草的主要有效成分和亞硫酸氫鈉加成物,具有消腫,抗化膿感染的功效。以往的研究只表明該藥僅具微弱的抗菌作用,據臨床報道治療呼吸道肺系疾病有很好的療效[2-5]。本研究發現,魚腥草素鈉對銅綠假單胞菌生物被膜有清除作用。銅綠假單胞菌是最典型的生物被膜菌,實驗中觀察到銅綠假單胞菌在建立早期生物被膜過程中生物被膜產量顯著增多,從早期生物被膜發育到成熟生物被膜過程中膜產量增加不顯著。從理論上分析細菌在生物被膜形成前生長代謝活躍,當被生物膜包裹后就進入休眠期,因此產膜也不活躍,實驗結果和理論分析一致。掃描電鏡下生物被膜形態觀察可印證此過程,早期生物被膜由胞外基質形成膜狀結構,成熟期的生物被膜表現為膜的增厚,該結果與Sauer K等[1]報道相符。魚腥草素鈉對銅綠假單胞菌生物被膜的清除實驗中,分別在形成早期生物被膜和成熟期生物被膜后藥物作用24 h測定生物被膜的清除作用,SMEC50早期生物被膜15 mg/L、成熟生物被膜250 mg/L,魚腥草素鈉的銅綠假單胞菌的早期生物被膜清除作用明顯強于對成熟期的生物被膜的清除作用,從圖1和圖5觀察分析與銅綠假單胞菌生物被膜的產量有關,隨著生物被膜產量的增多,SMEC50也隨之增大。這提示臨床治療相關感染應該早期用藥,早期用藥可能有預防和消除生物被膜病的療效。
自然界大部分細菌以生物被膜狀態存在,生物被膜是由細菌通過產生多糖、蛋白質、脂類、DNA組成胞外基質形成,細菌將自己包裹在膜內[6]。生物被膜很難清除[7-8],人類80%的感染由生物被膜引起[9]。生物被膜基質阻隔了免疫細胞和抗體的作用[10-11]。膜內細菌因得不到充分的營養,代謝降低導致對大多數抗生素的不敏感[12],吸附在生物被膜表面的細菌相對于其浮游狀態對抗生素的耐受性更強[12]。目前常規應用的抗生素只能殺滅浮游菌,膜內菌得到生物被膜的屏障保護而長期存活,釋放時又會引起新的感染,從而使感染反復發作。因此,以生物被膜為靶向的治療是解決生物被膜菌引起的慢性感染重要的策略。本實驗結果顯示,魚腥草素鈉的臨床療效與其抗生物被膜的作用有關,生物被膜的屏障作用被消除后可增強細菌對藥物的敏感性以及免疫因素對細菌的清除。已有報道14元環或15元環大環內酯類抗生素有一定的抗生物被膜作用[13],但是長期應用抗生素會引起新的臨床問題。魚腥草是藥食兩用的天然植物,具有長期服用對人體無毒副作用,不形成耐藥兩大優勢。本實驗顯示魚腥草素鈉的抗生物被膜作用,表明其在抗感染治療中有良好的前景。
[1]Sauer K,Camper A K,Ehrlich G D,et al.Pseudomon asaeruginosadisplaysmultiple phenotypes during development as a biofilm[J].Bicteral,2002,184(4):1140-1154.
[2]李京鶴,李志成,陳雯.魚腥草注射液治療急性上呼吸道感染196例療效觀察[J].時珍國醫國藥,2006,17(3):404.
[3]蘇慧嵐.加味華蓋散合魚腥草注射液治療慢性支氣管炎急性發作36例[J].現代中西醫結合雜志,2003,12(3):251.
[4]胡靜,何燕.新魚腥草素鈉注射液佐治毛細支氣管炎療效觀察[J].現代中西醫結合雜志,2006,15(5):578-154.
[5]李冰昱,萬啟南.魚腥草注射液治療老年人肺炎的臨床觀察[J].國際中醫中藥雜志,2006,28(3):151.
[6]Flemming H C,Wingender J.The biofilm matrix[J].Nat Rev Microbiol,2010,8(9):623-633.
[7]Walker J T,Bradshaw D J,Bennett A M,et al.Microbial biofilm formation and contamination of dental-unit water systems in general dental practice[J].Appl Environ Microbiol,2000,66(8):3363-3370.
[8]Kaplan J B.Biofilm dispersal:mechanisms,clinical implications,and potential therapeutic uses[J].Dent Res,2010,89(3):205-223.
[9]Ma Q,Zhang G,Wood T K.Escherichia coli BdcA controls biofilm dispersal inPseudomonas aeruginosaandRhizobium meliloti[J].BMC Res Notes,2011,26(4):447-457.
[10]Bjarnsholt T,Jensen P,Burm?lle M,et al.Pseudomonas aeruginosatolerance to tobramycin,hydrogen peroxide and polymorphonuclear leukocytes is quorum-sensing dependent[J].Microbiology,2005,151(Pt 2):373-383.
[11]Hentzer M,Teitzel G M,Balzer G J,et al.Alginate over production affectsPseudomonas aeruginosabiofilm structure and function[J].Bacteriol,2001,183(18):5395-5401.
[12]Mah TF,Pitts B,Pellock B,et al.A genetic basis forPseudomonas aeruginosabiofilm antibiotic resistance[J].Nature,2003,426(6964):306-310.
[13]Pérez-Martínez I,Haas D.Azithromycin inhibits expression of the GacA-dependent small RNAs RsmY and RsmZ inPseudomonas aeruginosa[J].Antimicrob Agents Chemother,2011,55(7):3399-3405.

