中試生產的結核DNA疫苗免疫效能研究
吳小麗 閉蘭 趙亞杰 羅丹 齊建新 王炯 李忠明
近年來,結核病疫情嚴重,卡介苗雖然是全球使用最廣泛的預防結核病的疫苗,可預防和減輕兒童的重癥結核病,但對成人肺結核的保護效果不穩定[1],因而,新型結核疫苗的研究對于預防和控制結核病具有重要意義。Mtb分泌蛋白Ag85復合物是Mtb的主要分泌性蛋白,也是Mtb主要保護性靶抗原的一部分,Ag85復合物在Mtb H37Rv株中占分泌蛋白總量的30%[2],是一組主要的 Mtb分泌蛋白,具有分枝菌酸轉移酶活性,在Mtb細胞壁合成的最后階段發揮重要作用。將Ag85蛋白或DNA疫苗免疫動物后可誘導特異的免疫反應[3],是新疫苗研制的熱點。為了研究本所中試生產的結核DNA疫苗的免疫效能,本實驗將編碼Ag85A蛋白的質粒免疫小鼠,對該疫苗的免疫效能進行研究,茲報告如下。
材料和方法
一、材料
小鼠IFN-γELISA 檢測試劑盒和小鼠IL-4 ELISA檢測試劑盒,為北京四正柏生物科技有限公司產品;小鼠IFN-γ酶聯免疫斑點檢測試劑盒(ELISPOT),為Mabtech公司產品。
二、方法
1.動物分組:選取4~6周齡BALB/c小鼠,通過數字表法隨機分成2組,每組10只,一組為結核DNA疫苗免疫組,一組為PBS對照組。
2.小鼠免疫:將我所300 L發酵罐中試規模生產的凍干結核DNA疫苗(結核DNA疫苗,批號090607)用滅菌生理鹽水復溶,配制成1 mg/ml溶液,以每次每只100μg/100μl的劑量采用兩點注射于小鼠后腿肌內進行免疫,共免疫3次,每次間隔3周。
3.樣本采集:(1)血清樣本采集:共采集2次血樣標本,分別為免疫前眼眶采基礎血及免疫結束后第3周摘眼球取血。(2)脾細胞制備:摘眼球取血,隨后斷頸處死小鼠,通過無菌操作取出小鼠脾臟,采用小鼠淋巴細胞分離液(達科為生物技術有限公司生產)分離淋巴細胞,通過20%FBS-RPMI1640培養基(含20%胎牛血清的RPMI 1640培養液)調整細胞濃度至1×106個/ml。
4.小鼠脾細胞IFN-γ分泌檢測:采用Mabtech公司Mouse IFN-γELISPOT進行檢測。(1)將調整好濃度(1×106個/ml)的細胞懸液加入各實驗孔,每只小鼠12個孔,100μl/孔(4個孔一組,分別加入Ag85A、陰性對照、合成肽);每塊板設置一組質控陽性對照(4個孔,各板之間應選取同一只小鼠的淋巴細胞)、背景負對照(4個孔,加入20%FBSRPMI 1640培養基)。(2)分別加入刺激物Ag85A、20%FBS-RPMI 1640(不加刺激物)、合成肽(10μl/孔),質控陽性對照中加入刀豆蛋白A(Con A)刺激物(10μl/孔),背景負對照加入20%FBS-RPMI 1640。(3)所有樣品和刺激物加完后,蓋好板蓋。放入37℃、5%CO2培養箱培養24 h。(4)具體檢測按照試劑盒說明書進行。(5)將ELISPOT板寄往達科為生物技術有限公司(深圳實驗室)進行斑點計數。
5.脾細胞CD4+、CD8+百分率檢測:采用流式細胞術對小鼠脾細胞CD4+、CD8+百分率進行檢測。實驗同時設置免疫組小鼠脾細胞和對照組小鼠脾細胞。步驟如下:(1)將小鼠(1×106)個/ml脾細胞1 ml懸于100μl含1%牛血清白蛋白(BSA)的PBS中,二組同時加入FITC標記的兔抗鼠CD4抗體和PE標記的兔抗鼠CD8抗體各10μl,室溫避光孵育30 min。(2)PBS洗細胞2次,加入2%甲醛固定液重懸細胞,使用流式細胞儀檢測。
6.血清細胞因子(IFN-γ、IL-4)檢測:(1)血清IFN-γ檢測:采用北京四正柏生物科技有限公司小鼠IFN-γ酶聯免疫檢測試劑盒進行。①從已平衡至室溫的密封袋中取出所需板條,除空白孔外,分別將血清樣本(19只小鼠,每只重復2個孔,共38個孔)和不同濃度標準品 (100μl/孔)加入相應孔中,37℃濕盒孵育90 min。②洗板5次,除空白孔外,加入生物素化抗體工作液 (100μl/孔),37℃濕盒孵育60 min。③洗板5次,除空白孔外,加入酶結合物工作液 (100μl/孔),37℃濕盒孵育30 min。④洗板5次,加入顯色劑100μl/孔,避光37℃濕盒孵育10~15 min。⑤加入終止液100μl/孔,混勻后5 min內酶標儀讀取450 nm和630 nm吸光度值(A450/630)。(2)血清IL-4檢測:采用北京四正柏生物科技有限公司小鼠IL-4酶聯免疫檢測試劑盒進行(方法和步驟同血清IFN-γ檢測)。
7.血清抗體檢測:采用間接ELISA方法對小鼠血清抗Ag85A抗體進行檢測。(1)包被:用碳酸鹽緩沖液將Ag85A稀釋至10μg/ml,加入96孔微孔板(深圳金燦華實業有限公司生產)每孔100μl,放4℃濕盒過夜。(2)封閉:棄包被液,用含5/104吐溫-20的磷酸鹽緩沖液(PBST)洗板5遍,用紗布拍干。每孔加1%BSA 200μl,置37℃濕盒2 h。封閉好的96孔微孔板烘干后置4℃冰箱內,1周內使用。(3)加樣:將每只小鼠免疫前后采集的血清按確定的稀釋倍數1∶10稀釋(稀釋液為1%BSA);100μl/孔,置于37℃濕盒,溫育60 min。(4)加酶結合物:PBST洗板5遍,用紗布拍干。用抗體稀釋液將辣根過氧化酶標記的羊抗大鼠免疫球蛋白G(HRP-GAM IgG)稀釋至1∶20 000,加入96孔微孔板,每孔100μl,置于37℃濕盒,溫育30 min。(5)顯色:PBST洗板5遍,用紗布拍干。先加入底物A液顯色(成分是:NaAc·3H2O 9.185 g,檸檬酸1.576 g,過氧化脲0.45 g,加雙蒸水溶解后稀釋至750 ml,調p H值至5.0~5.5),每孔50μl,再加入底物B液顯色,每孔50μl,置37℃反應10 min后,每孔加入2 mol/L硫酸50μl終止顯色。(6)讀數:終止反應后30 min內,酶標閱讀儀測定A450和A630值,A450減去A630,以行校對。
8.數據分析:對于脾細胞CD4+、CD8+百分率和血清細胞因子IFN-γ、IL-4水平測定結果采用t檢驗比較;脾細胞特異性IFN-γ分泌水平采用SPSS 11.0軟件進行單因素方差分析,比較兩組之間的差異,P<0.05為差異有統計學意義。
結 果
一、細胞免疫相關因子檢測
1.小鼠脾細胞IFN-γ分泌檢測:根據讀板結果,獨立樣本t檢驗顯示:t=36.538,P=0.018,結核DNA疫苗免疫組分泌IFN-γ細胞個數(103.6±112.14)高于PBS對照組(5.78±5.83),差異有統計學意義(t=36.538,P=0.018)(表1)。
2.脾細胞CD4+、CD8+百分率檢測:流式細胞儀檢測結果表明,結核DNA疫苗免疫組CD4+細胞百分率均值為21.57%,高于PBS對照組12.17%,兩者比較差異有統計學意義(t=3.043,P=0.038);結核DNA疫苗免疫組CD8+細胞百分率均值(13.70%)和 PBS對照組(10.57%)差異無統計學意義(t=0.847,P=0.445)。
3.血清細胞因子(IFN-γ、IL-4)檢測:(1)血清IFN-γ水平檢測:每只小鼠血樣設復孔,求其重復的兩孔均值(表2)。結核DNA疫苗免疫組IFN-γ水平 [(129.6±159.0)pg/ml]高 于 PBS 對 照 組[(76.5±21.5)pg/ml],但差異無統計學意義(t=-1.047,P=0.309)。(2)血清IL-4水平檢測:每只小鼠血樣設復孔,求其重復的兩孔均值(表3)。結核DNA 疫苗免疫組IL-4水平[(146.2±34.3)pg/ml]低于PBS對照組(177.7±28.1),差異有統計學意義(t=2.244,P=0.038)。(3)血清抗體檢測:將各組免疫前后血清中特異性抗Ag85A抗體通過ELISA檢測吸光度值,并用Excel軟件制圖(圖1),從圖中可以看出A 值均小于0.2,免疫前后、免疫組與對照組抗體水平從免疫學角度講均無免疫學意義。
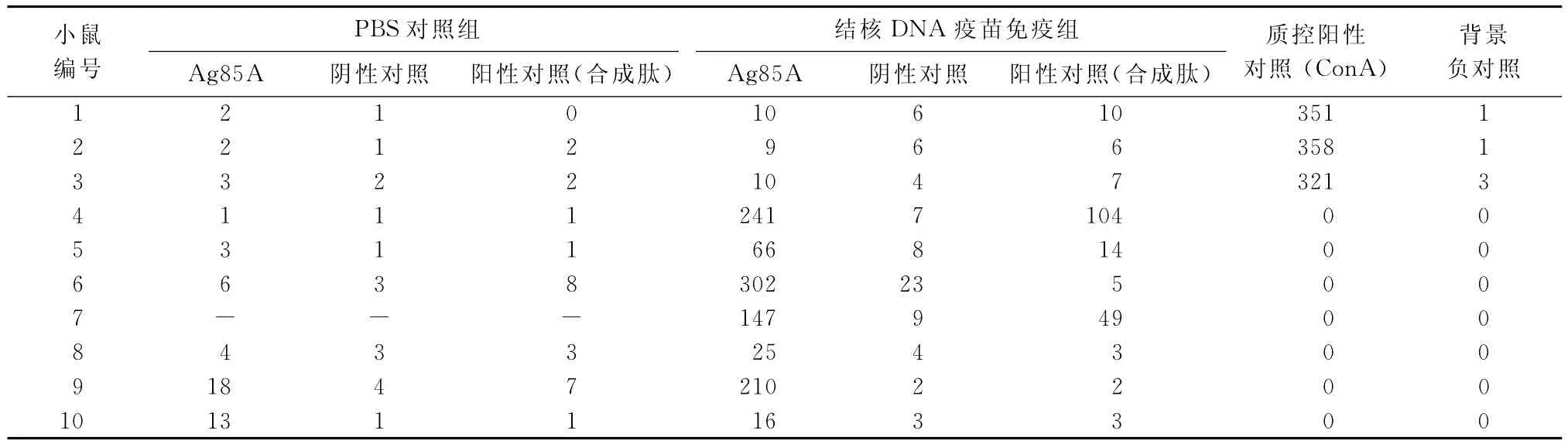
表1 不同編號小鼠在兩組中采用讀板機對ELISPOT讀取的斑點數(個)
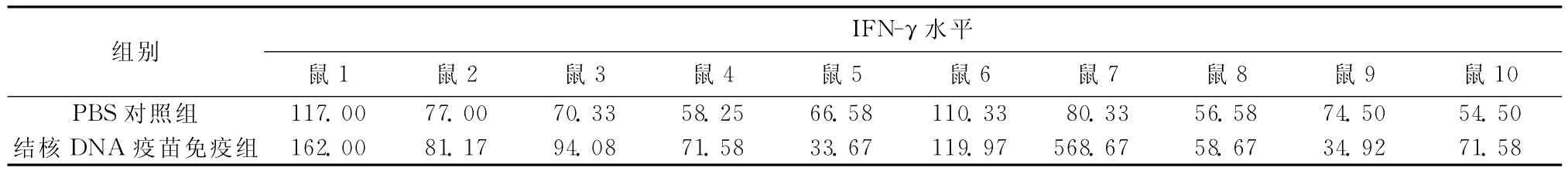
表2 PBS對照組和結核DNA疫苗免疫組IFN-γ水平的檢測結果(pg/ml)
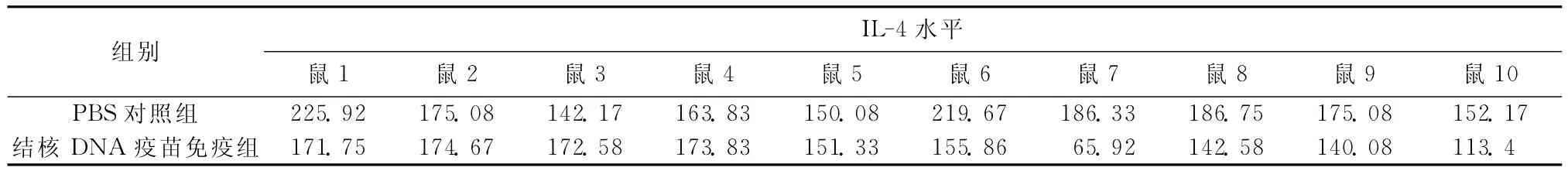
表3 PBS對照組和結核DNA疫苗免疫組IL-4水平檢測結果(pg/ml)
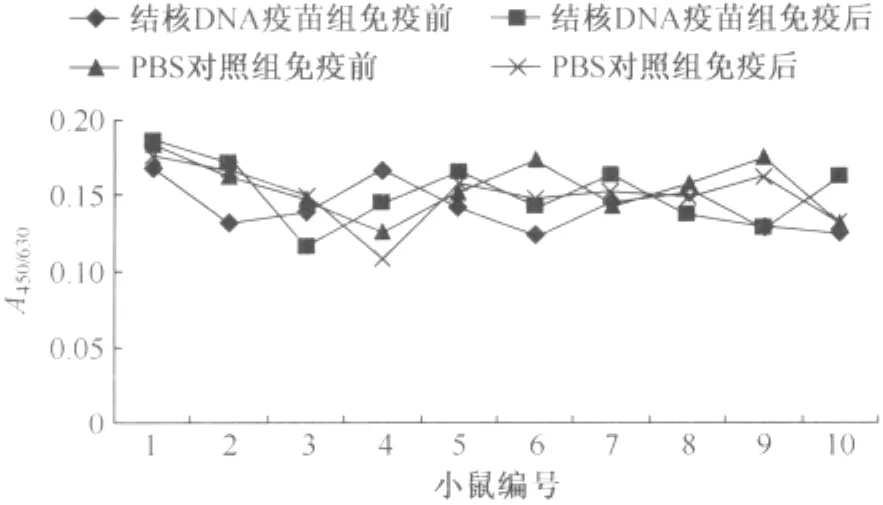
圖1 小鼠血清特異性抗體檢測結果
討 論
對于新型疫苗的評價,一般是從兩個方面進行的[4-5],一個是免疫學指標的變化,包括抗體水平的變化,免疫細胞水平的變化等;另一個是流行病學指標,即現場調查,包括新型疫苗對發病率、病死率的影響,發病后癥狀減輕的程度等。本實驗旨在對武漢生物制品研究所研制的結核核酸疫苗進行初步效果評價,所以只觀察疫苗對正常動物免疫學指標的影響。機體的抗結核病免疫反應是個非常復雜的過程,到目前為止對其確切機制仍然不甚明了[6]。因此,在疫苗評價時,缺乏公認的免疫學指標。但是,一般認為,結核病免疫機制主要是T細胞介導的細胞免疫[7],包括CD4+T細胞和CD8+T細胞的效應,筆者采用流式細胞術檢測結核核酸疫苗對外周免疫器官(脾)T細胞亞群的影響。CD4+Th1細胞介導的,以巨噬細胞為效應細胞的細胞免疫在抗結核免疫中處于中心地位[8-9],CD4+Th1通過釋放IFN-γ等細胞因子活化巨噬細胞進而清除細胞內外的Mtb;雖然CD4+Th2通過產生IL-4等細胞因子促進B細胞的增殖分化,產生針對Mtb抗原的抗體,但是這些抗體在機體的抗結核免疫中無保護作用[10]。所以,筆者以動物外周血和外周免疫器官(脾)中IFN-γ水平的變化間接監測CD4+T細胞是否向Th1分化,以外周血中IL-4水平變化間接監測CD4+T細胞是否向Th2分化,進而明確疫苗免疫后動物體免疫應答的方向。從流式細胞術檢測的結果可以看到,結核DNA疫苗免疫組CD4+細胞百分率高于陰性對照組(P<0.05),而CD8+細胞百分率差異無統計學意義(P>0.05),說明結核DNA疫苗主要引起Th1細胞的效應。誘導CD4+Th1細胞反應,可以加強巨噬細胞對Mtb的殺傷作用,但進一步驗證需要在有資質的生物安全三級實驗室進行豚鼠動物模型攻毒實驗。從ELISA檢測結果可知,在結核DNA疫苗免疫組免疫前后外周血抗Ag85A抗體水平沒有明顯變化。Ag85蛋白能夠誘導機體產生較強的T細胞增殖和刺激機體產生大量的INF-γ[12],用 Ag85免疫的小鼠能夠抵抗 Mtb的攻擊,在感染過Mtb的人的血清中也可以測到含量較高的Ag85的抗體[13],但是,本實驗從Ag85抗體的結果來看,沒有刺激產生抗體,可能是免疫程序和采血時間差異造成的;究竟多少劑量和怎樣的免疫程序能到達最好的效果,有待于在以后的試驗中進一步進行摸索。
[1]Kozak M.At least six nucleotide preceding the AUG initiator codon enhance translation in mammalian cells.J Mol Biol,1987,196(4):947-950.
[2]Suarez DL,Schultz-Cherry S.The effect of eukaryotic expression vectors and adjuvant on DNA vaccines in chickens using an avian influenza model.Avian Dis,2000,44(4):861-868.
[3]Frelin L,Ahlén G,Alheim M,et al.Codon optimization and m RNA amplification effectively enhances the immunogenicity of the hepatitis C virus nonstructural 3/4A gene.Gene Ther,2004,11(6):522-533.
[4]劉國霞,姜宇,張斌,等.動物核酸疫苗的研究進展.動物醫學進展,2005,26(9):34-36.
[5]Iwasaki A,Medzhitov R.Toll like receptor control of the adaptive immune responses.Nat Immunol,2004,5(10):987-995.
[6]McNeela EA,Jabbal-Gill I,Illum L,et a1.Intranasal immunization with genetically detoxified diphtheria toxin induces T cell responses in humans:enhancement of Th2 responses and toxin-neutralizing antibodies by formulation with chitosan.Vaccine,2004,22(8):909-914.
[7]孫樹漢.核酸疫苗及其在疾病免疫防治中的應用.第二軍醫大學學報,2000,21(6):28-30.
[8]Gallichan WS,Rosenthal KL.Long-term immunity and protection against herpes simplex virus type 2 in the murine female genital tract after mucosal but not systemic immunization.J Infect Dis,1998,177(5):1155-1161.
[9]McCluskie MJ,Brazolot Millan CL,Gramzinski RA,et a1.Route and method of delivery of DNA vaccine influence immune responses in mice and non-human primates.Mol Med,1999,5(5):287-300.
[10]Wang R,Doolan DL,Le TP,et al.Induction of antigen-specific cytotoxic T lymphocytes in humans by a malaria DNA vaccine.Science,1998,282(5388):476-480.
[11]Brosch R,Gordon SV,Marmiesse M,et a1.A new evolutionary scenario for the Mycobacterium tuberculosis complex.Proc Natl Acad Sci U S A,2002,99(6):3684-3689.

