高壓氧結合電針治療對脊髓損傷后大鼠膀胱功能的影響
王曉紅,邵 彬,黃禮群
(廣州軍區武漢總醫院康復理療科,武漢 430070)
脊髓損傷(spinal cord injury,SCI)可引起下尿路排尿功能障礙(神經源性膀胱),嚴重時可伴發致死性尿路感染或慢性腎衰竭[1]。臨床實踐已證實高壓氧是治療SCI的重要方法,但高壓氧治療神經源性膀胱的機制尚不清楚,其可能的機制是高壓氧可以保護神經細胞,促進神經纖維再生[2],從而誘發或重建正常的排尿反射;電針可以通過多環節延緩和減輕SCI的程度,改善損傷后并發癥[3],同時大量臨床實踐也證實電針在改善SCI后排尿功能方面具有獨特療效[4-5],本文旨在觀察高壓氧結合電針治療對SCI后大鼠膀胱功能的影響,從而為臨床治療SCI后神經源性膀胱提供一定的實驗依據。
1 材料與方法
1.1材料 實驗動物為健康雌性SD大鼠60只(鼠齡 4~6周),體質量250~350 g,按隨機數字表法分為3組:對照組、高壓氧組和高壓氧結合電針組(結合電針組),每組20只;各組又按手術后相應時間點分為24 h,3 d、7 d、14 d組,每組5只。實驗動物由廣州軍區武漢總醫院醫學實驗中心提供,飼養溫度為20~23 ℃,濕度為50%~60%,大鼠在籠內自由進食飲水。
1.2方法
1.2.1實驗動物模型制備 采用Allen′s 重物撞擊法制造大鼠SCI模型。稱取大鼠體質量后,給予10%水合氯醛溶液按4 mL/kg腹腔內注射麻醉,然后用電子剃毛器剃去大鼠背部毛發,以T12為中心顯露直徑約為0.5 cm的圓形無菌區,作為SCI區。將大鼠固定在鼠臺上,以T12棘突為中心背部正中縱行切口,長約3 cm,顯露脊柱后,在T11~12間用血管鉗小心咬除棘突和雙側椎板,露出白色的脊髓后,用致傷量為50 g/cm2的Allen′s重物撞擊法損傷脊髓,大鼠的雙下肢出現回縮性撲動、尾巴呈痙攣性擺動后雙下肢癱瘓,表明造模成功,然后依層次縫合。術后給予青霉素腹腔注射預防感染。所有大鼠均接受Allen′s 重物撞擊法制造SCI模型,造模成功后12 h按不同組別給予相應治療,其中對照組不接受任何治療,高壓氧組僅接受高壓氧治療,結合電針組接受高壓氧及電針治療。
1.2.2高壓氧治療 高壓氧組及結合電針組大鼠于術后12 h進艙,先用純氧洗艙10 min ,使艙內氧濃度大于95%,20 min內緩慢加壓至0.25 MPa。在高壓下停留60 min,其間用純氧通風10 min,停留結束后在20 min內勻速減壓至常壓,結束治療。高壓氧治療每天1次。
1.2.3電針治療 結合電針組大鼠于高壓氧治療后開始電針治療,電針治療參數:輸出電壓4~6 V,疏波4 Hz,密波20 Hz,留針20 min,每天1次。取穴及針刺方法[6]:大椎穴,背中線上,C7與T1棘突間,順棘突間直刺5 mm;腎俞穴,L2棘突下兩旁,直刺6 mm;三陰交穴,后肢內踝尖直上10 mm,直刺5 mm。
1.2.4尿流動力學檢查 大鼠稱體質量后,先以25%烏拉坦按1.0 g/kg腹腔注射麻醉[7],30 min后經尿道插入3號輸尿管導管,將大鼠放入測壓籠內,設置室溫為30 ℃。輸尿管導管接上三通,用注射器抽出膀胱內尿液后,三通一端與微量灌注泵相接,另一端接尿動力儀的膀胱壓力傳感器,體內置零。再以0.2 mL/min的速度向膀胱內灌注室溫下生理鹽水,至大鼠開始排尿時停止注水。測定排尿量,以1 mL注射器抽出膀胱內殘余尿。連續測量3次。膀胱測量指標為膀胱容量(灌注速度×灌注時間)、排尿量、殘余尿量(膀胱容量-排尿量)、排尿速率、最大排尿壓。
1.2.5取材 分別在造模后24 h,3、7、14 d處死大鼠。處死前大鼠完成尿流動力學檢測,檢測后開胸暴露心臟,心臟灌注冰生理鹽水至流出液為清亮后給予4%的多聚甲醛溶液繼續灌注,灌注完成后取出受損脊髓節段頭端3 mm、尾端3 mm的脊髓組織,及大鼠膀胱標本放入相同灌注液中,置入4 ℃冰箱過夜。乙醇脫水石蠟包埋并切片,其中脊髓切片為頭端5 μm,尾端5 μm各一張。
1.2.6神經型一氧化氮合酶(Neuronal nitric oxide synthase,nNOS)表達檢測 根據GENE TECH 公司兩步法抗兔/鼠通用型免疫組化試劑盒說明書進行,石蠟切片置于65 ℃烘箱中,烘片2 h,脫蠟至水,用PBS(pH 7.4)沖洗3次,每次5 min;高壓熱修復:在沸水中加入Na2EDTA(pH 9.0)。蓋上不銹鋼鍋蓋,但不能鎖定。將玻片置于金屬染色架上,緩慢加壓,使玻片在緩沖液中浸泡5 min,然后將蓋子鎖定,小閥門將會升起來。10 min后除去熱源,自然冷卻。切片放入3%過氧化氫溶液,室溫下孵育10 min,以阻斷內源性過氧化物酶。PBS(pH 7.4)沖洗3次,每次5 min;甩去PBS液,第一抗體1∶100濃度稀釋。每張切片加入50 μL稀釋液,4 ℃過夜;PBS沖洗3次,每次5 min;甩去PBS液,每張切片加50~100 μL A液(ChemMateTMEnVision+/HRP),室溫下孵育45 min;PBS沖洗3次,每次3 min;甩去PBS液,每張切片加50~100 μL新鮮配制的DAB溶液,室溫下孵育5 min,顯微鏡控制顯色;顯色完全后,蒸餾水或自來水沖洗,蘇木素復染,0.1%鹽酸分化,自來水沖洗,PBS沖洗返藍;切片經過梯度乙醇(70%~100%)脫水干燥,二甲苯透明,中性樹膠封固;用PBS代替一抗做陰性對照,高倍視野(×400)下計算陽性細胞率,即每張切片隨機取出10個不重疊高倍視野,算出陽性細胞率。
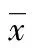
2 結 果
2.1nNOS在脊髓及膀胱組織中的表達 在各時間點上,對照組、高壓氧組及結合電針組的脊髓及膀胱組織中均有表達(封2圖1),陽性細胞即為細胞質內棕黃色染色顆粒;免疫組化結果顯示,在各時間點上,高壓氧組及結合電針組nNOS陽性細胞表達均高于對照組(P<0.01),結合電針組的陽性細胞數顯著高于高壓氧組(P<0.05),見表1。
2.2尿流動力學分析 尿流動力學結果顯示,對照組、高壓氧組及結合電針組尿流動力學指標在術后24 h比較,差異無統計學意義(P>0.05);術后3 d及以上,高壓氧組及結合電針組各項尿流動力學指標均優于對照組,差異有統計學意義(P<0.05);術后7、14 d,結合電針組的尿流動力學指標明顯優于高壓氧組,差異有統計學意義(P<0.05),見表2。

表1 nNOS在脊髓及膀胱組織中陽性細胞率的表達±s,%)

表2 各組尿流動力學的影響±s)

續表2 各組尿流動力學的影響±s)
3 討 論
由于控制膀胱的中樞或周圍神經傷病所引起的排尿功能障礙,稱為神經源性膀胱,它是SCI的常見合并癥之一[8]。神經源性膀胱引起嚴重尿潴留、尿路感染、膀胱內高壓、膀胱-輸尿管反流,甚至發生慢性腎衰竭,是截癱患者的首位死亡原因。1987~1988年,中國康復研究中心對唐山地震后因SCI造成截癱死亡的374例患者進行調查,發現腎衰竭占死因的40%以上。
國內外研究表明,氮能神經遞質合成減少在神經源性膀胱發病過程中起重要作用。由于一氧化氮(nitric oxide,NO)的化學性質極不穩定,目前主要是通過檢測一氧化氮合酶(nitric oxide synthase,NOS)及其降解產物的含量間接了解NO的變化。NOS陽性神經纖維廣泛分布于膀胱及尿道組織,NO通過NO-cGMP信號途徑舒張下尿路平滑肌,降低正常排尿時的尿道壓,對維持正常的膀胱儲、排尿功能有重要意義[9-11]。敲除nNOS基因的小鼠膀胱-尿道括約肌功能紊亂,有排尿困難、尿頻等癥狀[12]。神經源性膀胱逼尿肌、膀胱頸平滑肌中氮能神經遞質含量明顯下降,從而使逼尿肌興奮性升高,膀胱收縮與舒張功能失調,導致排尿障礙[13]。國內研究報道電針治療使SCI后大鼠膀胱逼尿肌及膀胱頸平滑肌中nNOS 表達增加,從而改善大鼠排尿功能[14-15];高壓氧治療可以促進損傷后脊髓的神經細胞再生[16-17],在本文的前期研究中,發現高壓氧能夠顯著減少SCI大鼠神經元細胞凋亡的同時,還能改善SCI大鼠的肢體功能及行為學評分[18]。
本實驗結果表明,在術后各時間點上,高壓氧組及結合電針組nNOS陽性細胞表達均高于對照組(P<0.01),結合電針組的陽性細胞數顯著高于高壓氧組(P<0.05);術后7、14 d,結合電針組的尿流動力學指標明顯優于高壓氧組,差異有統計學意義(P<0.05),說明高壓氧及電針治療都能改善SCI后大鼠尿流動力學指標,且都與脊髓及膀胱組織中氮能神經遞質的合成與釋放增加有關。所以本研究認為高壓氧與電針相結合治療SCI后神經源性膀胱,能夠更好地改善SCI后大鼠的膀胱功能。其機制可能是:(1)高壓氧能明顯增加損傷脊髓組織氧張力,調節微循環功能,減輕脊髓水腫,保護神經細胞,促進神經纖維再生,同時高壓氧也能提高脊髓對缺氧的耐受性[19],使脊髓神經元細胞缺血缺氧狀態得到改善,繼而使更多殘存的神經細胞免于繼發性損傷,更多地保留支配膀胱的神經功能。(2)中醫認為SCI的病因病機是由于督脈受損,電針督脈(大椎穴)可以改善SCI局部組織的血液微循環,又能促進腦脊液流動,減輕SCI 部位的水腫和血腫的壓迫及粘連,從而扼制了脊髓繼發性損傷的進行[20];三陰交是足三陰經交會穴,三陰經循行少腹或陰器,能通調下焦之氣機,推測電針刺激通過反射弧到脊髓后根激發腰骶部排尿中樞,引起反射性排尿;腎俞穴內有第1、2腰髓側角發出的交感神經纖維,可使尿道內括約肌收縮,而使膀胱容量增大,減少排尿次數。同時電針治療具有清除自由基和抑制氧化應激反應的作用,從而提高氧化能力,改善急性SCI,這也可能是電針改善SCI作用途徑之一[21]。(3)本實驗數據表明,高壓氧結合電針治療使nNOS表達顯著增加,使氮能神經遞質合成增加,并使膀胱和尿道組織中抑制性神經遞質水平升高,尿道及膀胱頸痙攣減輕,平滑肌舒張,尿道阻力降低,逼尿肌舒張,無抑制收縮頻率減少,膀胱順應性提高,由此改善大鼠尿流動力學指標,排尿障礙癥狀改善。總之,高壓氧結合電針治療對SCI后大鼠的神經元具有保護作用,并能很好改善大鼠的膀胱功能。
[1]候春林.脊髓損傷后膀胱功能重建[J].解放軍醫學雜志,2008,28(8):663-665.
[2]Ishibara H,Kanamori M,Kawaguchi Y,et al.Prediction of neurologic outcome in patients with spinal cord injury by using hyperbaric oxygen therapy[J].J Orthop Sci,2001,6(5):385-389.
[3]劉瑩瑩,陳向華.電針治療脊髓損傷機制研究進展[J].安徽中醫學院學報,2011,30(3):76.
[4]周凌云,李杰,李春梅,等.電針八髎、會陽治療脊髓損傷性尿潴留療效觀察[J].中國針灸,2006,26(4):237-239.
[5]吳東,曾立志,朱崇田,等.針灸配合膀胱功能訓練治療脊髓損傷后尿潴留35例[J].上海針灸雜志,2006,25(10):33.
[6]林文注,王珮.實驗針灸學[M].上海:上海科學技術出版社,1994:288-290.
[7]孫雙權 ,陳忠,葉章群,等.兩種大鼠膀胱測壓方法的比較[J].中國比較醫學雜志,2008,18(7):50-53.
[8]Xiao CG.Reinnervation for neurogenic bladder:historic review and introduction of a somatic-autonomic reflex pathway procedure for patients with spinal cord injury or spinal bifida[J].Eur Urol,2006,49(1):22-28.
[9]Gillespie JI,Markerink-Van Ittersum M,de Vente J.Endogenous nitric oxide/cGMP signalling in the guinea pig bladder:evidence for distinct populations of sub-urothelial interstitial cells[J].Cell Tissue Res,2006,325(2):325-332.
[10]Hedlund P.Nitric oxide/cGMP-mediated effects in the outflow region of the lower urinary tract--is there a basis for pharmacological targeting of cGMP?[J].World J Urol,2005,23(6):362-367.
[11]Poladia DP,Bauer JA.Nitric oxide in the urinary bladder:involvement of auto-relaxation[J].Nitric Oxide,2004,10(1):51-52.
[12]Burnett AL,Calvin DC,Chamness SL,et al.Urinary bladder-urethral sphincter dysfunction in mice with targeted disruption of neuronal nitric oxide synthase models idiopathic voiding disorders in humans[J].Nat Med,1997,3(5):571-574.
[13]Diniz P,Soejima K,Ito G.Nitric oxide mediates the effects of pulsed electromagnetic field stimulation on the osteoblast proliferation and differentiation[J].Nitric Oxide,2002,7(1):18-23.
[14]陳躍來,岑玨,候文光,等.電針對大鼠不穩定膀胱逼尿肌及膀胱頸氮能神經遞質的影響[J].中西醫結合學報,2006,4(1):73-75.
[15]黃昭明,李靜,鄭少斌.脊髓損傷后膀胱氮能神經變化的動物實驗研究[J].解放軍醫學雜志,2001,26(10):743-744.
[16]王鋼,劉世清.高壓氧對鼠損傷脊髓內神經生長相關蛋白表達的影響[J].中華物理醫學與康復雜志,2004,26(12):712-714.
[17]王鋼,劉世清,王石順.高壓氧對損傷脊髓GAP-43 mRNA表達影響的實驗研究[J].中華航海醫學與高氣壓醫學雜志,2004,11(4):217-219.
[18]王曉紅,邵彬,王琴,等.高壓氧治療對脊髓損傷后大鼠神經細胞凋亡及行為學評分的影響[J].重慶醫學,2010,39(8):935-936.
[19]Dong H,Xiong L,Zhu Z,et al.Preconditioning with hyperbaric oxygen and hyperoxi induces tolerance against spinal cord ischemia in rabbits[J].Anesthesiology,2002,96(40):907-912.
[20]徐斌.脊髓針為主綜合治療法治療外傷性截癱286例療效觀察[J].中國針灸,1990,10(2):7-9.
[21]宋琳,李曉寧,王瑩威,等.電針對急性脊髓損傷大鼠氧化應激反應的影響[J].針灸臨床雜志,2011,27(1):55-57.

