熔融NaOH分解橄欖石型硅酸鹽的反應機理
徐 敏,許 茜,劉日強,王子睿,翟玉春
(1. 東北大學 材料與冶金學院,沈陽 110004;
2. 黑龍江公安警官職業學院 刑事科學技術系,哈爾濱 150025)
金屬鎳由于具有良好的機械強度和延展性[1]、高熔點、高化學穩定性、空氣中抗氧化等特征成為現代航空工業、國防工業和人們生活中不可缺少的重要金屬之一。隨著鎳需求量的增加以及世界鎳硫化礦資源日益短缺,如何高效率、低成本、無污染地利用鎳的氧化礦資源 —— 紅土鎳礦的重要性日益凸顯。紅土鎳礦資源儲量約占全球鎳資源的72%,鎳紅土礦主要有兩種類型,一種是褐鐵礦型的紅土礦,另一種是硅酸鹽型的紅土礦。硅酸鹽型的鎳紅土礦的主要構成是鎂、鐵的硅酸鹽,鎳則以類質同相取代鐵或鎂存在于硅酸鹽中,鎳的品位在1%~2%之間[2?5]。
為了從硅酸鹽礦物中有效地分離鎳元素,需要破壞其穩定的硅酸鹽結構,使鎳元素可以從硅氧四面體組成的陣列束縛中釋放出來。利用熔融堿或高濃度堿液可以提供成鍵的OH?分解硅酸鹽結構,因此,堿處理成為分解硅酸鹽型礦物的有效方法之一。目前,盡管人們在堿處理硅酸鹽型礦物方面已經開展了許多研究工作,但是研究主要集中在唯像學的范疇,例如對堿處理工藝條件的優化,以及利用宏觀動力學研究堿處理過程的動力學方程、確定反應的控制步驟和反應的表觀活化能[6?8]。研究堿處理兩性金屬氧化物礦資源仍是一個尚需深入的領域,特別是基于堿處理過程中礦相結構的轉變、化學鍵的變化以及無機聚合物網絡結構的重構等角度研究硅酸鹽堿轉化過程和反應機理,將會幫助人們更深刻地理解堿處理硅酸鹽型礦物的反應機理,從而實現對堿分解過程的有效控制,以利于后續的浸出過程。這對于高效利用硅酸鹽型紅土鎳礦具有重要意義。
本文作者以溶液沉淀和固相反應相結合的方法合成Mg2SiO4和MgNiSiO4,利用X射線衍射儀、紅外光譜儀等對堿熔融后的水浸渣進行測試,同時對熔融堿處理Mg2SiO4過程進行拉曼光譜分析,研究Mg2SiO4和MgNiSiO4在熔融NaOH中的反應機理和轉化行為,為堿熔融法高效處理低品位鎳紅土礦提供理論依據。
1 實驗
實驗所用 NaOH、Na2SiO3、MgCl2、MgSO4、MgO和NiO均為分析純。水為去離子水。采用水溶液沉淀法合成MgSiO3;利用合成的MgSiO3與MgO和NiO分別在1 200 ℃,10 h和1 100 ℃,5 h固相反應制備Mg2SiO4和 MgNiSiO4。
熔融NaOH分解Mg2SiO4和 MgNiSiO4反應在鎳坩堝中進行,熔融堿處理采用兩種實驗方法,其一是將一定量的固體氫氧化鈉加入鎳坩堝中,加熱至設定溫度,待氫氧化鈉完全溶化后,投入確定反應劑量的Mg2SiO4或 MgNiSiO4,并開始對反應計時(稱為投料式);其二是將Mg2SiO4與給定反應劑量的NaOH提前混合后,一起加熱至設定溫度后開始計時(稱為預先混料式)。反應經過一段時間后,將反應體系降至室溫并加水浸出,通過離心分離得到含可溶性硅酸鹽的浸出液和堿熔水浸渣。
水浸渣分別采用日本理學 Rigaku X射線儀和Nicolet 380 FT-IR型智能傅立葉紅外光譜儀分析;堿熔融過程利用 Lab RAM HR?800型拉曼光譜儀進行在線分析。
2 結果與討論
2.1 Mg2SiO4和MgNiSiO4合成與表征
圖1所示為本研究合成Mg2SiO4和MgNiSiO4產物的XRD譜,橄欖石相硅酸鎂Mg2SiO4(JCPDS file 71—1972) 和硅酸鎂鎳MgNiSiO4(JCPDS file 203017)的標準XRD譜也示于圖1中。
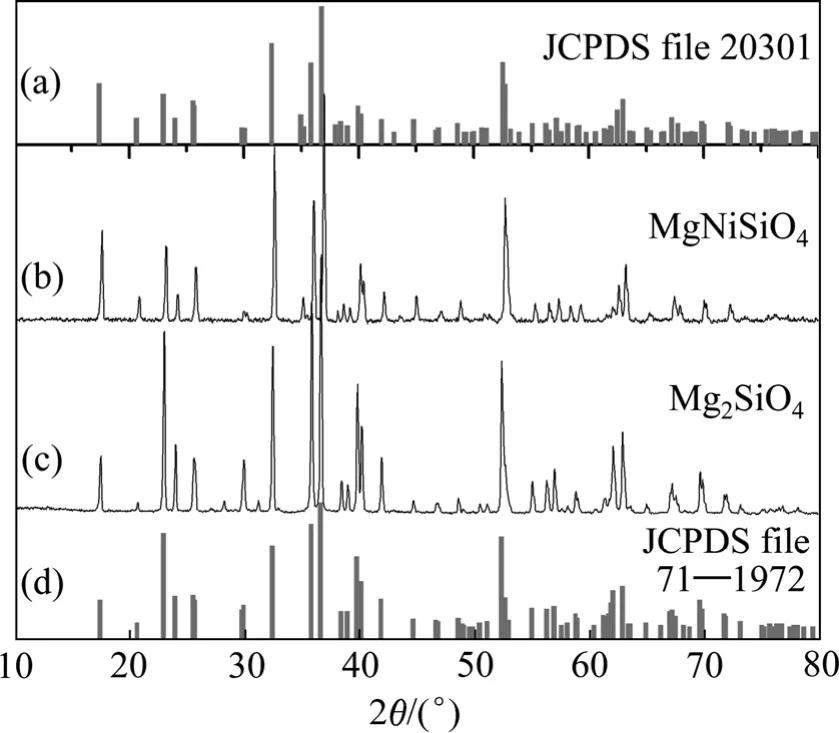
圖1 合成鎂鎳橄欖石和鎂橄欖石的XRD譜Fig. 1 XRD patterns of olivines prepared: (a) MgNiSiO4 standard JCP data; (b) Mg2SiO4 prepared; (c) MgNiSiO4 prepared; (d) Forsterite standard JCP data
由圖1可知:橄欖石相的正硅酸鎂和正硅酸鎂鎳XRD的標準譜非常相似,但是,橄欖石相的正硅酸鎂鎳 XRD衍射峰整體向高角度方向略有移動。合成的正硅酸鎂鎳和正硅酸鎂與其橄欖石相的 XRD吻合很好;兩者相比,合成的正硅酸鎂鎳 XRD衍射峰較正硅酸鎂的衍射峰也整體向高角度方向移動。合成的MgNiSiO4可以看成是Mg2SiO4異質同相體。由于Ni2+和 Mg2+半徑相近,Ni2+可以部分取代 Mg2+,占據了Mg2SiO4晶體中 Mg的晶格點陣位置,導致樣品的晶胞參數和晶胞V值改變(見表1)、以及XRD衍射峰向高角度移動。在鎂?鎳橄欖石中,Mg2+和 Ni2+的分布部分有序。
圖 2所示為合成的正硅酸鎂和正硅酸鎂鎳掃描SEM像,并對SEM像中標出點的成分進行EDS能譜分析。對于圖2中標出點①處,Mg、Si、O的摩爾比近似為 1.9:1.0:3.8;標出點②處,Mg、Ni、Si、O 的摩爾比為1.0:0.9:1.0:4.3。結合XRD物相分析結果可以確定本研究依次合成了橄欖石型正硅酸鎂和正硅酸鎂鎳。

表1 Mg2SiO4和MgNiSiO4的晶胞參數比較Table 1 Unit-cell parameters of Mg2SiO4 and MgNiSiO4 prepared in this study

圖2 合成的正硅酸鎂和正硅酸鎂鎳的SEM像Fig. 2 SEM images of magnesium silicate(a) and magnesium-nickel silicate(b)
2.2 堿熔后水浸渣的XRD物相分析
圖3(a)所示為在400 ℃、15 min條件下Mg2SiO4堿熔融水浸渣的XRD譜。從XRD譜可以得到,對于不同堿礦比的體系經過15 min堿熔融反應,Mg2SiO4與熔融 NaOH的反應產物中都可以發現 Na2MgSiO4中間產物生成。反應可以表示為
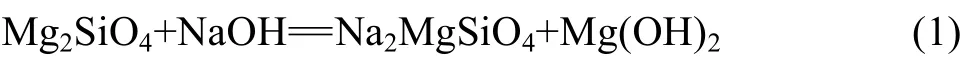
雖然在XRD譜中未見Mg(OH)2, 僅出現MgO衍射峰,這是由于水浸渣在煅燒后 Mg(OH)2分解成MgO;但是,對未經煅燒的水浸渣紅外光譜分析(見圖4) 明顯可見Mg—OH鍵振動峰和Mg(OH)2晶格的特征譜。對堿熔后水浸渣的 XRD分析還可以看到增加堿量有助于Mg2SiO4轉化成Mg(OH)2。
當采用預先混料方式進行400 ℃、15 min堿熔融反應后, Mg2SiO4-NaOH體系的反應產物經過水浸后煅燒,其 XRD譜見圖 3(b)。結果顯示水浸渣中僅含Mg(OH)2的分解產物MgO,因此,可以斷定幾乎所有都與Na+結合,生成可溶性的硅酸鈉進入水溶液相。這是由于采用預先混料的實驗方式,Mg2SiO4與NaOH反應時間遠超過15 min,表明通過延長堿熔融的反應時間可以實現 Mg2SiO4完全轉化成可溶性硅酸鈉。
圖4所示為MgNiSiO4在400 ℃反應條件下(堿與原料摩爾比為10:1)堿熔融15 min后渣的XRD譜。由圖4可以看出,MgNiSiO4堿熔融反應后渣相的主要成分為 Na2MgSiO4、NiO 和少量 MgNiSiO4。由于Na2MgSiO4與Na2NiSiO4是異質同相,所以,MgNiSiO4的堿熔融產物中也可能含有Na2NiSiO4。但是,其XRD譜中顯示的氧化物的衍射峰明顯偏向于 NiO的衍射峰,說明MgNiSiO4堿熔融反應過程中,Ni+應優先于Mg2+與NaOH中Na+交換,生成 Ni(OH)2,經煅燒后得到NiO。
2.3 堿熔融反應后的水浸渣紅外光譜分析
圖5所示為不同堿量時于400 ℃、15 min堿熔融后水浸渣的紅外光譜,以及室溫下 Mg2SiO4和Mg(OH)2的紅外光譜。其中,NaOH與Mg2SiO4質量比為30:1水浸渣經過600 ℃煅燒,其余水浸渣經室溫干燥。水浸渣的紅外光譜在3 424 cm?1附近的較寬吸收峰是浸出渣中所含吸附水的 O—H伸縮振動[9];在3 700 cm?1處的吸收峰應為Mg—OH的伸縮振動,因為對于經過600 ℃煅燒后的浸出渣未見該吸收峰,可能的原因是Mg(OH)2經過煅燒后大部分分解成MgO。這一結果與WU等[10]認為在3 700 cm?1和3 424 cm?1附近吸收峰皆為O—H伸縮振動略有差別。1 651 cm?1附近和1 443 cm?1的吸收峰應屬于Mg—OH的彎曲振動[11];在1 000~800 cm?1波數范圍內出現的吸收峰為SiO4的伸縮振動峰[12],對于 Mg2SiO4在 994、898和839 cm?1處依次出現明顯較為銳利的吸收峰,但對于浸出渣相應位置的吸收峰變得平緩,峰值也變小。結合 XRD分析結果,可以得出在浸出渣中 SiO4四面

圖3 在15 min、400 ℃條件下Mg2SiO4堿熔融水浸渣的XRD譜Fig. 3 XRD patterns of water-washing residue of Mg2SiO4 after alkali fusion at 400 ℃ for 15 min with different ratios of NaOH to Mg2SiO4: (a) Samples for dropping down to molten NaOH; (b) Samples for mixing with solid NaOH; 1—10:1; 2—15:1; 3—20:1;4—25:1; 5—30:1

圖4 在15 min、400 ℃條件下MgNiSiO4堿熔融后水浸渣的XRD譜Fig. 4 XRD patterns of residue obtained from MgNiSiO4 after alkali fusion of NaOH at 400 ℃ for 15 min (data within brackets show values of 2θ corresponding to peaks in XRD patterns)

圖5 在400 ℃、15 min條件下Mg2SiO4-NaOH體系堿熔融后水浸渣的紅外光譜Fig. 5 FT-IR spectra of residue of Mg2SiO4 after alkali fusion with NaOH with different mole ratios of NaOH to Mg2SiO4 at 400 ℃ for 15 min: (a) Mg2SiO4; (b) 10:1; (c) 15:1; (d) 20:1; (e)25:1; (f) 30:1; (g) Mg(OH)2
體存在于MgNa2SiO4中、且浸出渣中硅酸鹽含量較低是吸收峰變平緩和峰值減少的主要原因。在500 cm?1附近,Mg2SiO4紅外光譜表現的是SiO4的彎曲振動,而浸出渣的紅外光譜則呈現出Mg(OH)2晶格平行振動的特征。通過對浸出渣的紅外光譜分析可以得出,Mg2SiO4與熔融堿反應后得到的浸出渣表現出明顯的Mg—OH鍵和Mg(OH)2晶格的特征;并且 SiO4的伸縮振動峰隨著堿量的增加峰強逐漸減弱。可以推斷Mg2SiO4經過堿熔融處理后,其中的 Mg離子可以與NaOH中的Na離子交換,脫離其原有的硅酸鹽陣列;且增加堿量有助于鎂離子由 Mg2SiO4轉化成Mg(OH)2。
圖 6所示為 400 ℃、15 min 不同堿量分解MgNiSiO4的產物經過水浸后的水浸渣煅燒后的紅外光譜。與Mg2SiO4堿熔融后得到水浸渣的結果類似,其紅外光譜在3 424 cm?1附近的較寬吸收峰,對應其中吸附水中的 O—H伸縮振動;但由于 MgNiSiO4堿熔融后的水浸渣全部經500 ℃煅燒,所以在3 700 cm?1未出現與 M—OH伸縮振動對應的銳利吸收峰。在1 641 cm?1附近吸收峰應是鎂鎳橄欖石中的Mg—O的振動峰,而MgNiSiO4水浸渣的紅外光譜在1 641 cm?1附近只有很弱的吸收峰;但在1 443 cm?1附近也出現明顯的 Mg—OH振動峰。MgNiSiO4在 997和884 cm?1可見SiO4的伸縮振動峰,與Mg2SiO4結果非常相近;水浸渣的紅外光譜在該頻率范圍內出現平緩和較寬的吸收峰,可能是由于體系中同時存在的Na+,Ni2+和 Mg2+作用下使 SiO4彎曲振動峰呈現合并現象。在 500 cm?1附近,MgNiSiO4紅外光譜表現的是SiO4的彎曲振動,而浸出渣的紅外光譜在440 cm?1呈現Ni—OH彎曲振動[13],與煅燒后浸出渣的XRD中呈現的主要氧化物為NiO結果相對應。表明MgNiSiO4在 400 ℃,不同堿量熔融反應 15 min的過程中與NaOH優先交換的陽離子為Ni2+。
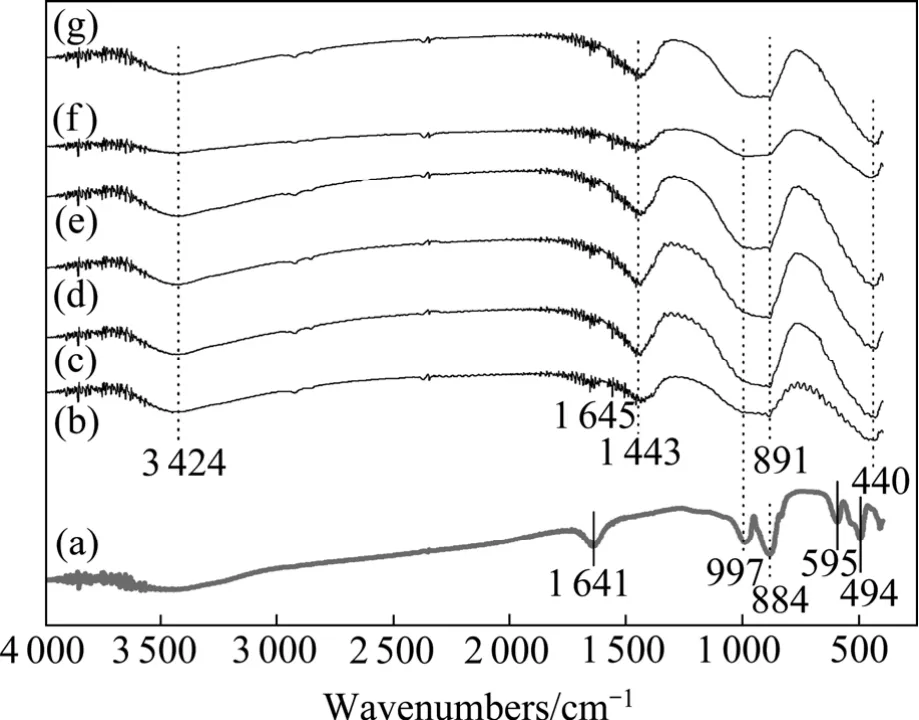
圖6 MgNiSiO4-NaOH體系在400℃、15 min下堿熔融后水浸渣的紅外光譜Fig. 6 FT-IR spectra of residue of MgNiSiO4 after alkali fusion with NaOH with different mole ratios of NaOH to MgNiSiO4 at 400 ℃ for 15 min: (a) MgNiSiO4; (b) 10:1; (c)15:1; (d) 20:1; (e) 25:1; (f) 30:1; (g) 40:1
2.4 堿熔融反應原位拉曼光譜分析
圖7所示為NaOH和Mg2SiO4按照摩爾比4:1預先混料升至不同溫度時體系的拉曼光譜圖。其中:25 ℃的拉曼光譜對應NaOH和Mg2SiO4混合體系在室溫時的拉曼光譜以及室溫時Mg(OH)2拉曼光譜,可以在1 074、3 564以及3 630 cm?1處看到NaOH特征振動峰;而 795、824、859 cm?1處的振動峰歸屬于Mg2SiO4中的SiO4島狀特征振動峰[14?15]。當混合體系溫度逐漸升高的過程中,NaOH在1 074 cm?1處的振動峰發生劈裂、以及劈裂峰合并、并且向低波數移動;由于隨著NaOH與Mg2SiO4反應的進行,體系中NaOH逐漸消耗,使整個體系的拉曼光譜在1 074 cm?1附近的 NaOH特征峰值也逐漸減少。熔融的 NaOH對Mg2SiO4中SiO4島狀伸縮振動峰有明顯的遮蔽效應,在795和824 cm?1振動峰強度減弱甚至消失;堿熔產物的 SiO4島狀伸縮振動峰逐漸向低波數移動至 803 cm?1附近,這與島狀SiO4鍵合的陽離子由鈉離子過渡為鎂離子相關,且鎂的相對分子質量大于鈉的相對分子質量。隨著體系溫度的升高和熔融堿的作用,島狀SiO4與陽離子的鍵合方式如圖8所示(結合前面XRD結果)。
SiO4島狀伸縮振動峰經歷Mg和Na離子共同作用下的振動峰寬化,且向低波數移動,最終產物Na4SiO4中SiO4島狀伸縮振動峰在803 cm?1[16]。同時發現,NaOH在 1 074 cm?1處 OH振動峰強度隨著Na4SiO4中島狀SiO4于803 cm?1處伸縮振動峰的增強

圖7 NaOH和Mg2SiO4摩爾比為4:1時升至不同溫度時的拉曼光譜Fig. 7 Raman spectra of mixture of NaOH and Mg2SiO4 at different temperatures with mole ratio of NaOH to Mg2SiO4 of 4:1
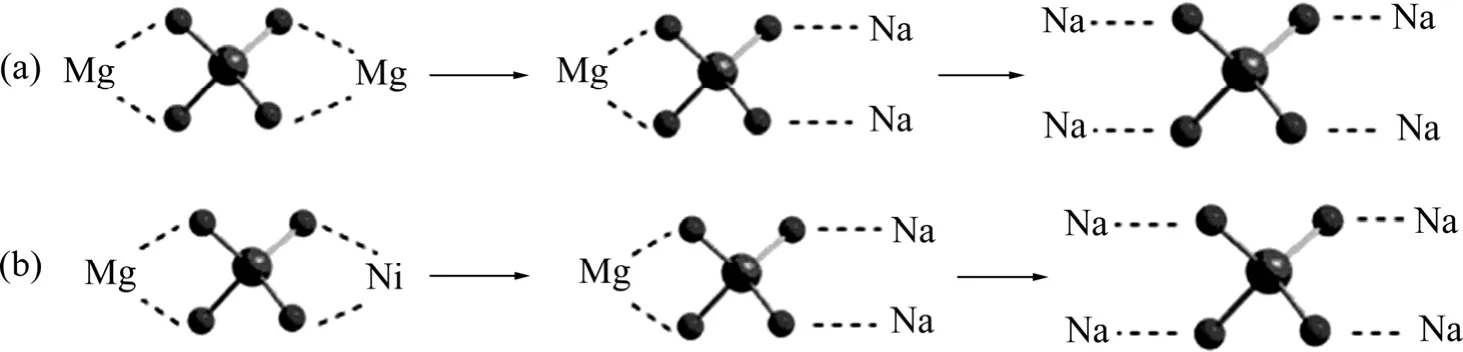
圖8 硅酸鎂堿熔融活化過程示意圖Fig. 8 Schematic illustration of alkali process of forsterite(a) and magnesium-nickel silicate(b)
而減弱,這說明堿熔融過程NaOH逐漸消耗;雖然產物 Mg(OH)2量會增加,但是 Mg(OH)2在 1 074 cm?1附近無拉曼活性特征峰。在體系溫度升至400 ℃之后,高頻區3 600 cm?1附近拉曼峰應主要對應Mg(OH)2中OH—的振動[17];但由于在反應過程中同時存在NaOH和Mg(OH)2,所以在高頻區OH的拉曼特征峰出現明顯寬化;Mg(OH)2在 500 ℃以上將分解反應,生成MgO,所以在 3 500 cm?1附近 OH—的振動峰在500 ℃以及更高的溫度范圍呈減弱趨勢。
3 結論
1) 利用水溶液沉淀結合固相反應法依次合成Mg2SiO4和 MgNiSiO4。XRD的分析結果表明:合成Mg2SiO4和MgNiSiO4具有類似的晶體結構,鎳離子以異質同相的方式存在于Mg2SiO4橄欖石相中。
2) 對Mg2SiO4堿熔融后的水浸渣XRD和紅外光譜FT-IR分析表明,NaOH對Mg2SiO4中Mg2+的替換逐次進行,其中間產物為Na2MgSiO4。對堿熔融過程的拉曼光譜在線分析顯示,堿熔融過程中與島狀SiO4結合的陽離子 Mg2+逐次由 Na+替換,對應島狀 SiO4伸縮振動模式拉曼峰向低波數移動;Mg離子經過堿熔融過程可以脫離SiO4陣列,以Mg(OH)2或MgO的形式從其硅酸鹽中得以釋放。
3) 對 MgNiSiO4堿熔融后的水浸渣XRD和紅外光譜 FT-IR分析結果表明,堿熔融過程中 Na+對MgNiSiO4中陽離子的替換是有擇優取向的,將首先替換其中的Ni2+,生成中間產物Na2MgSiO4。
[1] 劉 巖, 翟玉春, 王 虹. 鎳生產工藝研究進展[J]. 材料導報,2006, 20(3): 79?81, 96.
LIU Yan, ZHAI Yu-chun, WANG Hong. Research on production process of nickel[J]. Materials Review, 2006, 20(3): 79?81, 96.
[2] 彭容秋, 任鴻九, 張訓鵬. 鎳冶金[M]. 長沙: 中南大學出版社, 2005: 1?5.
PENG Rong-qiu, REN Hong-jiu, ZHANG Xun-peng. Nickel metallurgy[M]. Changsha: Central South University Press, 2005:1?5.
[3] 曹異生. 國內外鎳工業現狀及前景展望[J]. 世界有色金屬,2005(10): 67?71.
CAO Yi-sheng. Status quo and prospects of nickel industry at home and abroad[J]. World Nonferrous Metals, 2005(10):67?71.
[4] 何煥華. 世界鎳工業現狀及發展趨勢[J]. 有色冶煉, 2001,12(6): l?3.
HE Huan-hua. Present situation and development trend of world nickel industry[J]. China Nonferrous Metallurgy, 2001, 12(6):1?3.
[5] 劉 瑤, 叢自范, 王德全. 對低品位鎳紅土礦常壓浸出的初步探討[J]. 有色礦冶, 2007, 23(5): 28?30.
LIU Yao, CONG Zi-fan, WANG De-quan. Primary probe into normal atmospheric leaching of low-nickel laterites[J].Non-ferrous Mining and Metallurgy, 2007, 23(5): 28?30.
[6] 曹來宗, 劉代俊, 高麗花, 劉長虹, 沈 茜. 亞熔鹽法浸取釩的實驗研究[J]. 鋼鐵釩鈦, 2008, 29(2): 1?4.
CAO Lai-zong, LIU Dai-jun, GAO Li-hua, LIU Chang-hong,SHEN Qian. Experimental study on leaching vanadium by sub-molten salt method[J]. Iron Steel Vanadium Titanium, 2008,29(2): 1?4.
[7] ABDELKADER M, DAHER A, EL-KASHEF E. Novel decomposition method for zircon[J]. Journal of Alloys and Compounds, 2008, 460(1/2): 577?580.
[8] HIDETSUGU M. Extraction of silicon dioxide from waste colored glasses by alkali fusion using sodium hydroxide[J].Journal of the Ceramic Society of Japan, 2003, 111(1294):376?381.
[9] TSAI M T. Synthesis of nanocrystalline enstatite fiber via alkoxide sol-gel process[J]. Journal of the American Ceramic Society, 2005, 88(7): 1770?1772.
[10] WU Xiang-feng, HU Guo-sheng, WANG Biao-bing, YANG Yun-feng. Synthesis and characterization of superfine magnesium hydroxide with monodispersity[J]. Journal of Crystal Growth, 2008, 310: 457?461.
[11] 尤靜林, 蔣國昌, 徐匡迪. 二硅酸鈉晶體、玻璃及其熔體結構的拉曼光譜研究[J]. 光譜學與光譜分析, 2000, 20(6): 797?799.
YOU Jing-lin, JIANG Guo-chang, XU Kuang-di. High temperature Raman spectroscopic study of the structure of sodium disilicate crystal, glass and its melt[J]. Spectroscopy and Spectral Analysis, 2000, 20(6): 797?799.
[12] ?RODA M, PALUSZKIEWICZ C. The structural role of alkaline earth ions in oxyfluoride aluminosilicate glasses-infrared spectroscopy[J]. Vibrational Spectroscopy, 2008, 48(2):246?250.
[13] 何則強, 孫新陽, 熊利芝, 劉文萍, 陳 上, 吳顯明, 黃可龍.均勻沉淀法制備NiO超細粉末及其電化學性能[J]. 中國有色金屬學報, 2008, 18(z1): 301?305.
HE Ze-qiang, SUN Xin-yang, XIONG Li-zhi, LIU Wen-ping,CHEN Shang, WU Xian-ming, HUANG Ke-long. Preparation and electrochemical properties of superfine NiO powders by homogeneous precipitation method[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(z1): 301?305.
[14] 蔣國昌, 尤靜林, 吳永全, 侯懷宇, 陳 輝. 硅酸鹽熔體微結構單元的探討[J]. 地質地球化學, 2003, 31(4): 80?86.
JIANG Guo-chang, YOU Jing-lin, WU Yong-quan, HOU Huai-yu, CHEN Hui. A discussion on the micro-structural units of silicate melt[J]. Geology-geochemistry, 2003, 31(4): 80?86.
[15] KOLESOV B A, TANSKAYA J V. Raman spectra and cation distribution in the lattice of olivines[J]. Materials Research Bulletin, 1996, 31(8): 1035?1044.
[16] LIN Chung-cherng, CHEN Shin-fan, LIU Lin-gun. Anionic structure and elasticity of Na2O-MgO-SiO2glasses[J]. Journal of Non-Crystalline Solids, 2007, 353(4): 413?425.
[17] WALRAFEN G E, DOUGLAS R T W. Raman spectra from very concentrated aqueous NaOH and from wet and dry, solid,and anhydrous molten, LiOH, NaOH, and KOH[J]. J Chem Phys,2006, 124: 114504.

