HLA-B27陽性強直性脊柱炎患者淋巴細胞含量、DKK1和BMP-2因子表達研究
劉 華,董 青
(江蘇省蘇州市中醫院檢驗科 215007)
強直性脊柱炎(ankylosing spondylitis,AS)是一種危害骨骼系統與自身免疫相關的慢性疾病,癥狀表現為關節部位疼痛,行動不便,嚴重者甚至喪失活動能力,病理實驗顯示為關節的纖維化和骨性強直,進一步研究表明該疾病與人類白細胞抗原MHC-Ⅰ類分子HLA-B27高度相關,HLA-B27陽性成為AS的診斷指標之一[1]。Dickkopf(DKK1)是一種含有2個富半胱氨酸區域的分泌性糖蛋白,參與抑制Wnt/β-catenin信號[2],通過多種級聯反應抑制成骨細胞,激活破骨細胞,破壞成骨與溶骨失衡。骨形成蛋白-2(bone morphogenetic protein,BMP-2)是一種生長因子,在體內、體外均有較強的骨誘導活性,可以使堿性磷酸酶的活性增高、骨橋蛋白、骨鈣蛋白及1型膠原蛋白合成增加[3]。本研究通過流式細胞術檢測淋巴細胞亞群在B27陽性患者和健康人之間的差別,通過酶聯免疫反應檢測DKK1和BMP-2在AS患者和健康人中的含量,探討淋巴細胞亞群的結構與AS患病的關系,并進一步深入研究DKK1和BMP-2與AS疾病之間的關系,為研究AS疾病提供新的參考依據。
1 資料與方法
1.1一般資料 隨機抽取30例HLA-B27陰性健康受試者(對照組),60例HLA-B27陽性住院患者(AS組),符合AS診斷標準。所有受試者均于當天抽取外周靜脈血2 mL,EDTA-2K抗凝,標本在6 h之內測定。
1.2儀器與試劑 流式細胞儀購自美國BD公司;酶標儀、洗板機購自芬蘭雷勃公司;離心機購自德國艾本德公司;隔水式培養箱購自海門市恒昌儀器廠。CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC(Cat NO:340499t)、CD3-FITC/CD16+56-PE/CD45-PerCP/CD19-APC(Cat NO:340500+)購自BD公司;人DKK1和BMP-2酶聯免疫吸附測定(ELISA)試劑盒購自上海滬尚生物科技有限公司。
1.3方法
1.3.1流式細胞儀標本處理 選2支試管,分別加入CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC、CD3-FITC/CD16+56-PE/CD45-PerCP/CD19-APC 20 μL,將標本充分混勻,分別加入50 μL標本,振蕩器上充分混勻,避光放置15 min;加入溶血素2 mL,充分振蕩,避光放置10 min。1 500 r/min離心5 min棄上清液,加入生理鹽水2 mL振蕩,1 500 r/min離心5 min棄上清液,加入生理鹽水100 μL,充分振蕩混勻,待測。
1.3.2流式細胞儀器設置及數據分析 采用FACS Comp調整儀器FSC、SSC、FL1、FL2、FL3、FL4的電壓及補償。采用CELL Quest軟件獲取20 000個淋巴細胞,分析CD3、CD4、CD8、CD19、CD16+56細胞占淋巴細胞的百分比。分別將他們與淋巴細胞絕對數相乘,得到各種表型細胞的絕對值。
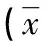
表1 對照組與AS患者的淋巴細胞亞群百分比±s)
1.3.3ELISA分析 按照試劑盒說明操作,標準品的稀釋與加樣:標準品稀釋好5個梯度,每孔加樣量均為50 μL;加樣:分別設空白孔、待測樣品孔。在酶標包被板上待測樣品孔中先加樣品稀釋液40 μL,然后再加待測樣品10 μL;溫育:封板膜封板37 ℃ 溫育30 min;洗滌:棄去液體,每孔加滿洗滌液,靜置 30 s后棄去,重復5次;加酶:每孔加入酶標試劑50 μL;溫育:步驟同上;洗滌:步驟同上;顯色:每孔先加入顯色劑A 50 μL,再加入顯色劑B 50 μL,輕輕震蕩混勻,37 ℃避光顯色15 min;終止:每孔加終止液50 μL,終止反應;測定:450 nm波長依序測量各孔A值。
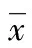
2 結 果
與對照組相比,HLA-B27陽性AS疾病患者總T細胞含量百分比顯著下降,差異有統計學意義(P<0.05);CD4+T和CD8+T細胞百分比明顯下降,而差異無統計學意義(P>0.05);T4/T8比值有所上升,但差異無統計學意義(P>0.05);B細胞含量百分比顯著升高,差異有統計學意義(P<0.05);NK細胞百分比含量略有上升,差異無統計學意義(P>0.05),見表1。ELISA試劑盒標準曲線的繪制,通過標準品的梯度加樣測定并繪制標準曲線,DKK1和BMP-2的標準曲線r2分別為0.998 5、0.997 9,HLA-B27陽性中DKK1和BMP-2的表達與對照組相比均顯著上升,差異有統計學意義(P<0.05),見表2。

表2 對照組與AS患者的DKK1和
▲:P<0.05,△:P<0.05,與對照組比較。
3 討 論
AS是與免疫學密切相關的疾病,有流行病學發病因素,也有遺傳學易感因素[4]。早在1973年Brewerton等[5]和Schlosstein等[6]就分別證實HLA-B27抗原與AS有強關聯性,并且 HLA-B27 陽性個體一生中患AS 的可能性為HLA-B27 陰性者的300倍,這提示HLA-B27基因或者是AS的疾病相關的基因,或者是與致病基因緊密連鎖。有越來越多的證據表明,HLA-B27基因或與AS疾病相關,HLA-B27轉基因大鼠骨量的變化,發現有疾病傾向的 HLA-B27大鼠骨量減少,該實驗表明HLA-B27基因缺陷與疾病中骨量丟失有關[7]。HLA-B27基因多態性影響機體相關的免疫應答反應,本研究通過流式細胞術檢測AS患者淋巴細胞亞群的含量百分比,探討淋巴細胞的變化與疾病的關系,總T細胞百分含量有顯著下降,B細胞百分含量顯著上升,表明在本檢測的患者體內,T細胞和B細胞較對照組異常,可能與AS有關,而T4、T8、T4/T8及NK細胞的百分比含量均有所變化,但差異無統計學意義(P>0.05)。
雖然HLA-B27陽性與AS 有強相關性,但是至今AS的發病機制仍然不清楚,提示AS發病機制的復雜性。AS是危害骨骼系統的疾病,臨床主要表現為骶髂關節及中軸關節病變為特征的脊柱關節炎癥疾病。DKK1蛋白屬于Dickkopf家族,可通過誘導beta-catenin磷酸化及降解來抑制Wnt信號通路,從而阻斷早期成骨細胞形成并誘導未成熟成骨細胞的凋亡[8]。DKK1是一種可溶性外泌型的糖蛋白,通過對Wnt信號的作用調節骨質重塑。有研究表明,過度表達DKK1或DKK1缺失表達分別可導致嚴重骨質丟失及大量骨質形成[9]。另有研究表明,多發性骨髓瘤(multiple myeloma,MM)細胞泌的DKK1通過與基質細胞表面的 LRP5 和(或)LRP6相互作用抑制β-catenin 組裝,從而抑制成骨細胞發揮骨質重塑功能[10]。以上證據表明,DKK1與骨質的丟失和形成有關,本實驗測得AS患者DKK1表達顯著上升,這提示DKK1與AS疾病的發病相關,其具體機制尚待進一步深入研究。
BMP-2作為TGF-β超家族成員,是一種重要的成骨調節因子,有很強的促進成骨細胞分化的功能,并表達特異性的成骨細胞產物[11]。BMP-2可以促進骨髓基質間充質細胞體外增值和誘導其分化為成骨前體細胞[12]。重組人BMP-2(rhBMP-2)可誘導再生軟骨和再生骨的形成[13]。本研究檢測HLA-B27陽性AS患者中BMP-2的表達與對照組相比顯著升高,AS與骨組織的逐步病變密切相關,有學者也提出BMPs類蛋白可能在AS發生過程中其重要作用,BMP-2的表達異常是否與患者骨組織病變有關,值得深入研究[14]。
雖然AS的研究廣泛而深入,但尚不能揭示其發病的根本原因,也表明AS發病的復雜性及影響因素的復雜性,有免疫因素、遺傳因素以及環境的互作,大多相關試驗都在研究這些因素與AS的關系,而AS患者病理實驗顯示為關節的纖維化和骨性強直,提示調節骨質或者骨細胞生長發育的基因也很有可能直接或間接參與AS的發病,而這些研究比較少見。本研究利用傳統的流式細胞術發現,MHC-Ⅰ類分子HLA-B27陽性AS患者T淋巴細胞和B淋巴細胞異常,進一步說明了AS的發病與HLA-B27遺傳基因及免疫因素相關。采用ELISA分析發現,調節骨質和骨細胞生長發育的兩個因子DKK1和BMP-2表達顯著升高,該兩種因子可能與AS發病有關,有待進一步探討,這為深入研究AS發病機制及臨床的診斷和治療提供新的思路和方法。
[1]Díaz-PeoaR,López-VázquezA,López-LarreaC.OldandnewHLAassociationswithankylosingspondylitis[J].TissueAntigens,2012,80(3):205-213.
[2]Mao B,Wu W,Davidson G,et al.Kremen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signaling[J].Nature,2002,417(6889):664-667.
[3]Nakashima K,de Crombrugghe B.Transcriptional mechanisms in osteoblast differentiation and bone formation[J].Trends Genet,2003,19(8):458-466.
[4]黃烽,楊春華.強直性脊柱炎臨床及免疫發病機制的研究進展[J].中國免疫學雜志,2001,17(6):281-285.
[5]Brewerton DA,Hart FD,Nicholls A,et al.Ankylosing spondylitis and HL-A 27[J].Lancet,1973,1(7809):904-907.
[6]Schlosstein L,Terasaki PI,Bluestone R,et al.High association of an HL-A antigen,W27,with ankylosing spondylitis[J].N Engl J Med,1973,288(14):704-706.
[7]Rauner M,Stupphann D,Haas M,et al.The HLA-B27 transgenic rat,a model of spondyloarthritis,has decreased bone mineral density and increased RANKL to osteoprotegerin mRNA ratio[J].J Rheumatol,2009,36(1):120-126.
[8]Pinzone JJ,Hall BM,Thudi NK,et al.The role of Dickkopf-1 in bone development,homeostasis,and disease[J].Blood,2009,113(3):517-525.
[9]Mukhopadhyay M,Shtrom S,Rodriguez-Esteban C,et al.Dickkopf1 is required for embryonic head induction and limb morphogenesis in the mouse[J].Dev Cell,2001,1(3):423-434.
[10]Tian E,Zhan F,Walker R,et al.The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma[J].N Engl J Med,2003,349(26):2483-2494.
[11]Ebara S,Nakayama K.Mechanism for the action of bone morphogenetic proteins and regulation of their activity[J].Spine(Phila Pa 1976),2002,27(16 Suppl 1):10-15.
[12]Kirker-Head C,Karageorgiou V,Hofmann S,et al.BMP-silk composite matrices heal critically sized femoral defects[J].Bone,2007,41(2):247-255.
[13]Sila-Asna M,Bunyaratvej A,Maeda S,et al.Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell[J].Kobe J Med Sci,2007,53(1/2):25-35.
[14]Carter S,Braem K,Lories RJ.The role of bone morphogenetic proteins in ankylosing spondylitis[J].Ther Adv Musculoskelet Dis,2012,4(4):293-299.

