地塞米松對哮喘小鼠氣道血管生成及血管內皮生長因子表達的影響
姚紅衛,呂麗麗
(1.江蘇省常州市第四人民醫院呼吸內科 213001;2.徐州醫學院附屬醫院老年科,江蘇徐州 221008)
氣道重塑是哮喘的重要病理特征之一,目前國內外對氣道重塑的研究多集中于平滑肌增生/肥大、基底膜增厚導致的氣道壁增厚,對于血管生成等氣道血管改變方面的研究尚較少。血管內皮細胞生長因子(VEGF)是一種有效的多功能的血管調節因子,它通過與血管內皮上的特異性受體結合,具有強大的促進內皮細胞增殖、增加微血管通透性、誘導血管生成等多種功能。本研究通過建立慢性哮喘小鼠模型,了解VEGF在哮喘小鼠模型肺組織中的表達和對氣道血管生成的作用,以及早期應用地塞米松對氣道重塑及VEGF表達的影響,現報道如下。
1 材料與方法
1.1材料 采用4~6周齡的BALB/c小鼠30只,雌性,體質量18~22 g(購自徐州醫學院實驗動物中心)。飼養條件為清潔級環境,室溫為22~25 ℃,自由飲水無雞卵清蛋白(OVA)進食。
1.2儀器與試劑 OVA(美國Sigma公司),小鼠VEGF ELISA檢測試劑盒(深圳晶美公司),兔抗小鼠Ⅷ因子多克隆抗體和Enivision 試劑(即用型,丹麥Dako公司),VEGF 多克隆抗體及SABC免疫組化檢測試劑盒(購自武漢博士德生物工程有限公司),奧林巴斯圖像采集系統,402A型超聲霧化器(江蘇魚躍醫療設備有限公司)。
1.3方法
1.3.1哮喘模型的制備和分組 將30只小鼠按隨機數字表法分為3組,每組10只。生理鹽水對照組(A組):以生理鹽水代替OVA致敏和激發。哮喘組(B組):分別于第0、7、14及21天給小鼠腹腔注射OVA致敏液0.2 mL(含OVA 25 μg硫酸鋁鉀1 mg)在致敏后第28天,將小鼠置于一容器中(20 cm×40 cm×50 cm),每5只為1組,以2%的OVA溶液霧化激發,每天1次,每次30 min,連續7 d,然后再隔天1次共激發18次;觀察小鼠反應,如出現煩躁不安、呼吸急促、流涎、大小便失禁和腹肌痙攣等為陽性反應。地塞米松干預組(C組):每次激發前1 h予地塞米松(2 mg/kg)腹腔注射。
1.3.2標本收集 末次霧化激發24 h后,以5%的水合氯醛0.4 mL腹腔注射麻醉小鼠,分離氣管,插入套管針,暴露胸腔,結扎右主氣管,用0.3 mL的磷酸鹽緩沖液(PBS)行左肺支氣管肺泡灌洗,反復3次,回抽率在80%以上,將收集的支氣管肺泡灌洗液(BALF)放入1.5 mL的EP管中,低速離心10 min,沉渣以1 mL Hank′s液重懸,行細胞計數。上清液-70 ℃保存待測定VEGF濃度。將右肺組織及氣管浸入10%中性甲醛溶液中固定,經漂洗、脫水、包埋制成蠟塊,切片后行蘇木精-伊紅(HE)染色行病理學觀察,部分行免疫組化染色。
1.3.3BALF中活性VEGF的測定 應用小鼠VEGF ELISA檢測試劑盒檢測BALF中VEGF水平,步驟按試劑盒說明書進行。
1.3.4VEGF免疫組化染色 石蠟切片脫蠟至水,3%過氧化氫(H2O2)室溫孵育10 min,以消除內源性過氧化物酶的活性,經微波處理,滴加比例為1∶100的VEGF一抗抗體,37 ℃孵育1 h;滴加二抗試劑盒中A液(生物素化山羊抗小鼠IgG),37 ℃孵育20 min;滴加二抗試劑盒中B液(試劑SABC),37 ℃孵育30 min;用二氨基聯苯胺(DAB)溶液顯色,室溫顯色,鏡下控制反應時間。自來水充分沖洗,HE輕度復染,脫水,透明,封片。PBS代替一抗作為陰性對照。VEGF陽性染色為棕黃色或棕褐色顆粒,主要定位在胞漿。
1.3.5氣管血管密度的計算 病理切片采用Envision 法行抗Ⅷ因子免疫組化染色標記血管內皮細胞,操作按試劑盒說明書進行。用PBS代替一抗作陰性對照,以血管內壁出現棕黃色或黃色顆粒狀為陽性反應。每個標本觀察5張切片,每張切片在顯微鏡(×1 000)下于黏膜下層、黏膜固有層血管盡可能多的區域選10個視野,計數50個視野中(1 mm2)陽性反應的管腔樣結構的總數。計數采取盲法,由兩位不知實驗分組的醫師獨立完成。
1.3.6圖像分析 肺組織切片在顯微鏡下放大200倍,每組隨機選取直徑100~200 μm完整的小支氣管橫截面30個,采用計算機圖像分析系統,測定完整的無軟骨支氣管橫斷面的基底膜周徑(Pbm,μm)、管壁面積(WAt,μm2),計算支氣管管壁厚度(WAt/Pbm)表示氣道壁厚度。每張小鼠肺組織切片隨機選取10個視野,測定每組肺組織切片中的血管數。
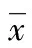
2 結 果
2.1各組小鼠BALF中細胞計數和活性VEGF含量的比較 分析不同組BALF中白細胞總數、EOS百分比及VEGF濃度變化,可見哮喘組明顯高于對照組,差異有統計學意義(P<0.05),地塞米松組較哮喘組降低,差異有統計學意義(P<0.05),見表1。
2.2肺組織病理學改變 對照組小鼠氣道黏膜正常,管周無炎性細胞浸潤,支氣管腔規則;與對照組比較,哮喘組氣道壁及氣道平滑肌明顯增厚,黏膜下層增寬,管腔狹窄,黏膜下、支氣管及血管周有大量炎性細胞浸潤;地塞米松組上述改變明顯減輕,炎性細胞浸潤明顯減少,但部分結構仍有輕微破壞,見封2圖1~3。
2.3VEGF蛋白質在小鼠氣道和肺內的表達 免疫組化結果顯示 哮喘組小鼠氣道黏膜上皮細胞、支氣管平滑肌、肺泡上皮細胞和血管周圍有大量棕黃色VEGF陽性蛋白顆粒表達,對照組VEGF陽性蛋白顆粒較少,地塞米松組VEGF呈弱陽性表達,見封2圖4~6 。
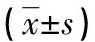
表1 各組BALF中白細胞總數、EOS百分比及VEGF濃度
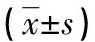
表2 各組氣管血管密度、支氣管壁厚度及肺組織血管計數的比較

圖7 BALF中VEGF水平與氣管血管密度成正相關(r=0.814,P<0.05)

圖8 BALF中VEGF水平與支氣管壁厚度成正相關(r=0.643,P<0.05 )
2.4各組氣管血管密度、WAt/Pbm及肺組織血管計數的變化 抗Ⅷ因子免疫組化染色及圖像分析軟件顯示:哮喘組的氣管血管密度、WAt/Pbm及肺組織血管計數明顯高于對照組(P<0.05);與哮喘組比較,地塞米松組氣管血管密度、WAt/Pbm及肺組織血管計數明顯減少(P<0.05),見表2。
2.5相關性分析結果提示 BALF中VEGF的水平與氣管血管密度、支氣管壁厚度及肺組織中的血管數目皆呈正相關,見圖7~9。

圖9 BALF中VEGF水平與肺組織中血管數目成正相關(r=0.650,P<0.05)
3 討 論
氣道血管生成/血管增生是哮喘氣道重塑的一個重要病理特征,VEGF是一強有力的刺激血管內皮細胞的生長因子,主要有兩大生物學功能:一是增加血管通透性,是已知最強的血管通透劑[1];二是促進血管生成的功能。因此它可能與支氣管哮喘的發病密切相關。研究發現過敏原可誘導支氣管上皮細胞表達VEGF mRNA,產生較多的VEGF,進而改變氣道的通透性,導致氣道滲出、水腫[2]。Feltis等[3]發現,在哮喘患者支氣管黏膜及BALF中的VEGF水平較對照組明顯升高,且與支氣管黏膜下的血管數目呈正相關。Gomulka等[4]研究發現,在哮喘患者血清和誘導痰中VEGF 含量均顯著升高,VEGF和VEGF受體的水平與新血管的生成密切相關。同樣的,劉鑫等[5]研究發現,慢性哮喘模型大鼠的總氣管壁、氣管內壁及氣道平滑肌增厚,肺組織VEGF mRNA及VEGF蛋白的表達增高,提示VEGF可能參與了慢性哮喘大鼠的氣道重塑過程。本研究顯示,VEGF在小鼠哮喘模型氣道及肺組織內呈過度表達,并且BALF中VEGF的水平與氣管血管密度、支氣管壁厚度及肺組織中的血管數目皆呈正相關。提示測定VEGF水平可能會成為評價哮喘控制情況和氣道重塑嚴重程度很有價值的指標。
糖皮質激素(GCS)是治療哮喘的有效方法[6]。激素能緩解氣道的重塑,其機制之一就是通過降低血管滲透性和血漿蛋白的滲出從而減輕炎癥和氣道重塑。有研究表明激素能通過GCS受體通路降低VEGF的分泌和表達,而且這種作用是有時間依賴性和劑量依賴性的[7-8]。Chetta等[9]在對30例輕中度哮喘患者予氟替卡松吸入治療6周后發現,其氣道高反應性、癥狀評分及炎癥細胞數均較治療前明顯下降。在體外實驗中也發現,激素是VEGF強大的抑制劑,激素能下調哮喘患者氣道中促血管生成的炎癥介質的水平[10]。本研究在應用地塞米松治療后,哮喘組BALF中白細胞總數、EOS百分及VEGF濃度顯著下降,肺組織內VEGF呈弱陽性表達,其氣管血管密度、WAt/Pbm及肺組織內血管計數均顯著減少。上述結果提示,地塞米松干預可降低哮喘模型的氣道炎癥,減緩氣道血管生成的過程。
[1]Dvorak HF,Brown LF,Detmar M,et al.Vascular permeability factor/vascular endothelial growth factor,microvascular hyperpermeability,and angiogenesis[J].Am J Pathol,1995,146(5):1029-1039.
[2]Antony AB,Tepper RS,Mohammed KA,et al.Cockroah extractantigen fincreases bronchial airway epithelial plermeability[J].Allergy Clin Immunol,2002,110(4):589- 595.
[3]Feltis BN,Wignarajah D,Zheng L,et al.Increased vascular endothelial growth factor and receptors:relationship to angiogenesis in asthma[J].Am J Respir Crit Care Med,2006,173(11):1201-1207.
[4]Gomulka K,Liebhart J.Vascular endothelial growth factor - structure,function and role in airways inflammation and the clinical course of asthma[J].Pneumonol Alergol Pol,2009,77(6):549-553.
[5]劉鑫,梅全慧,劉希,等.VEGF、HIF-1α在大鼠慢性哮喘模型中的表達及地塞米松的干預效應[J].重慶醫學,2010,39(22)3013-3015.
[6]Korideck H,Peterson JD.Noninvasive quantitative tomography of the therapeutic response to dexamethasone in ovalbumin-induced murine asthma[J].J Pharmacol Exp Ther,2009,329(3):882-889.
[7]Nomura S,Kanazawa H,Hirata K,et al.Relationship between vascular endothelial growth factor and angiopoietin-2 in asthmatics before and after inhaled beclomethasone therapy[J].J Asthma,2005,42(2):141-146.
[8]Bandi N,Kompella UB.Budesonide reduces vascular endothelial growth factor secretion and expression in airway(Calu-1) and alveolar(A549) epithelial cells[J].Eur J Pharmacol,2001,425(2):109-116.
[9]Chetta A,Zanini A,Foresi A,et al.Vascular component of airway remodeling in asthma is reduced by high dose of fl uticasone[J].A m J Respir Crit Care Med,2003,167(5):751-757.
[10]Wen FQ,Liu X,Manda W,et al.Th2 Cytokine-enhanced and TGF-β-enhanced vascular endothelial growth factor production by cultured human airway smooth muscle cells is attenuated by IFN-γ and corticosteroids[J].J Allergy Clin Immunol,2003,111(6):1307-1318.

