組織型纖溶酶原激活物在進展期大腸癌組織中的表達與微血管密度的相關性研究*
顧 敏,孟信春,王 強,楊清平
(1.重慶市長壽區中醫院普外科 401220;2.重慶市長壽區人民醫院普外科 401220;3.重慶市長壽區人民醫院病理科 401220)
組織型纖溶酶原激活物(t-PA)由血管內皮細胞合成分泌,可以選擇性激活與纖維蛋白結合的纖溶酶原而發揮纖溶作用,近年來發現t-PA能夠通過激活細胞外基質中的蛋白質酶聯反應來降解微血管基膜及細胞外基質,從而阻礙微血管的生成。國內多家研究數據顯示癌組織中t-PA濃度明顯低于正常組織。本文通過檢測癌組織浸液中t-PA濃度及癌組織微血管密度(MVD),初步探討t-PA在腫瘤浸潤轉移過程中的調節機制。
1 資料與方法
1.1一般資料 選取2008年6月至2010年8月本院大腸癌患者手術切除的標本60例。患者術前檢查未發現遠處轉移,術前未接受放化療,無急性腸梗阻患者,經腸道準備后行標準大腸癌根治術。肉眼見腸管漿膜層、直腸系膜或鄰近組織有浸潤。病理證實癌組織浸潤腸管全層,包括高中低分化腺癌及黏液腺癌。切取外緣癌組織為研究組,另取距腫瘤5 cm以上的正常腸管組織20例為對照組。
1.2方法 將外緣癌組織分為兩等分,分別檢測組織型纖溶酶原激活物及微血管密度。t-PA檢測采用發色底物法,試劑購自上海太陽生物技術公司。將癌組織剪成細小碎塊,按比例加入PBS液后研碎,獲取組織勻漿,離心后取上清液檢測。MVD檢測采用免疫組化SP法,鼠抗人CD34單克隆抗體及試劑盒購自武漢博士德生物工程公司。每張切片在100低倍光鏡下挑選微血管分布最密集區,然后在200高倍光鏡下計算5個視野的微血管數目取平均值。
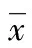
2 結 果
進展期大腸癌外緣癌組織浸液t-PA濃度低于癌旁正常腸管組織(P<0.01),外緣癌組織的微血管密度高于正常(P<0.01)。相關性分析顯示,t-PA濃度與MVD呈負相關(r=-0.570 8)。

表1 研究組和對照組t-PA濃度及微血管密度的比較±s)
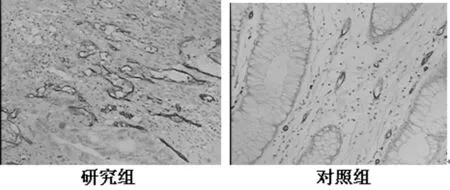
圖1 SP染色,CD34定位于血管內皮細胞的細胞膜與細胞質,研究組的密度明顯高于對照組

圖2 大腸癌組t-PA濃度與MVD的相關性分析
3 討 論
腫瘤的生長和浸潤轉移同時存在細胞外基質的降解和微血管基膜的生成兩種微觀過程。這兩種過程由大量的信號分子來綜合調控。有研究證實,乙酰肝素酶、尿激酶型纖溶酶原激活物、基質金屬蛋白酶等能夠介導降解細胞外基質的活性分子在癌組織中大量表達。而多項研究發現,作為尿激酶型纖溶酶原激活物的同類型物質,組織型纖溶酶原激活物同樣能介導細胞外基質的降解,卻在腫瘤組織中低表達。
本研究嚴格選取已浸潤漿膜層的進展期大腸癌外緣癌組織作為檢測對象,因為進展期的腫瘤生長較為成熟,腫瘤內各種活性因子表達較高,而處于外緣的癌組織侵襲性更強,血管生成更為密集,并且我們除外了急性腸梗阻的病例,因腸管擴張組織水腫能改變被檢測物的濃度,故檢測結果具有代表性。本研究發現,在外緣癌組織中的t-PA濃度確實明顯低于正常組織,而微血管密度卻顯著高于正常。
正常情況下t-PA 及PAI-1分布在血管腔表面,并且存在動態平衡調節著血漿纖溶活性,由于新生微血管內皮細胞結構功能不完整,t-PA 能夠擴散至腔外,從而能夠降解微血管基膜及細胞外基質,阻礙微血管的生成。筆者認為腫瘤組織通過某種信號介導降低血管內皮細胞的t-PA合成分泌,同時增加PAI-1的表達,阻斷t-PA對新生微血管基膜的降解,有助于新生內皮細胞的穩定附著,從而促進微血管的生成。并且t-PA濃度降低后造成纖溶酶活性減低,造成局部的高凝狀態,高凝狀態可以減少免疫細胞的造訪,可以提供相對穩定的物理環境以維持各種活性因子的濃度,有利于腫瘤細胞的復制和微血管的生成。
[1]吳慶玉,徐德勝.數種惡性腫瘤患者血漿t-PA濃度分析[J].北京醫科大學學報,1996,28(3):234.
[2]Hu K,Yang J,Tanaka S,et al.Tissue-type plasminogen activars acts as a cytokine that triggers intracellular signal transduction and induces matrix metalloproteinase-9 gene expression[J].J Biol Chem,2006,281(4):2120-2127.
[3]Diaz VM,Hurtado M,Thomson TM,et al.Specific interaction of tissue-type plasminogen activator(t-PA) with annexin II on the membrane of pancreatic cancer cells activates plasminogen and promotes invasion in vitro[J].Gut,2004,53(7):993-1000.
[4]Poon RT,Ng IO,Lau C,et al.Tumor Microvessel Density as a Predictor of Recurrence After Resection of Hepatocellular Carcinoma:A Prospective Study[J].J Clin Oncol,2002,20(7):1775-1785.
[5]劉大林,陳國玉.胃癌組織中微血管密度和尿激酶型纖溶酶原激活物的意義[J].江蘇醫藥雜志,2003,29(1):53-54.
[6]何旭,胡志恒.尿激酶型纖溶酶原激活物系統與腫瘤關系的研究進展[J].海軍醫學雜志,2005,26(1):75-77.
[7]盧興國,張桂娣.肝癌組織浸液尿激酶性和組織型纖溶酶原激活物的檢測[J].基礎醫學與臨床,2003,25(5):572-573.
[8]沈友進,尹俊.組織型纖溶酶原激活劑研究進展[J].廣東醫學 2008,29(9):1581-1584.
[9]Casslén B,Bossmar T,Lecander I.Plasminogen activators and plasminogen activator inhibitors in blood and tumor fluids of patients with ovarian cancer[J].Eur J Cancer,1994,30A(9):1302-1309.
[10]De Cremoux P,Grandin L,Diéras V,et al.Urokinase-type Plasminogen Activator and Plasminogen-activator-inhibitor Type 1 Predict Metastases in Good Prognosis Breast Cancer Patients [J].Anticancer Res,2009,29(5):1475-1482.

