水飛薊素對野百合堿誘發肺動脈高壓大鼠肺血管重構的保護作用
楊 勇,呂進泉,趙文生
(江蘇大學附屬醫院兒科,江蘇鎮江 212001)
肺動脈高壓(pulmonary hypertension,PH)是由于肺循環受限引起肺血管阻力進行性增加,最終導致右心衰竭的綜合征。病情進展迅速,預后極差[1]。本研究通過大劑量外源性水飛薊素干預經腹腔注射野百合堿(MCT)復制的肺動脈高壓大鼠模型,觀察肺動脈高壓大鼠模型的肺血管重構及Fas mRNA的表達變化,探討水飛薊素對肺動脈高壓大鼠模型肺血管重構的保護作用及機制。
1 材料與方法
1.1實驗動物 雄性Sprague Dawley(SD)大鼠24只,體質量230~250 g,由江蘇大學實驗動物中心提供。
1.2儀器與試劑 MCT(美國Sigma公司);水飛薊素(天津天士力制藥股份有限公司),Medlab-U/8C502生物信號處理系統(南京美易科技有限公司);Bio-Rad實時定量PCR儀C1000(伯樂生命醫學產品有限公司);α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)抗體(武漢博士德生物工程有限公司,貨號:BM0002);RT試劑盒(Fermentas中國公司,貨號:K1622);熒光定量PCR試劑盒(東洋紡生物科技有限公司);TUNEL凋亡試劑盒(南京凱基);Fas引物序列(擴增產物198 bp,上海生工生物工程有限公司):上游5′-TGA AGA CAT CCT TGA GCC TTG-3′,下游5′-AGA TTC ATT GGC ACA CTT TCA G-3′;β-actin引物序列(擴增產物207 bp,上海生工生物工程有限公司),上游5′-CAC CCG CGA GGT CAA CCT TC-3′,下游5′-CCC ATA CCC ACC ATC ACA CC-3′。
1.3實驗動物分組、模型制備與干預 隨機分為正常對照組(C組)、MCT誘發肺動脈高壓模型組(M組)、水飛薊素治療組(S組),每組8只。MCT先溶于1 mol/L濃鹽酸,加去離子水,然后用1 mol/L的氫氧化鈉調pH至7.4,最終配置成濃度20 mg/mL野百合堿溶液。M組、S組大鼠一次性腹腔注射MCT 60 mg/kg,C組一次性腹腔注射生理鹽水3 mL/kg。將水飛薊素用生理鹽水配成50 mg/mL溶液,S組自第2天開始按照水飛薊素每次150 mg/kg,每天灌胃3次,共27 d。M組和C組用生理鹽水每次2 mL/kg,每天灌胃3次。
1.4觀測指標及檢測方法
1.4.1右心導管法測定平均右心室收縮壓(right ventricular systolic pressure,RVSP) 28 d后,記錄大鼠質量,右心導管法測定平均肺動脈壓,大鼠以200 mg/mL烏拉坦麻醉(2.5 mL/kg)后用聚氯乙烯導管插入右頸外靜脈,緩慢進入右心房、右心室,導管內加入肝素鹽水,測壓導管接壓力傳感器記錄壓力變化。
1.4.2心肺組織取材 完成肺動脈壓測量后,取出分離心肺組織。測量心指數:分離右心室,除去心耳、心房,用濾紙吸去血液、鹽水。分別稱取右心室和左心室加室間隔的質量,右心室肥大指數(right ventricular hypertrophy index,RVHI)=右心室質量/(左心室質量+室間隔質量)。右肺以40 g/L多聚甲醛固定,常規石蠟包埋后切片,用HE染色、α-SMA免疫組織化學染色、TUNEL法檢測肺動脈平滑肌細胞凋亡。左肺置于液氮中凍存,用于Fas mRNA半定量RT-PCR檢測。
1.4.3HE染色 肺組織石蠟切片常規脫蠟至水,HE染色,脫色透明后,中性樹膠封片。顯微鏡下觀察肺動脈大體形態變化。
1.4.4肺動脈α-SMA免疫組織化學染色 肺組織石蠟切片常規脫蠟至水,SP法檢測α-SMA抗原的表達,1∶100稀釋一抗,DAB顯色。胞質棕黃色著色為陽性信號。采用Image-Pro Plus圖像分析系統,隨機選取50~100 μm血管20根,取平均光密度值(平均光密度值=累積光密度/面積)評價肺小動脈平滑肌細胞增殖程度。
1.4.5TUNEL法檢測大鼠肺動脈平滑肌細胞凋亡 肺組織切片脫蠟至水,參照TUNEL凋亡試劑盒說明書進行操作。結果判定:顯微鏡下隨機選取50~100 μm左右的肺動脈,計數500個肺動脈平滑肌細胞中的凋亡細胞數,求得凋亡指數(AI)。AI=凋亡細胞數/總細胞數×100%。
1.4.6肺組織Fas mRNA RT-PCR檢測 采用Trizol法提取肺組織總RNA,核酸蛋白分析儀測總RNA的純度。cDNA第一鏈的合成和熒光定量PCR過程采用RT試劑盒和熒光定量PCR試劑盒,按照說明書操作。擴增反應條件:95 ℃預變性1 min,按下列步驟擴增40個循環,95 ℃變性5 s,56 ℃退火30 s,72 ℃延伸30 s;最后一個循環后,72 ℃延伸10 min。

2 結 果
2.1RVSP及RVHI的變化 與C組相比,MCT誘發28 d后,M組的RVSP 及RVHI明顯升高(P<0.05)。經干預后,S組RVSP及RVHI低于M組(P<0.05),見表1。
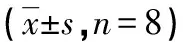
表1 3組大鼠RVSP 和RVHI變化的比較
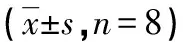
表2 3組大鼠肺動脈平滑肌細胞α-SMA、凋亡指數及肺組織Fas mRNA表達的比較
2.2肺組織HE染色、α-SMA免疫組織化學染色、細胞凋亡指數、Fas mRNA相對表達量 HE染色所見:C組(封3圖1A)肺動脈管壁菲薄;S組(封3圖1B)肺動脈管壁較C組明顯增厚,但較M組薄,炎癥細胞浸潤減輕;M組(封3圖1C)肺動脈管壁明顯增厚,管腔狹窄,大量炎癥細胞浸潤。與M組(封3圖2A)比較,C組(封3圖2B)α-SMA表達低(P<0.01)、Fas mRNA表達高(P<0.01)、細胞凋亡指數升高(P<0.05),S組(封3圖2C)α-SMA表達低(P<0.01)、Fas mRNA表達高(P<0.01)、細胞凋亡指數稍升高,見表2。
3 討 論
目前,研究認為,炎癥、過氧化物、遺傳基因等多種因素損傷肺微小動脈內皮細胞是肺動脈高壓(PAH)發生的始動環節[2]。肺動脈內皮細胞功能紊亂、平滑肌細胞和纖維原細胞活化、血管壁細胞間交互作用、循環祖細胞黏附、血管壁的持續性收縮是PAH血管重構主要機制[3]。SD大鼠腹腔注射MCT后,藥物經肝臟代謝生成五元雜環的吡咯MCT,可特異性損傷肺血管內皮細胞,引起內皮細胞功能障礙、血管平滑肌細胞增生、肺動脈壓力增高,復制肺動脈高壓模型[4]。
本實驗給予大劑量水飛薊素干預S組大鼠后,S組大鼠糞便稍有稀爛改變,1周后好轉,未見其他不良反應。給予大劑量水飛薊素干預S組大鼠,大鼠RVSP下降,肺血管重構的病理改變減輕,說明大劑量水飛薊素干預可以減輕肺動脈高壓模型大鼠肺血管的重構,改善肺動脈高壓癥狀。其機制可能為:(1)抗氧化作用。氧化損傷可以通過損傷血管內皮、促進肺動脈平滑肌細胞增殖、促進血管外基質增生等多條途徑參與肺血管重構[5]。活性氧(reactive oxygen species,ROS)是細胞內重要的具有氧化還原潛能的氧衍生物,參與血管平滑肌細胞增殖、分化、凋亡、遷移等多種功能調控[6]。水飛薊素具有良好的抗氧化和自由基清除活性[7]。水飛薊素可以抑制細胞與組織ROS的產生,并促進細胞組織產生超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px),通過抑制氧自由基的過度產生和促進氧自由基降解酶生成抑制細胞損傷及血管重構。(2)抗炎作用。研究顯示炎癥反應參與了肺動脈高壓的發生及發展過程,中性粒細胞等炎癥細胞、IL-1、IL-6、TNF-α、PDGF、VEGF等炎癥因子均參與了內皮細胞損傷及血管壁重構[8-10]。水飛薊素可以通過抑制NF-κB的轉錄活性、清除活性氧自由基等機制抑制炎癥反應[11-12]。本實驗觀察到大劑量水飛薊素干預后肺微小動脈周圍炎癥反應減輕,證實水飛薊素可以通過抗炎作用減輕血管重構。(3)本實驗研究發現水飛薊素干預MCT誘發PAH模型大鼠可以提高肺組織Fas mRNA表達,肺動脈血管平滑肌細胞凋亡增多,可部分調節血管平滑肌的增殖與凋亡平衡,具體機制尚不明確[13]。(4)基質金屬蛋白酶(matrix metalloprotenases,MMPs)大量分泌可以降解彈力纖維,破壞正常膠原結構,誘發肺小動脈重構。水飛薊素可以通過降低細胞MMPs表達水平,抑制膠原合成,發揮對組織的保護作用[14-15]。
本實驗結果顯示大劑量水飛薊素可以減輕MCT誘發肺動脈高壓大鼠模型肺組織炎癥細胞浸潤,促進肺動脈高壓大鼠肺組織Fas mRNA表達,提高肺動脈高壓大鼠肺血管平滑肌細胞凋亡,降低RVSP,減輕肺動脈重構變化,對MCT誘發的肺動脈高壓大鼠具有保護作用。
[1]MclaughlinVV,ArcherSL,BadeschDB,etal.ACCF/AHA2009expertconsensusdocumentonpulmonaryhypertension[J].JAmCollCardiol,2009,53(17):1574-1619.
[2]Tuder RM,Abman SH,Braun T,et al.Development and pathology of pulmonary hypertension[J].J Am Coll Cardiol,2009,54(1):1-9.
[3]Morrell NW,Adnot S,Archer SL,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coll Cardiol,2009,54(1):21-31.
[4]熊邁,姚尖平,徐穎琦,等.兩種大鼠肺動脈高壓模型肺血管重塑的血流力學、組織學和體視學指標變化[J].中華實驗外科雜志,2009,26(8):1043-1045.
[5]劉斌,彭軍.氧化應激和肺動脈高壓血管重構[J].中國動脈硬化雜志,2011,19(6):539-542.
[6]魏倩萍,鄧華聰.活性氧簇調控的信號通路與糖尿病腎病[J].重慶醫學,2005,34(3):446-448.
[7]韓玫瑰,韓子明,郭勇.水飛薊素對大鼠腎小管間質纖維化的影響及作用機制探討[J].細胞與分子免疫學雜志,2011,27(3):339-344.
[8]盧獻靈,何建國.肺動脈高壓的炎癥發病機制[J].中華結核和呼吸雜志,2009,32(11):862-865.
[9]董旭,王鋼,王懷良,等.蛋白激酶C亞型在慢性“炎癥性”肺動脈高壓大鼠肺動脈中的表達[J].解放軍醫學雜志,2007,32(6):558-560.
[10]丁晶,曾超美,杜軍保.氣體信號分子與肺動脈高壓的發病機制[J].實用兒科臨床雜志,2009,24(13):1026-1029.
[11]王占海,沈凌鴻,陳向東,等.水飛薊素對脂多糖性大鼠急性肺損傷的拮抗作用[J].中國病理生理雜志,2007,23(2):280-283.
[12]陳曉英,王玉林,王偉.核因子-κB抑制劑PDTC在肺動脈高壓中的作用[J].山東大學學報:醫學版,2008,47(1):55-63.
[13]陸俊羽,姚偉,錢桂生,等.Fas和FasL在Na/H交換器-1抑制誘導缺氧大鼠肺動脈平滑肌細胞凋亡中的作用[J].中國危重病急救醫學,2005,17(9):515-518.
[14]王蕾蕾,王國賢.水飛薊素對糖尿病大鼠心肌損傷的保護作用[J].中國動脈硬化雜志,2010,18(8):625-629.
[15]曾紅軍,龐玉生,梁秀安.基質金屬蛋白酶-1、9在小兒先天性心臟病肺血管重構中的作用[J].廣西醫學,2009,31(10):1409-1411.

