從軟錳礦中濕法浸出錳的研究進(jìn)展
謝紅艷,王吉坤,楊世誠(chéng),馬 進(jìn),李天杰,納吉信,彭 東
(1.昆明理工大學(xué)冶金與能源工程學(xué)院,云南昆明 650093;2.云南冶金集團(tuán)總公司,云南昆明 650031;3.云南建水錳礦有限責(zé)任公司,云南建水 654302)
0 前言
硫酸錳的工業(yè)生產(chǎn)在我國(guó)已有50多年的歷史。由于我國(guó)錳礦資源豐富,各地都根據(jù)其資源條件開(kāi)展了硫酸錳生產(chǎn)的各種工藝研究[1~3]與生產(chǎn)實(shí)踐。研究如何經(jīng)濟(jì)、合理地利用低品位軟錳礦,特別是解決其還原工藝這一瓶頸性的技術(shù)問(wèn)題,對(duì)緩解當(dāng)前我國(guó)錳礦資源緊缺的矛盾、確保錳系產(chǎn)品行業(yè)的可持續(xù)發(fā)展,以及西部地區(qū)經(jīng)濟(jì)的發(fā)展都具有十分重要的戰(zhàn)略意義[4]。本文在廣泛收集整理國(guó)內(nèi)外有關(guān)錳礦濕法浸出研究成果的基礎(chǔ)上,對(duì)錳礦濕法浸出過(guò)程及其工藝的研究進(jìn)展進(jìn)行綜述,并提出進(jìn)一步研究的方向。
1 國(guó)內(nèi)的研究進(jìn)展與現(xiàn)狀
1.1 兩礦一步法
我國(guó)研究工作者對(duì)兩礦一步法反應(yīng)過(guò)程的浸出機(jī)理、化學(xué)熱力學(xué)和動(dòng)力學(xué)特征、以及過(guò)程的各種影響因素和具體操作條件,都開(kāi)展了大量的試驗(yàn)研究工作,發(fā)表了許多研究報(bào)告。
2004年,賀周初等[5]介紹了兩礦法浸出低品位軟錳礦的原理及工藝條件,在一定的工藝條件下,以硫鐵礦作還原劑,用硫酸直接浸出Mn含量為25%左右的低品位軟錳礦,浸出率達(dá)93%,該工藝具有能耗少,成本低,實(shí)用性強(qiáng),錳回收率高等特點(diǎn),為低品位軟錳礦的利用開(kāi)辟了新的途徑。
對(duì)該酸浸反應(yīng),不少研究者作了很多探討,由反應(yīng)復(fù)雜,每個(gè)反應(yīng)都有其理論依據(jù)。根據(jù)文獻(xiàn)[6~7],歸納列出的反應(yīng)式如下:

袁明亮等[8~9]的研究指出,在該浸出過(guò)程中,浸出反應(yīng)初始條件不同,反應(yīng)機(jī)理及最終的產(chǎn)物均不同,在起始酸濃度較高的條件下,存在著黃鐵礦氧化產(chǎn)物為S0和SO2-4的競(jìng)爭(zhēng)反應(yīng),使得浸出所需黃鐵礦用量增加,同時(shí),產(chǎn)物S0粘附于礦石顆粒表面,由于S0的強(qiáng)疏水性和非導(dǎo)電性,阻礙了浸出反應(yīng)的進(jìn)一步進(jìn)行,這是兩礦法錳浸出率低的主要原因。
王長(zhǎng)興[10]認(rèn)為在浸出過(guò)程中,由FeS2和MnO2顆粒組成兩個(gè)原電池,如圖1。其中MnO2原電池反應(yīng)迅速,而FeS2的原電池由于生成的硫膜覆蓋在FeS2顆粒表面,溶解速度受阻變慢。
MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O FeS2+Fe3+=3Fe2++2S°

圖1 FeS2和MnO2顆粒組成兩個(gè)原電池
提高浸出溫度和加強(qiáng)攪拌,加速擴(kuò)散有利于反應(yīng)進(jìn)行。當(dāng)溶液的pH值接近3以后,Fe2+沉淀為Fe(OH)3或 Fe2O3·n H2O,催化作用即消失。
盧宗柳等[11]的研究指出:浸出反應(yīng)體系中Fe3+氧化能力的制約因素是Fe3+與Fe2+的濃度比值,比值愈高,則氧化能力愈強(qiáng)。采取在浸出料漿中返回浸渣洗液(含 Fe3+和 Fe2+)可縮短反應(yīng)時(shí)間。出現(xiàn)不同產(chǎn)地黃鐵礦用量配比差異的主要原因可能是由于元素之間的類質(zhì)同象、晶體結(jié)構(gòu)畸變以及選礦藥劑作用等因素造成的。
華毅超等[12]利用Fenton試劑的催化氧化作用對(duì)還原階段的后期進(jìn)行了相關(guān)的改進(jìn),Fenton試劑(Fe2++H2O2)能產(chǎn)生大量的羥基自由基,因而具有極強(qiáng)的氧化能力。由于硫鐵礦的投料相對(duì)于錳是過(guò)量的,因而在反應(yīng)后期,體系中有一定量 Fe2+存在。此時(shí)引入雙氧水(H2O2)則在體系中形成了 Fenton試劑。劇烈的氧化作用使反應(yīng)體系產(chǎn)生大量微泡而劇烈翻騰,強(qiáng)化了攪拌效果,并將礦粉顆粒進(jìn)一步破碎,促使被包藏的錳進(jìn)一步溶出。此外,H2O2也具有將四價(jià)錳還原為二價(jià)錳的作用,還可將過(guò)量的Fe2+氧化為 Fe3+,使浸取液中的鐵以 Fe3+的形式存在。這樣,當(dāng)加入碳酸鈣(CaCO3)中和過(guò)量硫酸時(shí),雜質(zhì)鐵形成Fe(OH)3而更易于沉淀除去。Fenton試劑的形成起到了一舉多得的效果。主要反應(yīng)方程式為:

據(jù)稱,由此可使軟錳礦中錳的利用率從現(xiàn)行工藝的83%提高至91%,新增產(chǎn)出大大高于所增加的原料投入。
2008年,陳蓉等[13]以鐵礦精選后的尾礦—硫精砂為還原劑,用硫酸直接浸出錳含量為15%左右的低品位錳礦,可得到較好技術(shù)指標(biāo)的硫酸錳產(chǎn)品,錳的浸出率在97%以上,錳回收率可達(dá)92.39%。實(shí)驗(yàn)得出當(dāng)錳礦粉、硫鐵礦和硫酸三者的質(zhì)量比為1∶0.2∶0.46,浸出時(shí)間為10 h時(shí),錳浸出效果較佳,且副產(chǎn)品酸性白土的產(chǎn)率為51%~72%。
兩礦一步法的優(yōu)點(diǎn)是省去了高溫焙燒工序,其還原、浸出和凈化可在同一反應(yīng)槽內(nèi)完成,減少了設(shè)備投資,黃鐵礦來(lái)源廣,價(jià)格低廉,生產(chǎn)成本低,操作過(guò)程亦簡(jiǎn)單易行,與焙燒法相比大大改善了操作環(huán)境,還降低了酸耗,因此兩礦一步浸出法在當(dāng)前已是我國(guó)低品位軟錳礦生產(chǎn)錳系產(chǎn)品過(guò)程中最通行的工藝路線。
兩礦一步法的缺點(diǎn)是還原率和浸出率較低,渣量大,影響了錳的回收率,尤其在生產(chǎn)電解金屬錳過(guò)程的工藝控制上,凈化過(guò)程較難掌握,特別要求軟錳礦和黃鐵礦的礦源成分穩(wěn)定,因此,兩礦一步法雖然在硫酸錳和普通級(jí)電解二氧化錳生產(chǎn)中得到了廣泛的應(yīng)用,但是在生產(chǎn)電解金屬錳的過(guò)程中,至今尚未得到普遍推廣使用。
1.2 SO2直接浸出法
張昭等[14]研究了用純SO2浸出軟錳礦(含錳量25%)的動(dòng)力學(xué),在系統(tǒng)研究了溫度、錳礦粒度、SO2流量、液固比和攪拌強(qiáng)度對(duì)錳浸出率影響的基礎(chǔ)上,導(dǎo)出了浸出過(guò)程的動(dòng)力學(xué)方程:
1-(1-a)1/3=2.80×10-3Q1.04SO2exp(-22 420/8.31 T)t實(shí)驗(yàn)結(jié)果表明:浸出過(guò)程為礦粒表面化學(xué)反應(yīng)所控制,浸出反應(yīng)可在常溫下進(jìn)行。同時(shí)也研究了雜質(zhì)鐵的行為,證實(shí)了二價(jià)鐵離子對(duì)錳浸出的催化作用。
有學(xué)者研究表明[15~16],在 SO2直接浸取軟錳礦過(guò)程中,連二硫酸錳的生成與所使用的浸取反應(yīng)條件有很密切的關(guān)系,在室溫下反應(yīng)所得浸出產(chǎn)物中有1/3是連二硫酸錳,而若在10℃以下生成物則全部是連二硫酸錳,而隨著溫度的升高,連二硫酸錳會(huì)發(fā)生分解反應(yīng):

總的說(shuō),與傳統(tǒng)的還原焙燒法相比,二氧化硫浸出工藝縮短了生產(chǎn)流程,節(jié)省能源消耗、設(shè)備投資和場(chǎng)地、避免了焙燒過(guò)程廢氣對(duì)環(huán)境的污染。生產(chǎn)成本亦有所降低,因而特別適用于低品位軟錳礦的有效利用[17],在這方面,尚需要長(zhǎng)期的生產(chǎn)實(shí)踐來(lái)加以驗(yàn)證。
1.3 連二硫酸鈣法浸出軟錳礦[18]
在浸出槽中將軟錳礦粉與連二硫酸鈣(CaS2O6)混合成礦漿,通入 SO2即生成硫酸錳和連二硫酸錳,所生成的硫酸錳再與連二硫酸鈣作用置換轉(zhuǎn)化為連二硫酸錳溶液和硫酸鈣沉淀:

過(guò)濾浸出液,碳酸鈣即與浸出渣一起被過(guò)濾分離出去。濾液中加入石灰乳,則生成Mn(OH)2沉淀:

再將其過(guò)濾,即得到固體Mn(OH)2產(chǎn)品,可作為錳精礦或用酸溶解后制備錳系產(chǎn)品。而濾液中含CaS2O6可循環(huán)使用。
1.4 硫酸亞鐵浸出法
綜合國(guó)內(nèi)發(fā)表的用硫酸亞鐵浸出軟錳礦的試驗(yàn)報(bào)告[19~22]可知其反應(yīng)條件大體為:反應(yīng)溫度70~95 ℃,初始硫酸濃度 180~210 g/L,液固比 3∶1~8∶1,在攪拌下反應(yīng)時(shí)間為2~3.5 h,二氧化錳浸出率可達(dá)95%以上。顯然,硫酸亞鐵浸出軟錳礦的浸出液中含鐵量較高,如果使用通行的Fe(OH)3中和沉淀法除鐵將產(chǎn)生大量的膠體沉淀,造成過(guò)濾困難和錳的吸附損失,因此宜在浸出的同時(shí)加入硫酸鈉,采用鐵礬沉淀法除去大部分的鐵[23],所生成的黃鈉鐵礬沉淀的沉降和過(guò)濾性能良好,而且鐵礬沉淀反應(yīng)為產(chǎn)酸反應(yīng),可有利于硫酸亞鐵浸出軟錳礦過(guò)程的繼續(xù)進(jìn)行。余下未除盡的鐵再以調(diào)節(jié)pH值生成Fe(OH)3沉淀的方法深度去除以達(dá)到工藝要求。
1.5 金屬鐵直接浸出法
朱道榮在研究硫酸亞鐵浸出軟錳礦的報(bào)告[19]中曾經(jīng)指出:“在此過(guò)程中添加定量的廢鐵屑,對(duì)錳的浸出率、液固分離、減少亞鐵用量都有好處,這方面的工作有待于進(jìn)一步研究”。
張東方等[24]報(bào)道了用鐵屑作還原劑,在酸性條件下浸出錳銀礦中的錳,浸出反應(yīng)條件為:當(dāng)鐵礦比1∶13,礦酸比 0.6∶1,液固比 3∶1,浸出時(shí)間 60 min,浸出溫度室溫,磨礦細(xì)度為小于0.074 mm占80%時(shí),錳浸出率達(dá)到97.60%,銀則留在浸出渣中,實(shí)現(xiàn)了錳銀分離。酸耗較大是該方法的主要缺點(diǎn)。
1.6 閃鋅礦(方鉛礦)催化還原法
唐尚文[25~26]介紹了在稀硫酸(或稀鹽酸)溶液中,用閃鋅礦(或方鉛礦)精礦作還原劑,用可溶性鐵鹽作催化劑,分解軟錳礦(或大洋錳結(jié)核礦),同時(shí)制取錳鹽和鋅鹽。該工藝具有反應(yīng)快速、徹底,工藝流程簡(jiǎn)單等特點(diǎn),同時(shí)省去了軟錳礦的還原焙燒和鋅(鉛)精礦的氧化焙燒,能夠大幅度提高錳、鋅(鉛)礦的浸出率,對(duì)原料礦的品級(jí)沒(méi)有嚴(yán)格要求。
1.7 農(nóng)林副產(chǎn)物直接浸出法
2008年,李同慶[4]將各種農(nóng)作物副產(chǎn)品作為軟錳礦還原劑的浸出試驗(yàn)綜合于表1中[27~37]。

表1 各種植物原料還原軟錳礦浸出試驗(yàn)
1.8 微生物浸取法
20世紀(jì)70~80年代我國(guó)在微生物浸取低品位錳礦方面曾經(jīng)進(jìn)行過(guò)不少的工作。近年來(lái),李浩然等[38]進(jìn)行了用氧化亞鐵硫桿菌加還原劑從大洋錳結(jié)核中浸出錳的研究,錳的浸出率接近100%。杜竹瑋等[39]還進(jìn)行了用嗜酸混合異養(yǎng)菌還原浸出廢電池粉末中的二氧化錳,浸出率達(dá)90%以上。
1.9 兩礦加濃硫酸熟化法
滕英才等[40]介紹了用硫鐵礦、錳礦加入濃硫酸熟化法生產(chǎn)硫酸錳,具有錳的收率高及節(jié)約原(燃)材料的特點(diǎn)。首先,將錳粉、硫鐵礦粉按1∶0.35先置入攪混機(jī)內(nèi),加入30%水調(diào)成漿狀,在不斷攪拌下逐漸加入98%濃硫酸,濃硫酸加入量為錳粉的55%左右。由于反應(yīng)熱和硫酸的稀釋熱作用,過(guò)程反應(yīng)十分激烈,實(shí)測(cè)溫度達(dá)140~160℃。待硫酸加完畢,再攪拌10~20 min,趁其還是漿狀排出,熟化,再放置較長(zhǎng)時(shí)間,使其反應(yīng)徹底進(jìn)行。
然后,將熟化后的物料,用第2次壓濾出的洗滌水按1∶2.5左右進(jìn)行浸取。開(kāi)始時(shí)浸出液的p H值已達(dá)2.5~3,通入蒸汽加熱到90℃左右,再用富錳渣粉(其主要成分為MnSiO3)調(diào)節(jié)p H值,用離心機(jī)分離出的母液調(diào)節(jié)漿液濃度,使?jié){狀溶液的濃度在42°Be,p H=4.8~5.2 后排出。
2 國(guó)外的研究進(jìn)展與現(xiàn)狀
2.1 兩礦加酸浸出法
將軟錳礦、黃鐵礦及硫酸按一定的配比,在一定的溫度下進(jìn)行反應(yīng),使得高價(jià)態(tài)錳被還原成低價(jià)態(tài)錳。Nayak等[41]的研究指出,在此過(guò)程中主要產(chǎn)生以下的氧化—還原反應(yīng):

Fe2+由硫鐵礦浸出產(chǎn)生,MnO2主要被Fe2+還原成可溶性的Mn2+,這樣兩個(gè)反應(yīng)循環(huán)往復(fù)的進(jìn)行,軟錳礦就被不斷地浸出,一般認(rèn)為總反應(yīng)式為:
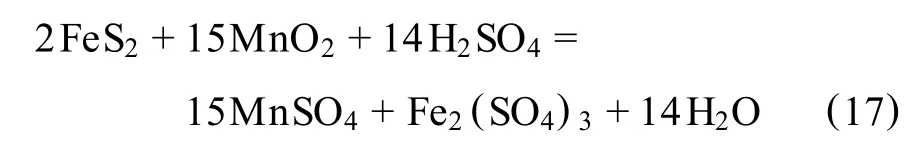
第1個(gè)反應(yīng)是快速反應(yīng),第2個(gè)反應(yīng)的速度較慢,是整個(gè)浸出反應(yīng)的控制步驟,因此維持 Fe2+離子的濃度遠(yuǎn)低于Fe3+離子濃度即可促進(jìn)MnO2的反應(yīng)速率。
2.2 SO2還原浸出法
Miller J D,Wan R Y[42]研究指出,用 SO2做還原劑直接浸出軟錳礦制備硫酸錳的試驗(yàn)原理是:

同時(shí)發(fā)生副反應(yīng):
MnO2+2H2SO3=MnS2O6+2H2O
MnS2O6的生成量隨攪拌速度增大而降低,隨pH值的減小而下降[43]。當(dāng)溫度升高,發(fā)生反應(yīng):

美國(guó)礦務(wù)局A.Back等[44]發(fā)表的研究報(bào)告表明,在 pH=0.75時(shí),僅有 3%的 SO2被氧化成S2O6-,而在pH=1.90時(shí),就有8%的SO2被氧化成S2O6-。
日本大阪市立大學(xué)Asai等人的研究[45]也同樣證實(shí)了提高酸度有利于抑制S2O-6的生成,浸取液的溫度越高、酸度越高和漿液攪拌強(qiáng)度越大,以及SO2不過(guò)量,則反應(yīng)生成的連二硫酸錳越少。
澳大利亞 HiTec公司2004年申請(qǐng)的專利聲稱[46],通過(guò)控制浸出液的電位、酸度、反應(yīng)溫度和反應(yīng)時(shí)間,可有效地抑制副反應(yīng)的進(jìn)行,使浸出液中MnS2O6的含量低于1~5 g/L,其主要工藝參數(shù)為:
1)浸出溫度95℃以上,浸出液pH值低于1.5。
2)浸出液中可溶性鐵以 Fe2(SO4)3的形式存在,其初始濃度大于4 g/L,亞鐵離子濃度保持在0.5 g/L以下。
3)在整個(gè)浸出過(guò)程中,監(jiān)控鐵離子與亞鐵離子的比例,確保氧化還原電位(ORP)大于或等于550 mV(相對(duì)Ag/AgCl參比電極)。
4)在浸出過(guò)程中通入SO2的時(shí)間不少于10 h,整個(gè)浸出時(shí)間為10~15 h。
5)浸出液中MnS2O6含量低于5 g/L或低于1 g/L。
HiTec進(jìn)一步研究采用溶劑萃取法凈化浸出液工藝,并于2005年申請(qǐng)了SO2直接浸取軟錳礦的第2個(gè)專利[47],在溶劑萃取法凈化浸出液的過(guò)程中,MnS2O6不會(huì)被有機(jī)溶劑萃取而留在水相之中,從而與被萃取到有機(jī)相的硫酸錳分離開(kāi)來(lái)[48]。因此,在不必考慮生成MnS2O6副反應(yīng)的情況下,SO2浸取軟錳礦過(guò)程的反應(yīng)條件發(fā)生了重大的變化,即:浸出液的pH從低于1.5改變?yōu)榭傻陀?或低于3;浸出溫度從95℃以上改變?yōu)榭傻陀?0℃;反應(yīng)時(shí)間從不少于10~15 h改變?yōu)榭稍? h以內(nèi)使其中95%以上的錳被浸出,從而大大放寬了浸出過(guò)程的反應(yīng)條件,即采用較低的溫度和酸度,容許生成少部分MnS2O6。
2.3 硫酸亞鐵浸出法
低品位軟錳礦與硫酸亞鐵之間可能產(chǎn)生以下3種反應(yīng)[49]:
1)在中性硫酸亞鐵溶液中:

2)在微酸性硫酸亞鐵溶液中:

3)在有過(guò)量酸存在的硫酸亞鐵溶液中:

鋼廠酸洗廢液和硫酸法鈦白粉生產(chǎn)均有大量的副產(chǎn)綠礬(FeSO4·7H2O),可在酸性溶液中浸出軟錳礦中作為還原劑,使軟錳礦中的四價(jià)錳還原成硫酸錳,用于生產(chǎn)硫酸錳或其他錳系產(chǎn)品。
2.4 鐵屑浸出法
最近國(guó)外的研究[50]表明:在酸性軟錳礦漿中,直接加入海綿鐵,能夠使軟錳礦中的四價(jià)錳迅速地還原成二價(jià)錳,比用硫酸亞鐵更加有效。其反應(yīng)條件為:物料(錳礦和海綿鐵)粒度:-250+150μm,H2SO4/MnO2摩爾比3,Fe/MnO2摩爾比0.8,室溫(20℃)下反應(yīng)10 min后錳浸出率即達(dá)到98%,反應(yīng)15 min后浸出率達(dá)到100%。若將反應(yīng)溫度從20℃提高到60℃,則反應(yīng)時(shí)間可從10 min減少到3 min,即可使軟錳礦完全被浸出。
而在與前列同樣條件下,若使用硫酸亞鐵作為還原劑,并且把 Fe/MnO2摩爾比提高到0.8,反應(yīng)10 min后錳浸出率僅為80%,反應(yīng)30 min后也僅93%,可見(jiàn)直接加金屬鐵現(xiàn)場(chǎng)形成的硫酸亞鐵對(duì)還原浸出的過(guò)程起了很有利的促進(jìn)作用。
實(shí)際上,鐵屑在酸性溶液中很快就與酸反應(yīng)生成硫酸亞鐵,起還原作用的還是硫酸亞鐵中的亞鐵離子,因此金屬鐵直接浸出法的機(jī)理是與硫酸亞鐵浸出法相同的,實(shí)際上是一種改良的硫酸亞鐵浸出法,這是由于初生態(tài)的亞鐵離子可能具有更強(qiáng)的還原能力。
2.5 煤炭直接還原法[51-52]
在酸性條件下,煤可與軟錳礦反應(yīng),使其中的MnO2還原成MnO而進(jìn)入溶液:
2MnO2+4H++C→CO2+2Mn2++2H2O(24)
ΔESHE=1 102 V,ΔG0=-394 kJ,由此可知 ,該反應(yīng)的熱力學(xué)的反應(yīng)推動(dòng)力較大,Hancock等研究了使用煙煤和褐煤在酸性溶液中分別浸出Amapa錳礦粉(含錳33.1%)、軟錳礦(估計(jì)含錳 63%)、深海錳結(jié)核(含錳33.9%)和化學(xué)二氧化錳(估計(jì)含錳63%)的過(guò)程,指出浸出還原反應(yīng)速率與溫度和酸度成正比,煤/礦比為2∶1,浸出液可用硫酸、鹽酸或腐殖酸,酸濃度為1~5 N,浸出液含固濃度100~300 g/L,在95℃以上進(jìn)行反應(yīng)約2~4 h,錳浸出率可達(dá)95%以上。試驗(yàn)表明:褐煤還原二氧化錳的能力大于煙煤,同等反應(yīng)條件下以上4種類含錳的物料中軟錳礦的浸出率相對(duì)較低,而鹽酸溶液中的浸出反應(yīng)速率和浸出率明顯大于硫酸溶液。
2.6 草酸直接浸出法
Sahoo[53]等報(bào)道了用草酸作為還原劑浸出印度Joda軟錳礦(含 24.7%Mn和 28.4%Fe,粒度為-150+105μm)的試驗(yàn),在85℃的含草酸30.6 g/L和硫酸濃度為0.534 M的溶液中可浸出錳礦粉中98.4%的錳,而只有8.7%的鐵被浸出。
在酸性介質(zhì)中草酸可與二氧化錳產(chǎn)生以下還原反應(yīng):

2.7 甲醇直接浸出法
F.Momade等[54]研究了在硫酸介質(zhì)中甲醇直接還原加鈉貧軟錳礦(含27.6%~32.0%Mn和8.6%~6.1%Fe)的浸出過(guò)程,其反應(yīng)式為:

試驗(yàn)結(jié)果表明:在160℃的高溫下,含硫酸0.3 M的40%(體積比)甲醇溶液與軟錳礦反應(yīng)2 h后,錳的浸出率可達(dá)98%。試驗(yàn)結(jié)果還指出,在此過(guò)程中甲醇濃度對(duì)錳礦中鐵的浸出率具有很大的影響,在120℃和0.16 M硫酸的反應(yīng)條件下,當(dāng)溶液中的甲醇濃度從0%增加到50%(體積比)時(shí),鐵的浸出率則從58%降低到3.5%,而在160℃和0.092 M硫酸和40%(體積比)甲醇的反應(yīng)條件下,鐵的浸出率僅有0.4%。
2.8 電解還原浸出法
Elsherief[55]研究了埃及低品位軟錳礦在硫酸溶液中的礦漿電解浸出過(guò)程,指出其反應(yīng):

當(dāng)有足夠的MnOOH聚集在MnO2表面時(shí),就產(chǎn)生進(jìn)一步的還原反應(yīng),在電解液中形成Mn2+:

酸度、溫度和所施加的電位對(duì)浸出率都有很大的影響,Fe2+和Mn2+的存在將大大增加反應(yīng)的速度,最佳的電解浸出反應(yīng)條件是在70℃的50 g/L硫酸溶液中,液固比為 1∶100,施加電位 0 m V(相對(duì)Hg/HgSO4/K2SO4參比電極),反應(yīng)45 min后錳即可被完全浸出,而鐵的浸出率僅56%。在此反應(yīng)條件下錳的浸出率要比未施加電位時(shí)的化學(xué)溶解過(guò)程高出5倍。
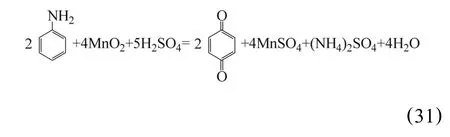
2.9 苯胺還原浸出法
劉建本等[56]報(bào)道了日本的赤羽工廠采用苯胺作還原劑直接浸出錳的生產(chǎn)技術(shù),其苯胺加入量較小,利用率高,浸出渣量少,因而過(guò)濾設(shè)備的面積也小。采用低溫浸出,浸出溫度控制在10~20℃,為了維持浸出溫度,浸出槽中設(shè)有蛇形管,通過(guò)循環(huán)冷卻水冷卻,既節(jié)約了能源,又保持了良好的作業(yè)環(huán)境。浸出反應(yīng)為:
2.10 苯醇還原浸出法
YAHU I ZHANG等[57]報(bào)道了以苯醇為還原劑,在硫酸氣氛下浸出錳,使四價(jià)錳還原為二價(jià)錳,苯醇被氧化為對(duì)苯醌。因此,在此浸出過(guò)程中發(fā)生的氧化還原反應(yīng)如下式所述:

2.11 葡萄糖還原浸出法
F.Pagnanelli等[58]介紹了用葡萄糖作還原劑,在硝酸環(huán)境下浸出低品位錳礦。所用錳礦中的錳以復(fù)雜氧化物Mn7O13(6MnO2·MnO)的形式存在,并伴隨有鋁硅酸鹽。本研究考察了溫度、粒度、葡萄糖和硝酸濃度對(duì)浸出結(jié)果的影響,并與以前的硫酸環(huán)境下的反應(yīng)進(jìn)行了對(duì)比。其最佳工藝條件為:溫度90℃,化學(xué)計(jì)量的硝酸濃度,20%以下化學(xué)計(jì)量的葡萄糖,顆粒大小為295~417μm。試劑的濃度是通過(guò)下式進(jìn)行化學(xué)計(jì)量的(礦中所有錳元素均認(rèn)為是四價(jià)錳):
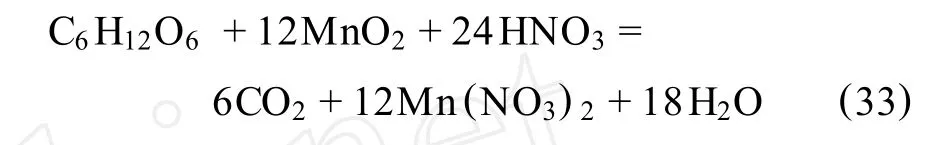
2.12 FeS2-MnO2-O2-H2O體系高溫加壓浸出法
Rajko.Z.V racar等[59]報(bào)道了在加壓釜內(nèi)高溫條件下,在 FeS2-MnO2-O2-H2O體系中浸出錳的研究。此文表述了:
1)在加壓釜內(nèi)高溫下,硫鐵礦在水溶液中被氧氣氧化的結(jié)果。
2)硫鐵礦氧化產(chǎn)物FeSO4和H2SO4與軟錳礦同時(shí)反應(yīng),并浸出軟錳礦中Mn4+的結(jié)果。
本文說(shuō)明了黃鐵礦氧化和錳的高效浸出兩個(gè)過(guò)程幾乎能夠順利完成。
浸出過(guò)程中可能發(fā)生的反應(yīng)如下:

總反應(yīng)式為:
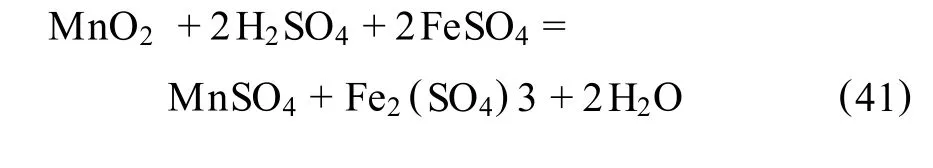
3 錳礦濕法浸出技術(shù)展望
軟錳礦濕法浸出過(guò)程及其工藝的研究歷經(jīng)多年發(fā)展取得了豐碩的成果,而且各種工藝已實(shí)現(xiàn)了工業(yè)應(yīng)用,但浸出過(guò)程機(jī)理的研究仍有待深入,尤其在礦物表面分子或原子級(jí)水平研究方面非常欠缺。而且,在清潔高效、技術(shù)合理、經(jīng)濟(jì)可行的適合處理復(fù)雜低品位錳礦的新工藝研究及其工業(yè)應(yīng)用方面還有較長(zhǎng)的一段路要走。今后應(yīng)在以下幾方面繼續(xù)開(kāi)展研究:
1)研究其他礦物成份(如黃鐵礦、磁黃鐵礦、黃銅礦、方鉛礦等)對(duì)軟錳礦浸出的影響,這對(duì)于處理復(fù)雜礦,實(shí)現(xiàn)選擇性浸出具有指導(dǎo)意義;
2)加強(qiáng)礦物浸出過(guò)程的電化學(xué)研究,采用電化學(xué)與表面分析[60](如:STM/ETS,AFM,XPS,AES/SAM,SIMS,SAL I,RBS,RNR,SEM,TEM,LEED等)相結(jié)合的方法,研究浸出過(guò)程中錳礦的表面性質(zhì),進(jìn)一步明晰浸出過(guò)程機(jī)理;
3)研究新型高效添加劑(如煤等)脫除元素硫的作用及其機(jī)理;
4)加強(qiáng)鐵浸出控制及鐵渣處理的研究,開(kāi)發(fā)出適用于復(fù)雜錳礦的節(jié)能、高效、清潔的浸出新工藝;
5)探索加壓浸出復(fù)雜錳礦的工藝過(guò)程及機(jī)理。
[1]譚立群.硫酸錳廠新工藝的設(shè)計(jì)[J].中國(guó)錳業(yè),2000,18(4):33-35.
[2]楊新科.制備硫酸錳最佳工藝條件的研究[J].中國(guó)錳業(yè),2001,19(3):15-16.
[3]周凌風(fēng).冷法浸出硫酸錳溶液[J].中國(guó)錳業(yè),2002,20(4):20-22.
[4]李同慶.低品位軟錳礦還原工藝技術(shù)與研究進(jìn)展[J].中國(guó)錳業(yè) ,2008,26(2) :4-26.
[5]賀周初,彭愛(ài)國(guó),鄭賢福,等.兩礦法浸出低品位軟錳礦的工藝研究[J].中國(guó)錳業(yè),2004,22(2):35-37.
[6]丁楷如,余遜賢,等.錳礦開(kāi)發(fā)與加工技術(shù)[M].長(zhǎng)沙:湖南科學(xué)技術(shù)出版社,1991.
[7]田宗平,朱介忠,王雄英,等.兩礦加酸法生產(chǎn)硫酸錳的工藝研究與應(yīng)用[J].中國(guó)錳業(yè),2005,23(4):4-26.
[8]袁明亮,梅賢功,陳工,等.兩礦法浸出軟錳礦的工藝與理論[J].中南工業(yè)大學(xué)報(bào),1997,28(4):329-332.
[9]袁明亮,梅賢功,邱冠周,等.兩礦法浸出軟錳礦時(shí)元素硫的生成及其對(duì)浸出過(guò)程的影響[J].化工冶金,1998,19(19):161-164.
[10]王長(zhǎng)興.軟錳礦直接酸浸法生產(chǎn)硫酸錳的工藝探討[J].湖南有色金屬,1997,13(1):45-48.
[11]盧宗柳,都安治.兩礦法浸出氧化錳礦的幾個(gè)工藝問(wèn)題[J].中國(guó)錳業(yè),2006,24(1):39-42.
[12]華毅超,陳國(guó)松,張紅漫,等.工業(yè)硫酸錳濕法還原生產(chǎn)工藝[J].南京工業(yè)大學(xué)學(xué)報(bào),2004,26(5):50-53.
[13]陳蓉,陳啟明,陳金芳,等.低品位錳礦制備硫酸錳的研究[J].武漢工程大學(xué)學(xué)報(bào),2008,30(1):20-22.
[14]張昭,劉立泉,彭少方.二氧化硫浸出軟錳礦[J].化工冶金,2000,21(1):103-107.
[15]歐陽(yáng)昌倫,謝蘭香.錳礦濕法脫硫過(guò)程中影響連二硫酸錳生成的主要因素[J].化工技術(shù)與開(kāi)發(fā),1983,3:60-66.
[16]劉啟達(dá).高效實(shí)用的軟錳礦漿脫硫新技術(shù)和流程[J].廣東化工 ,1998,(2) :19-20.
[17]王強(qiáng),詹海青,何建新,等.軟錳礦漿煙氣脫硫技術(shù)的研究與應(yīng)用[J].中國(guó)錳業(yè),2007,25(4):19-23.
[18]余遜賢.錳[Z].長(zhǎng)沙:冶金工業(yè)部長(zhǎng)沙黑色冶金礦山設(shè)計(jì)院,1980.
[19]朱道榮.軟錳礦-硫酸亞鐵的酸性浸出[J].中國(guó)錳業(yè),1992,10(1):30-31.
[20]袁明亮,莊劍鳴,陳藎.用硫酸亞鐵渣直接浸出低品位軟錳礦[J].礦產(chǎn)綜合利用,1994,(6):6-9.
[21]王德全,宋慶雙.用硫酸亞鐵浸出低品位錳礦[J].東北大學(xué)學(xué)報(bào)(自然科學(xué)版),1996,17(6):606-609.
[22]彭榮華,李曉湘.用鈦白副產(chǎn)的硫酸亞鐵浸錳制備高純二氧化錳[J].無(wú)機(jī)鹽工業(yè),2006,38(12):48-50.
[23]王德全,宋慶雙,彭瑞東.用硫酸亞鐵浸出同時(shí)沉淀鐵礬法處理低品位錳礦[J].東北大學(xué)學(xué)報(bào)(自然科學(xué)版),1998,19(2):168-170.
[24]張東方,田學(xué)達(dá),歐陽(yáng)國(guó)強(qiáng),等.銀錳礦中錳礦物的鐵屑還原浸出工藝研究[J].中國(guó)錳業(yè),2007,25(1):24-26.
[25]唐尚文.用閃鋅礦(方鉛礦)精礦催化還原軟錳礦(大洋錳結(jié)核礦)制取硫酸錳[J].無(wú)機(jī)鹽工業(yè),2005,37(6):46-49.
[26]唐尚文.氧化錳礦和硫化鋅/硫化鉛精礦在稀酸中直接,同時(shí)浸出的方法[P].CN,1465723A.2004-01-07.
[27]楊幼平,黃可龍.植物粉料一硫酸法直接浸出軟錳礦的實(shí)踐[J].中國(guó)礦業(yè),2001,10(5):54-56.
[28]鄧益強(qiáng),樂(lè)志文.軟錳礦無(wú)煤還原制備硫酸錳新工藝研究[J].廣西輕工業(yè),2007,(10):38-40.
[29]曹柏林,黃斌.用貧軟錳礦制備硫酸錳[J].湖南有色金屬,2000,16(3):18-19.
[30]張小云,田學(xué)達(dá).纖維素還原低含量軟錳礦制備硫酸錳[J].精細(xì)化工,2006,23(2):195-197.
[31]劉西德,姜立夫,高燦柱,等.從廢錳渣制取硫酸錳的研究[J].山東化工,1994,(2):13-15.
[32]楊明平,宋和付.酒糟一硫酸浸取錳礦尾礦中錳制備硫酸錳工藝[J].無(wú)機(jī)鹽工業(yè),2006,38(11):50-52.
[33]楊明平,宋和付,李國(guó)斌.米糠一硫酸直接浸錳工藝條件研究[J].無(wú)機(jī)鹽工業(yè),2005,37(2):30-32.
[34]D.Hariprasad,B.Dash,M.K.Ghosh,etal.Leaching of Manganese Ores using Saw dust as a Reductant[J].M inerals Engineering,2007,20(1):293-295.
[35]趙崇濤.氧化錳礦直接制備硫酸錳的研究Ⅱ-蔗渣法[J].福建師范大學(xué)學(xué)報(bào)(自然科學(xué)版),1993,9(2):54-58.
[36]S.J.M cCarroll.Treatment of Manganese Ores[P].US:3,085,875,1963.
[37]粟海鋒,孫英云,文衍宣,等.廢糖蜜還原浸出低品位軟錳礦[J].過(guò)程工程學(xué)報(bào),2007,7(6):89-93.
[38]李浩然,馮雅麗.微生物催化還原浸出氧化錳礦中錳的研究[J].有色金屬,2001,(8):5-81.
[39]杜竹瑋,李浩然.微生物還原浸出法回收廢舊電池粉末中的金屬錳[J].環(huán)境污染治理技術(shù)與設(shè)備,2005,(9):62-64.
[40]滕英才,馬集成.兩礦加濃硫酸熟化法生產(chǎn)硫酸錳[J].化工技術(shù)與開(kāi)發(fā),2006,35(2):1-2.
[41]B.B.Nayak,K.G.Mishra,R.K.Paramguru.Kinetics and Mechanism of MnO2Dissolution in H2SO4[J].Journal of Applied Electrochemistry,1999,29:191-200.
[42]Miller J D,Wan R Y.Reaction Kinetics for the leaching of MnO2by Sulfur Dioxide[J].Hydrometallurgy,1983,10:219-242.
[43]Asai S,Negi H,Konishi Y.Reductive Dissolution of Manganese Dioxide in Aqueous Sulfur Dioxide Solutions[J].The Canadian Journal of Chem.Eng,1986,64:237-241.
[44]A.E.Back,S.F.Ravitz,K.E.Tame.Formation of Dithionate and Sulfate in the Oxidation of Sulfur Dioxide by Manganese Dioxide and Air[J].U.S.Bureau of Mines,1952,Report Investigation 4 931.
[45]S.Asai.H.Negi,Y.Konish,Reductive Dissolution of Manganese Dioxide in Aqueous Sulfer Dioxide Solutions[J].The Canadian J.of Chem.Eng,64(4):237-242.
[46]C.Ward.Hydrometallurgical Processing of Manganese Containing Materials[P].WO:033738,2004.
[47]C.Ward.Imp roved Hydrometallurgical Processing of Manganese Containing Materials[P].WO:012582,2005.
[48]C.Ward,C.Y.Cheng,M.D.Urbani.Manganese-From Waste to High-tech Material[C].Green Processing Conference,Fremantle,WA,10-12May,2004.
[49]S.C.Das,P.K.Sahoo,P.K.Rao.Extraction of Manganese Ores by FeSO4Leaching[J].Hydrometallurgy,1992,15:35-47.
[50]Bafghi,A,Zakeri,Z1Ghasemi,etal.Reductive Dissolution of Manganese Ore in Sulfuric Acid in the Presence of Iron Metal[J].Hydro metallurgy,2008,90:207-212.
[51]Hancock,H A,Fray,D J.Use of Coal and Lignite to Dissolve Manganese Dioxide in Acidic Solutions[J].Transaction of Institution of mining and Metallurgy,Section C,1986,95:27-34.
[52]Fray,D J,Hancock,H A.Obtaining Aqueous Solutions from Insoluble Metal Oxide[P].GB:2,161,465,1986.
[53]R.N.Sahoo,P.K.Naik,S.C.Das.Leaching of Manganese from Low-Grade Manganese Ore using Oxalic Acid as Reductant in Sulphuric Acid Solution[J].Hydrometallurgy,2001,62:157-163.
[54]F.Momade,Z.Momade.Reductive Leaching of Manganese Oxide Ore in Aqueous Methanol-Sulphuric Acid Medium[J].Hydrometallurgy,1999,51:103-113.
[55]Elsherief A.E.A Study of the Electroleaching of Manganese Ore[J].Hydro metallurgy,2000,55:311-326.
[56]劉建本,陳上,魯廣.硫酸錳的生產(chǎn)技術(shù)及發(fā)展方向[J].無(wú)機(jī)鹽工業(yè),2005,37(9):5-7.
[57]Yahui Zhang,Qi Liu and Chuanyao Sun.Sulfuric Acid Leaching of Ocean Manganese Nodules Using Phenols as Reducing Agents[J].Minerals Engineering,2001,14(5):525-537.
[58]F.Pagnanelli,G.Furlani,P.Valentini,F.Veglio,L.Toro.Leaching of low-grade manganese ores by using nitric acid and glucose:optimization of the operating conditions[J].Hydro metallurgy,2004,75:157-167.
[59]Rajko.Z.V racar,Katarina P.Cerovic.Manganese leaching in the FeS2-MnO2-O2-H2O system at high temperature in an autoclave[J].Hydro metallurgy,2000,55:79-92.
[60]Vaughan D J,Pattrick R A D.Mineral Surfaces[M].London,UK:Champman&Hall,1995 :17-60.

