基于Au/Rh-HNP復合納米材料的CEA免疫傳感技術的構建及驗證*
陳 亞,孟凡飛,劉 飛
(陸軍軍醫大學第二附屬醫院:1.藥理基地;2.檢驗科,重慶 400037)
新型納米材料應用在生物傳感器中能夠增強電子傳導和響應界面,可顯著放大信號,同時還可作為載體起到支撐和吸附的作用[1-3]。癌胚抗原(carcinoembryonic antigen,CEA)是目前最常用的腫瘤標志物之一,作為診斷腸癌及評價其預后的重要指標,在腺癌及大細胞癌患者中升高明顯[4-5]。本研究以自制金銠空心納米球(gold-rhodium hollow nanospheres,Au/Rh-HNP)為信號放大催化劑,構建新型納米材料免疫傳感器,研制腫瘤標志物CEA檢測的新技術,為CEA檢測提供可選方案。
1 材料與方法
1.1 材料與儀器
CEA一抗、CEA二抗、CEA標準品均購自鄭州博賽生物技術股份有限公司,牛血清白蛋白(bovine serum albumin,BSA)、人血清白蛋白(human serum albumin,HAS)、聚乙烯吡咯烷酮(poly-vinyl pyrrolidone,PVP)購自美國Sigma公司,氧化鋁(Al2O3)粉末、1%氯金酸(HAucl4)溶液、氯化銠(RhCl3)、鐵氰化鉀、硫堇(Thi)購自美國Sigma-Aldrich公司,Au/Rh-HNP為實驗室自制。 Z36HK低溫高速離心機購自德國Hermil有限公司,Chi650d電化學工作站購自上海辰華儀器有限公司,玻碳電極(glass carbon electrode,GCE)購自天津艾達恒晟科技發展有限公司,S-4800電子掃描電鏡購自日本日立公司。
1.2 方法
1.2.1構建原理
傳感器構建過程見圖1。首先在麂皮上對直徑為4 mm GCE依次用0.3 μm和50 nm Al2O3顆粒反復打磨,拋光電極表面;隨后在雙蒸水(ddH2O)、無水乙醇中超聲1 min。裸電極拋光表面沉積納米金,簡要過程如下:將拋光電極放入100 μmol/L HAuCl4溶液中,采用循環伏安(cyclic voltammetry,CV)法,設置靜息電位上下電位均為-0.2 V,電沉積30~45 s沉積納米金顆粒,從而在電極表面固化形成納米金顆粒層。在ddH2O中晃洗干凈電極,吸干水滴;在電極表面滴加20 μL CEA一抗(濃度1 μmol/L),4 ℃孵育過夜或者室溫3 h固定CEA一抗。在ddH2O中晃洗干凈電極,吸干水滴;在電極表面滴加15 μL CEA抗原,室溫孵育1 h。在ddH2O中晃洗干凈電極,吸干水滴;加入20 μL CEA二抗(濃度1 μmol/L),室溫孵育3 h。在ddH2O中晃洗干凈電極備用。

圖1 Au/Rh-HNP CEA傳感器的構建原理
1.2.2制備Au/Rh-HNP
參照文獻[6]自制Au/Rh-HNP,將六水合氯化鈷(CoCl2·6H2O,10 mg)和PVP(40 000 Mw,60 mg)溶解在50 mL ddH2O(18.2 M)中,超聲10 min,并用氮氣(N2)吹掃10 min。然后,將1.0 mL 1% RhCl3和0.2 mL 1% HAuCl4溶液合并在單獨的燒瓶中。然后攪拌,逐滴添加新制備的硼氫化鈉(NaBH4)溶液(5 mg溶于10 mL H2O中)。添加所有NaBH4后,將所得混合物逐滴添加到CoCl2/PVP混合物中,攪拌20 min。最后,通過離心法收集沉積物,并用H2O和乙醇沖洗數次。將沉淀物重新懸浮在2 mL H2O中,并在4 ℃條件下儲存備用。
1.2.3制備CEA二抗Au/Rh-HNP復合物
將酶標液、保護劑加入燒杯,攪拌;再加入100 μL硫堇,攪拌,離心,洗滌3次,加入ddH2O。再加入600 μL Au/Rh-HNP,加入CEA二抗,低溫攪拌,再加入過氧化物酶,攪拌。
1.2.4制備CEA一抗復合物電極
將備好的裸電極置于1% HAuCl4溶液中,CV法沉積15 s,再置于鐵氰化鉀溶液中。CEA一抗材料溶液加到修飾后的電極上,放置8 h。置于鐵氰化鉀溶液中,CV法及電化學阻抗譜(electrochemical impedance spectroscopy,EIS)法對加抗體修飾后的GCE進行表征,加 BSA于電極上封閉未與抗體結合的鍍金表面,置于鐵氰化鉀溶液中。
1.2.5CEA抗原的檢測
將CEA標準品分別制成20.0、5.0、1.0、0.5、0.1 mg/dL 5個濃度,加于復合電極上,于37 ℃靜置15 min,然后加入CEA抗體Au/Rh-HNP復合物,洗滌,再加入3%過氧化氫(H2O2),檢測電極電信號的變化。
1.2.6特異性實驗
按CEA抗原檢測方法,被檢物中0.5 mg/dL HSA、0.5 mg/dL BSA作為干擾物。
1.2.7電化學檢測方法
電化學檢測在包含三電極的常規電化學池中進行,分別采用了CV、EIS和差分脈沖伏安法(differential pulse voltammetry,DPV)進行檢測。 CV法和EIS法在含有0.1 mol氯化鉀(KCl)的5 mmol [Fe(CN)6]3-/4-溶液中進行;DPV在2 mL 0.1 mol磷酸鹽緩沖液(PBS,pH 7.4)中進行,加入適量H2O2作為催化底物,電壓為-0.6~0 V,掃描速率為50 mV/s。
1.3 統計學處理
2 結 果
2.1 制備的Au/Rh-HNP表征
該金銠納米材料均呈圓球形,具有中間亮度較低、四周亮度較高的典型空心結構。Au/Rh-HNP分布較均勻,直徑范圍為80~200 nm,見圖2。

A:bar=2.00 μm;B:bar=200 nm。
2.2 修飾電極的CV法表征
a1曲線氧化峰電流>120 μA、氧化峰還原峰電流差值<0.12 V;a2較a1電流增大;a3固化一抗后電阻增大;a4在相同電壓下較各自對應電極曲線a3電流減小;a5捕獲二抗后電阻繼續增加,電子的傳導能力最小,見圖3。

a1~a5分別表示電極裸電極、表面沉積金后、固化一抗、捕獲CEA抗原后、加入Au/Rh-HNP捕獲二抗后的CV法表征。
圖3 CEA免疫傳感修飾過程CV法表征圖
2.3 修飾電極的EIS法表征
b1電阻<200 Ω;b2較b1電阻減小;b3捕獲CEA抗原對應電極曲線b2電阻增大;b4較b3電阻增大;曲線b5表示捕獲二抗后(未加H2O2)電阻是最大的,見圖4。
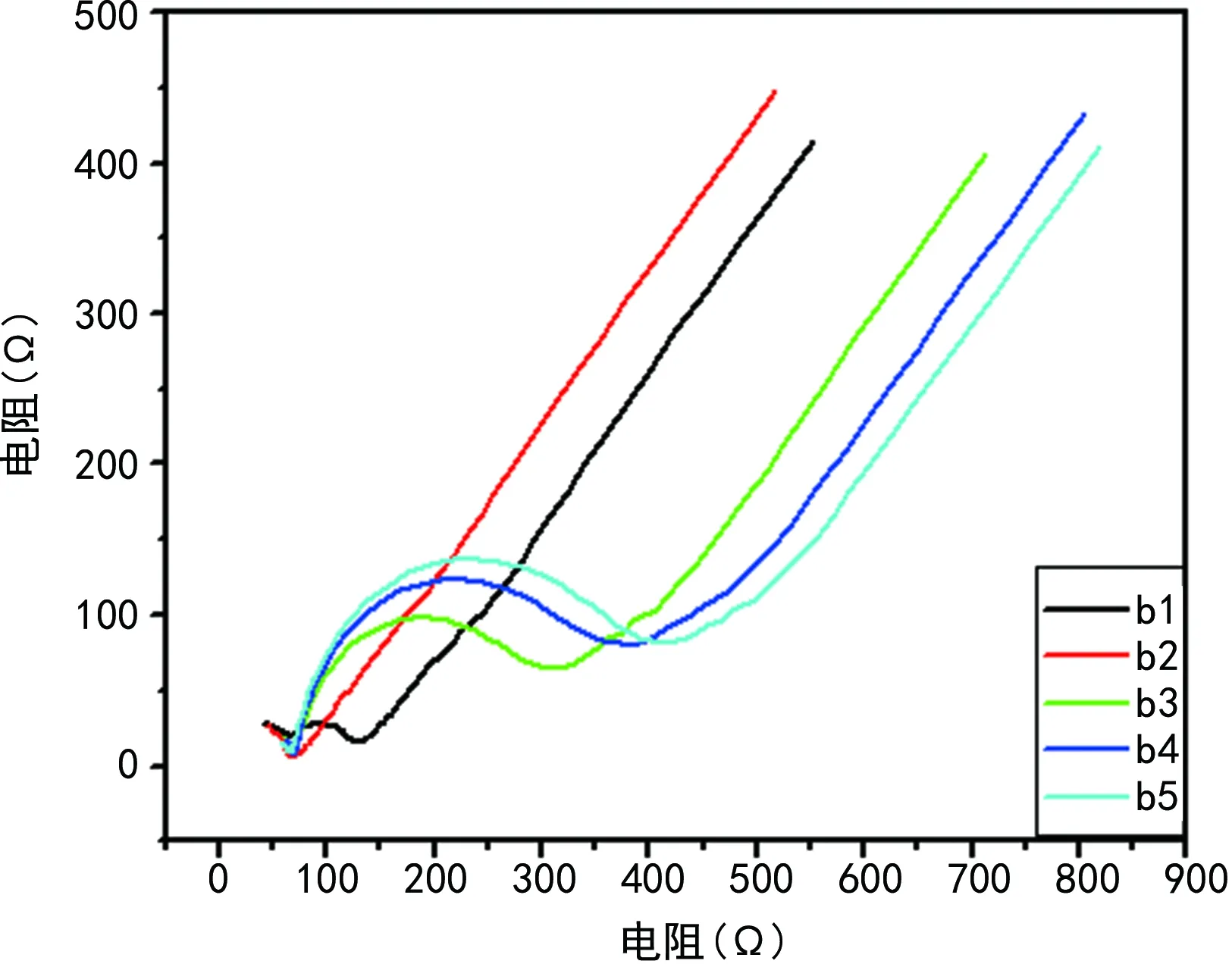
b1~b5分別表示電極裸電極、表面沉積金后、固化一抗、捕獲CEA抗原后、加入Au/Rh-HNP捕獲二抗后的EIS法表征。
2.4 催化劑體積與電極電流的影響
在相同電壓下電流增大,催化前與催化后形成鮮明的對比;當20、25、30 μL時電流沒有明顯變化,見圖5。
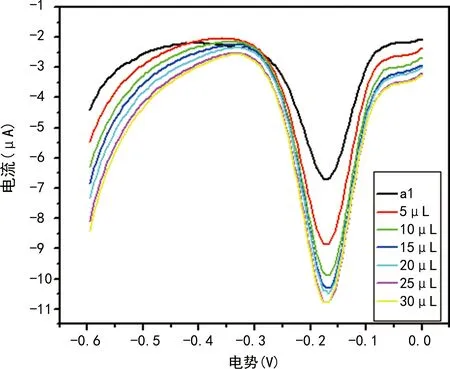
曲線a1表示未催化時,其他曲線分別表示依次加入3% H2O2 5、10、15、20、25、30 μL條件下的電流變化。
2.5 CEA檢測結果
檢測范圍為0.1~20 mg/dL,回歸方程為:Y=0.008 7X+0.019,見圖6。
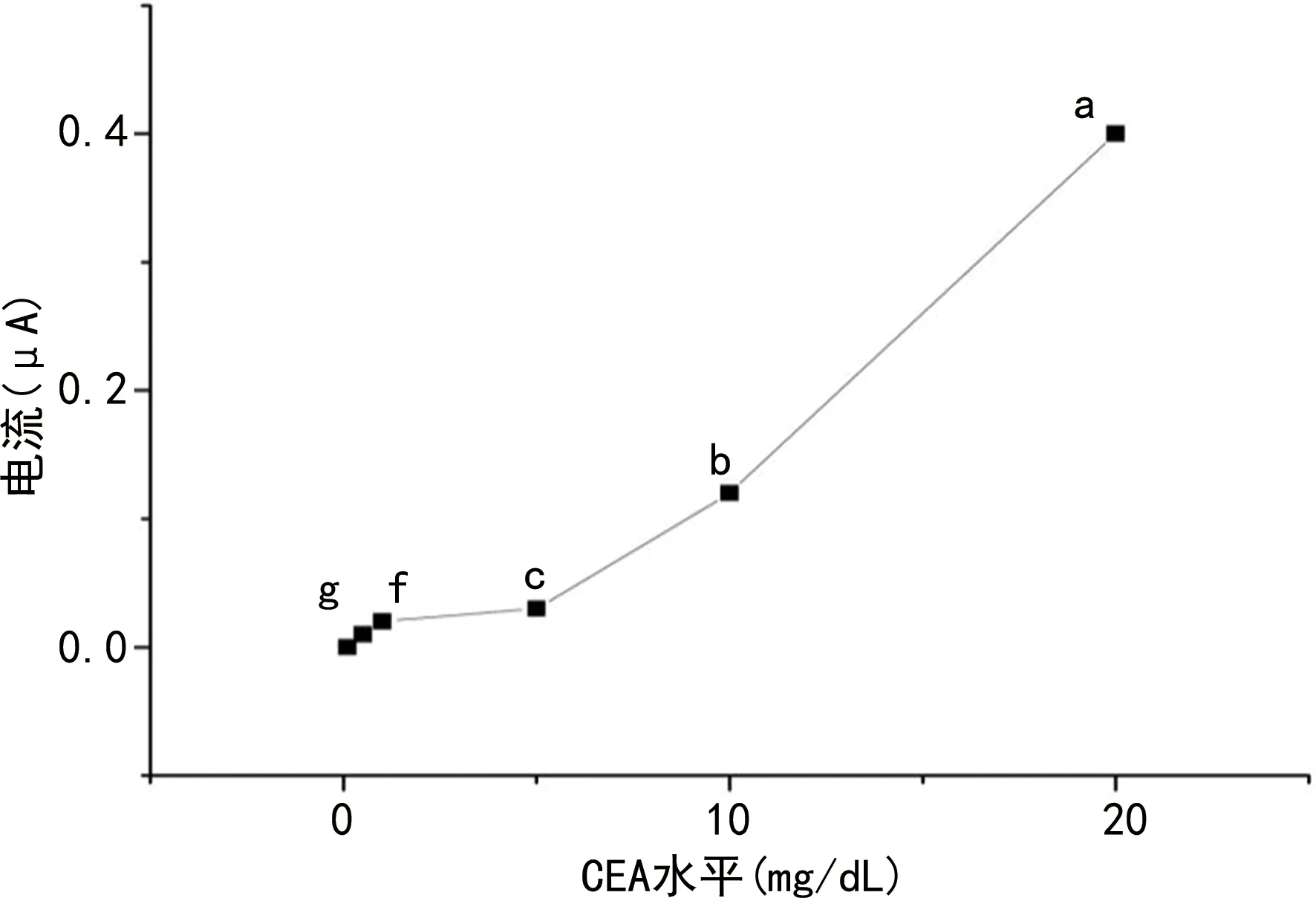
a、b、c、f、g分別檢測為20.0、5.0、1.0、0.5、0.1 mg/dL。
2.6 特異性實驗
AFP和BSA加入后能檢測到的電流很小,而CEA抗原檢測的電流變化明顯,見圖7。
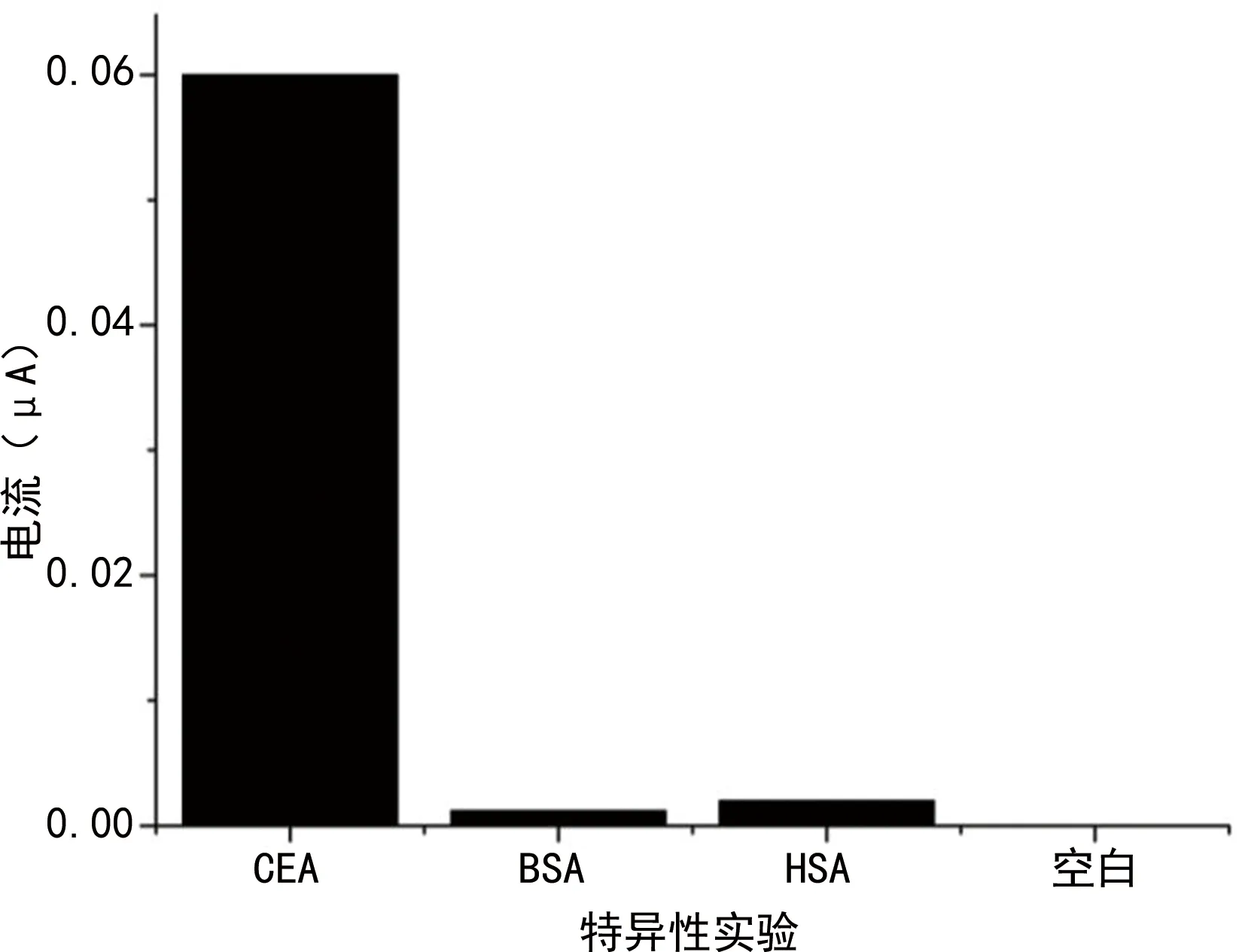
圖7 檢測特異性實驗
3 討 論
CEA是臨床上使用最廣泛的腫瘤標志物之一[7],與眾多腫瘤的發生、發展密切相關,主要功能是在腫瘤細胞和基質膠原間起黏附作用,在腫瘤的生長和轉移過程中扮演重要的角色[8]。健康人血清中CEA水平很低,但在不同癌癥中如乳腺癌、結直腸癌和肺癌中可以觀察到CEA水平不同程度的升高[9-10]。另外,術前和術后定期檢查CEA水平為預測腫瘤所處階段、進展和復發提供了有用的信息[11]。CEA的檢測方法較多,常用的檢測方法如酶聯免疫吸附試驗(ELISA),操作步驟多,干擾因素也較多,通常由于光學背景過高而靈敏度不夠;放射免疫法(RIA)由于使用放射性元素對檢測人員和環境有危害;化學發光法準確度較高,但檢測時間較長,成本較高。因此,這些方法都存在一定缺陷,開發更加靈敏、特異的CEA檢測方法對于腫瘤的早期診斷和篩查具有重要的意義。
以金和銠為材料,制備相應納米顆粒用于檢測不同生物標志物已有較多報道,自制的Au/Rh-HNP無色、呈圓球形,是一種中間亮度較低、四周亮度較高的典型空心結構,這種結構可極大地擴大微球的表面積,可結合更多的信號分子,由于金與蛋白分子間有很強的親和力[12],因此標記和固化蛋白分子很容易實現。本研究自制的Au/Rh-HNP分布均勻,直徑范圍為80~200 nm,不易聚合沉淀,因此它可能成為有潛力的蛋白分子標記載體,從而構建更方便的檢測方法[13-14]。從實驗結果看,CV法表征a1曲線氧化峰電流>120 μA、氧化峰還原峰電流差值<0.12 V,表明電極達到拋光要求;a2較a1電流增大,是由于電極表面沉積金后導電能力增強,電子的傳遞速度加快;a3固化一抗后電阻增大,電子的傳導能力較沉積金及裸電極時減小,因此在相同電壓下較各自對應電極曲線a2電流減小,同時也小于a1的電流;a4由于捕獲抗原后電阻較前增大,電子的傳導能力較前裸電極、表面沉積金及固化一抗時減小,因此在相同電壓下較各自對應電極曲線a3電流減小;a5捕獲CEA抗原后電阻繼續增加,電子的傳導能力最小,表明電極各步的修飾是成功的。EIS法表征b1電阻<200 Ω,表明達到拋光要求;b2較b1電阻減小,表明已沉積上金層;b3捕獲CEA抗原對應電極曲線b2電阻增大,表明已固化了一抗;b4較b3電阻增大;曲線b5表示捕獲二抗后(未加H2O2)電阻是最大的,表明電極各步修飾是成功的。由于Au/Rh-HNP具有催化H2O2的功能,在整個催化過程中電子轉移到硫堇上,因而在相同電壓下電流增大,催化前與催化后形成鮮明的對比,說明抗原抗體已經牢固地結合。
在CEA電極檢測中,該免疫傳感器檢測CEA的靈敏度已達到0.1 mg/dL,檢測范圍為0.1~20.0 mg/dL,表明該傳感器對不同水平的CEA溶液有良好的響應,與CEA水平間有良好的線性關系。為驗證實傳感器的特異性,選擇5 mg/dL AFP、5 mg/dL BSA作為干擾物,從結果可以看出,AFP和BSA加入后能檢測到的電流信號很弱,而同水平CEA抗原檢測的電流信號變化明顯,表明CEA抗體的結合是特異性結合。
生物傳感器用于生物標志物的檢測具有廣泛的應用前景[15],傳感器與不同的生物材料或不同的生物標志物結合,可以構建多種不同的檢測器。本研究自制的Au/Rh-HNP具有良好的生物兼容性和吸附力,可有效放大檢測信號,同時該納米顆粒還具有H2O2的催化特性,因此具備建立不同檢測方法和檢測不同生物標志物的潛力。本研究利用該納米顆粒與金電極結合建立了基于抗體-抗原-抗體夾心法快速、簡便、定量檢測CEA的方法,并獲得了初步的成功,為進一步開發利用這種新型納米材料奠定了基礎。但本實驗仍存在一定不足之處:沒有用臨床真實標本對實驗方案進行驗證,其靈敏度還有待提高,其他干擾性疾病標志物的檢測并沒有完全囊括在本實驗中。

