含磷酸結合口袋的BRCT結構域功能位點預測
盛自章, 黃京飛
( 1. 中國科學院昆明動物研究所 遺傳資源與進化國家重點實驗室, 云南 昆明 650223; 2. 中國科學院研究生院, 北京 100049; 3. 中國科學院昆明動物研究所和香港中文大學生物多樣性和人類疾病模型聯合研究中心, 云南 昆明 650223)
含磷酸結合口袋的BRCT結構域功能位點預測
盛自章1,2, 黃京飛1,3,*
( 1. 中國科學院昆明動物研究所 遺傳資源與進化國家重點實驗室, 云南 昆明 650223; 2. 中國科學院研究生院, 北京 100049; 3. 中國科學院昆明動物研究所和香港中文大學生物多樣性和人類疾病模型聯合研究中心, 云南 昆明 650223)
BRCT( BRCA1 C-terminus)是真核生物DNA損傷修復系統重要的信號傳導和蛋白靶向結構域。為了探討含磷酸結合口袋的BRCT與磷酸化配體結合的機制, 對XRCC1 BRCT1、PTIP BRCT4、ECT2 BRCT1和 TopBP1 BRCT1進行了結構保守性和表面靜電勢分析。結果顯示, 4個BRCT的磷酸結合口袋周圍所存在的結構保守并帶正電勢的溝槽很可能是其功能位點, 并且類似的溝槽在含磷酸結合口袋的BRCT中普遍存在。溝槽兩側及底部均帶有極性氨基酸殘基, 兩側帶正電荷, 而底部疏水。這說明溝槽與配體的結合以靜電和疏水相互作用為主。溝槽主要位于單個BRCT中,而且4個BRCT的溝槽在形狀和電荷分布上都不同, 說確明BRCT配體特異性主要由單個BRCT決定。磷酸結合口袋位于溝槽中心, 說明溝槽可能同時結合磷酸化殘基的N端和C端附近殘基。
BRCT結構域;磷酸結合口袋;DNA損傷修復;表面靜電勢
BRCT(BRCA1 C-terminus)結構域最早發現于乳腺癌相關蛋白 BRCA1中, 后來發現它還廣泛存在于真核生物的DNA損傷修復蛋白中(Bork et al, 1997)。BRCT結構域能夠識別被DNA損傷探測蛋白如 ATM (ataxia telangiectasia mutated protein)或ATR(ATM-Rad3-related kinase)磷酸化修飾的蛋白,并將DNA損傷的信號傳導給下游分子; 也可以通過與非磷酸化的蛋白相互作用將修復蛋白靶向到DNA損傷位點(Dulic et al, 2001; Mohammad & Yaffe, 2009; Glover et al, 2004)。BRCT結構域包含約95個氨基酸殘基, 其二級結構主要由3個α-螺旋圍繞4個平行的β-片層組成(β1-α1-β2-β3-α2-β4-α3, α1-和α3-螺旋位于β-片層的一側, α2-螺旋則位于另一側)(Zhang et al, 1998)。在DNA連接酶III和XRCC1(X-ray repair cross complementing protein 1)等蛋白中, BRCT結構域以單體形式存在并發揮功能(Dulic et al, 2001)。在BRCA1 和 MDC1 (mediator of DNA damage checkpoint 1)等蛋白中, BRCT結構域則由序列上相隔20~30個氨基酸殘基的兩個BRCT組成二聯體。根據兩個 BRCT相互作用方式的不同可將其分為 I類和 II類二聯體(Sheng et al, 2011; Rappas et al, 2011):I類二聯體的兩個 BRCT通過 N 端BRCT(BRCTa)的α2-螺旋與C端BRCT(BRCTb)的α1-和α3-螺旋形成三螺旋束的形式結合, 兩個BRCT的β-片層相互平行, 如BRCA1和MDC1中的二聯體(Williams et al, 2001, Glover et al, 2004); II類二聯體的兩個BRCT可能通過BRCTa的α2-螺旋與BRCTb的β-片層底部結合, 兩個BRCT的β-片層相互垂直,如 PTIP (PAX transcription activation domain interacting protein 1)BRCT1-2和BRCT3-4, TopBP1 BRCT4-5 (Rappas et al, 2011; Sheng et al, 2011)。在TopBP1 (topoisomerase (DNA) II binding protein 1)和Ect2 (epithelial cell transforming sequence 2)的N端, BRCT結構域由序列上相隔~20個氨基酸殘基的三個BRCT組成(TopBP1 BRCT0、BRCT1和BRCT2)(三聯體), 相鄰的兩個BRCT也是以β-片層相互垂直的方向相互結合(Rappas et al, 2011; Sheng et al, 2011)。
研究表明, 很多 BRCT結構域均含有由位于β1- C端鄰接的Ser和Gly, α1- N端的Arg和α2- N端的Lys組成的磷酸結合口袋(Williams et al, 2004)。磷酸結合口袋與這些BRCT的功能緊密相關, 例如, RFC1(replication factor C large subunit)中的單體BRCT可以結合DNA末端的磷酸(Kobayashi et al, 2010)。但研究最清楚的是I類二聯體識別特異磷酸化蛋白的機制。磷酸化蛋白識別口袋由 BRCTa的磷酸結合口袋延伸至BRCTa與BRCTb相互作用的三螺旋束區。BRCTa的磷酸結合口袋結合磷酸絲氨酸(磷酸絲氨酸結合區), 而三螺旋束區結合磷酸絲氨酸 C端第一到第三位的殘基(特異性決定區)(Williams et al, 2004)。此外, 磷酸結合口袋還存在于一些參與蛋白內或蛋白間相互作用的單體、II類二聯體和三聯體的BRCT中。由于這三類BRCT與I類二聯體結構上的差異, 而且II類二聯體的磷酸結合口袋位于BRCTb而不是BRCTa, 它們并不含有I類二聯體的決定識別特異性的三螺旋束區。研究表明這三類 BRCT也可以結合含有磷酸基的配體(Yu et al, 2003; Rappas et al, 2011; Masson et al, 1998; Munoz et al, 2007; Kim et al, 2005), 但具體機制不清楚。因此, 本研究對這三類BRCT進行了結構保守性和表面靜電勢分析, 并對其結合磷酸化配體的機制進行了探討。
1 材料與方法
BRCT結構域的結構主要來源于 PDB數據庫(表1)。ECT2 BRCT0-2和PTIP BRCT3-4的同源模建使用 Discovery Studio 2.5; ECT2 BRCT0-2和PTIP BRCT3-4同源模建的模板分別是 TopBP1 BRCT0-2和TopBP1 BRCT1-2(PDB ID: 2xnk)(Sheng et al, 2011)。ECT2 BRCT0-2和PTIP BRCT3-4與模板的序列比對使用“Align Multiple Sequences”模塊;對于每個要模建的對象, 首先使用默認參數產生20個結構, 每個結構進行環區優化產生10個結構, 在產生的200個結構中選取總能量最低的作為模建結果。兩個模建結構用Profile-3D進行結構兼容性評估。XRCC1 BRCT1、PTIP BRCT3-4、ECT2 BRCT0-2和TopBP1 BRCT0-2的同源序列來自NCBI nr數據庫,序列搜索使用 Blastp, 采取默認參數(Altschul et al, 1997)。使用MAFFT方法, 采取genafpair策略(Katoh et al, 2002)分別對XRCC1 BRCT1、PTIP BRCT3-4、ECT2 BRCT0-2和 TopBP1 BRCT0-2的同源序列進行比對。將每個序列比對文件和對應的BRCT結構文件提交到ConSurf網站, 使用最大似然法依次計算 XRCC1 BRCT1、PTIP BRCT3-4、 ECT2 BRCT0-2和 TopBP1 BRCT0-2的結構保守性(Landau et al, 2005)。表面靜電勢計算使用PyMol中的 APBS模塊(Schrodinger, 2010; Baker et al, 2001), 采取默認參數。
2 結 果
本研究主要分析了XRCC1 BRCT1(單體)、PTIP
BRCT3-4(II類二聯體)、ECT2 BRCT0-2和 TopBP1 BRCT0-2(三聯體)的結構保守性和表面靜電勢。PTIP BRCT3-4和ECT2 BRCT0-2的三維結構通過同源模建得到, 模建結構的 Profile-3D打分都位于最小期望值和最大期望值之間(PTIP BRCT3-4打分為62.36, 最小和最大期望值分別為37.94和84.31; ECT2 BRCT0-2打分為96.45, 最小和最大期望值為56.68和 125.96), 說明模建結構是合理的。結構保守性分析顯示, XRCC1 BRCT1、PTIP BRCT4、ECT2 BRCT1、TopBP1 BRCT1和TopBP1 BRCT2中的磷酸結合口袋殘基是保守的(殘基ConSurf打分6~9,表1), 由于前四個BRCT有結合磷酸化配體的報道(Rappas et al, 2011; Masson et al, 1998; Munoz et al, 2007; Kim et al, 2005), 所以我們下一步的分析主要針對前4個BRCT。結果顯示, XRCC1 BRCT1、PTIP BRCT4、ECT2 BRCT1和TopBP1 BRCT1的磷酸結合口袋周圍還存在一些保守的區域(殘基ConSurf打分5~9, 表1)。XRCC1 BRCT1的磷酸結合口袋周圍有兩個保守的區域:一個由 α1-和 β2-組成, 另一個由α1-和α3-組成(圖1A)。PTIP BRCT4和TopBP1 BRCT1的表面保守區組成相似, 都是由 α1-延伸到β2-和β3-之間的環區(圖1B, C)。ECT2 BRCT1的表面保守區由α1-至β2-區域延伸到BRCT0和BRCT1相互作用的區域(圖1D)。這四個BRCT的保守區都在結構域表面形成以磷酸結合口袋為中心的溝槽。此外,這些BRCT表面不存在其它由三個或更多殘基組成的保守區域。因此, 磷酸結合口袋及其周圍的保守區形成的溝槽可能是這些BRCT重要的功能位點。
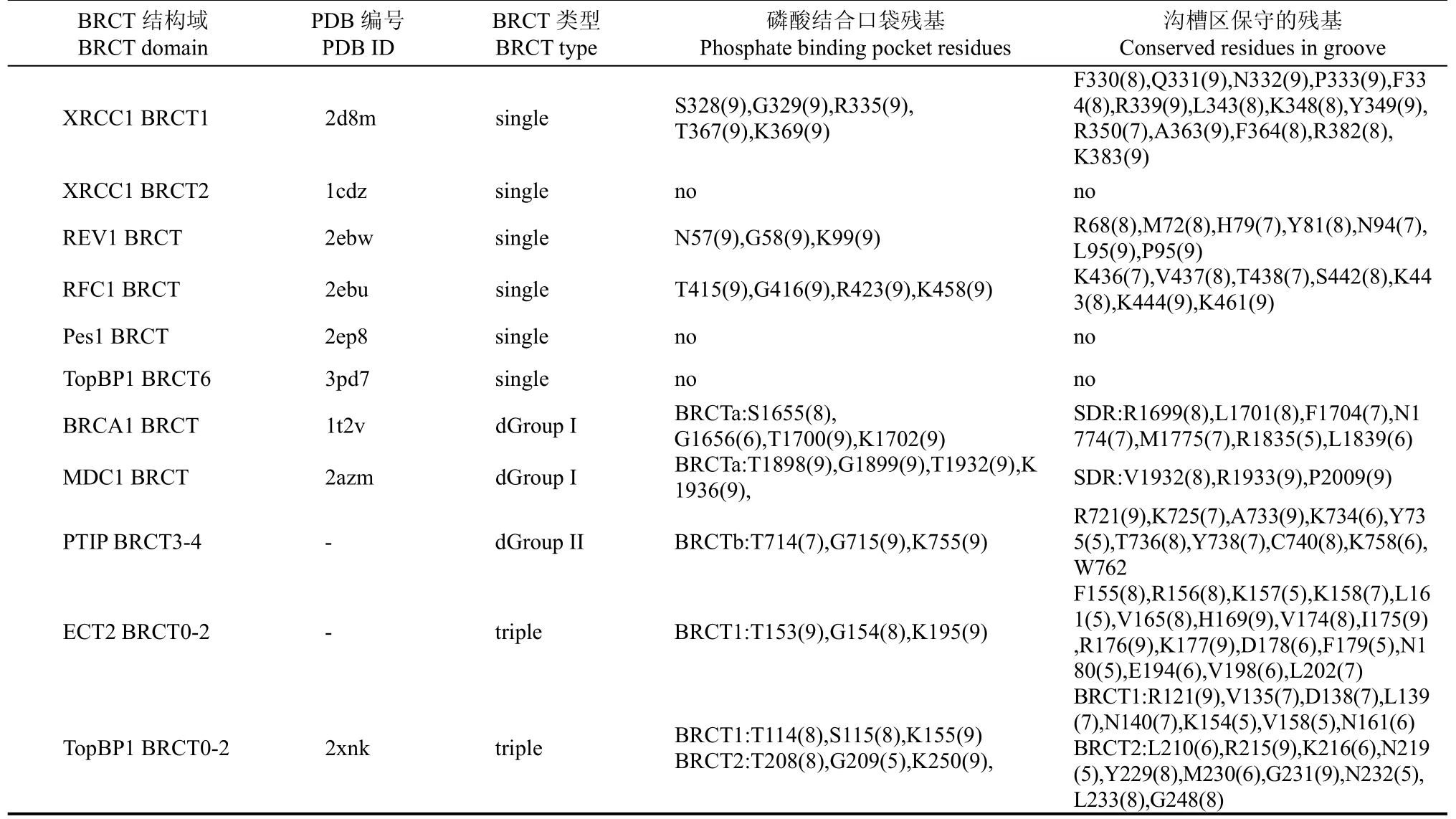
表1 本文使用的BRCT結構域的結構Tab. 1 Structures of BRCT domains
表面靜電勢分析顯示, 這四個BRCT的磷酸結合口袋和保守區都帶有較強的正電勢(圖 1E, H)。溝槽保守性和靜電勢的一致性提示我們, 這種溝槽可能是含有磷酸結合口袋的BRCT結構域的共同特征。為了驗證這一假設, 我們還分析了其它含有磷酸結合口袋的 BRCT。結果顯示, 結構較保守(ConSurf打分5~9的殘基組成)的帶正電勢的溝槽也存在于一些蛋白如REV1(deoxycytidyl transferase)中的單體BRCT(表1), II類二聯體的BRCTb如PTIP BRCT2和TopBP1 BRCT5(未給出具體數據)。I類二聯體的特異性決定區也帶有正電勢并且周圍是中性或帶負電勢區(圖1I), RFC1結合DNA的位點也帶有正電勢(未給出具體數據)。此外, 在一些不含磷酸結合口袋的單體BRCT如XRCC1 BRCT2(圖1J)、Pes1(pescadillo homolog 1) BRCT和TopBP1 BRCT6中, 磷酸結合口袋等同的位置不含或只有由結構上不保守(ConSurf打分 1~4)的少于五個殘基組成的正電勢區域。因此, 磷酸結合口袋周圍帶正電勢的保守的溝槽很可能是BRCT與含有磷酸基團的配體相互作用的位點。

圖1 BRCT結構域的結構保守性和表面靜電勢Fig. 1 The structural conservation and electrostatic surfaces of BRCT domains
我們對XRCC1 BRCT1、 PTIP BRCT4、 ECT2 BRCT1和 TopBP1 BRCT1進行比較后發現, 雖然這四個BRCT磷酸結合口袋周圍的溝槽在形狀上有所差異, 但都包含α1至β2區。四個BRCT的α1至β2區都含有保守的Arg, Lys或His, 但并沒有發現在四個BRCT中均保守的殘基(圖2), 說明電荷在這些BRCT溝槽中的分布是不同的。PTIP BRCT4、ECT2 BRCT1和 TopBP1 BRCT1的溝槽都包含由α2和位于β2和β3之間的環區構成的表面區域, 但三個BRCT在該區域也沒有共同保守的殘基。這種溝槽區電荷分布和殘基差異說明這些BRCT可能結合不同的配體。磷酸結合口袋位于溝槽的中心, 說明溝槽可能能夠同時結合配體磷酸化氨基酸殘基的兩端序列。I類二聯體的特異性決定區由BRCTa延伸至 BRCTb, 與此不同的是, XRCC1 BRCT1、PTIP BRCT4、ECT2 BRCT1和 TopBP1 BRCT1的溝槽主要分布于這四個BRCT內部, 說明識別特異性主要由單個BRCT決定。

圖2 人 XRCC1 BRCT1, PTIP BRCT4, TopBP1 BRCT1和 ECT2 BRCT1的序列比對Fig. 2 Sequence alignment of human XRCC1 BRCT1, PTIP BRCT4, TopBP1 BRCT1, and ECT2 BRCT1
此外, 根據我們構建的四個 BRCT結構模型,我們還分析了溝槽氨基酸殘基在其空間結構中的位置分布情況。結果顯示, 溝槽兩側多為帶正電荷和極性的氨基酸殘基, 而底部多為疏水和極性氨基酸殘基(圖1K)。盡管I類二聯體的特異性決定區也具有類似的殘基分布(Williams et al, 2004), 但以上四個BRCT的溝槽含有三到四個帶正電荷的氨基酸殘基(α1至β2區), 而I類二聯體如BRCA1和MDC1的特異性決定區只含有一到兩個帶正電荷殘基 (人BRCA1:Arg1699和Arg1835)。因而, 溝槽區的更強的正電勢使得這類BRCT結構域更傾向于結合帶負電的配體。
3 討 論
本研究發現XRCC1 BRCT1、PTIP BRCT4、ECT2 BRCT1和 TopBP1 BRCT1的磷酸結合口袋周圍都有結構較保守的帶正電勢的溝槽, 類似的溝槽也存在于其它含有磷酸結合口袋的BRCT結構域中。而且RFC1中的溝槽是其結合DNA末端的區域, I類二聯體中的溝槽是其結合磷酸化蛋白的特異性決定區(Glover et al, 2004; Kobayashi et al, 2010)。這些結果說明, 我們分析的這四個 BRCT的溝槽區可能具有容納配體中磷酸基團附近區域的能力。
這四個BRCT可能采取與I類二聯體相似的配體結合機制。在 I類二聯體中, 磷酸結合口袋殘基與配體磷酸絲氨酸中的磷酸基團形成氫鍵或鹽鍵;特異性識別區兩側的正電殘基與配體中的負電殘水性氨基酸殘基(Williams et al, 2004)。我們所研究的四個BRCT的溝槽區具有與I類二聯體特異性識別區相似的殘基空間排布, 說明這四個BRCT與配體的結合方式可能與I類二聯體與配體的結合方式相似, 而且溝槽區的極性殘基也可能與配體形成氫鍵。其中, 氫鍵和鹽鍵等可能與配體結合親和性有關, 疏水相互作用與配體結合的特異性有關, 但具體結合機制還有待進一步研究。I類二聯體中磷酸結合口袋位于配體結合區的一端, 因而只能結合磷酸絲氨酸C端的序列, 但這四個BRCT的磷酸結合口袋位于溝槽的中部, 說明四個BRCT可能還會結合位于磷酸化殘基N端的殘基。
結合文獻報道, 我們進一步推測了這些 BRCT可能結合的配體以及配體結合機制。XRCC1 BRCT1傾向于結合 PARP1(Poly(ADP-Ribose) Polymerase 1)中被寡聚的二磷酸腺苷-核糖基修飾的區域(Masson et al, 1998), 說明XRCC1 BRCT1可能結合二磷酸腺苷中的磷酸。TopBP1 BRCT1可以結合被CK2(caesin kinase2)磷酸化的RAD9 C端序列(SPVLAED[pS387]EGE)(Rappas et al, 2011)。從序列可以看出, 磷酸絲氨酸pS387兩端都為帶負電荷殘基, 可能與TopBP1 BRCT1溝槽兩側的帶正電荷殘基相互作用。PTIP BRCT3-4 (II類二聯體)和BRCT5-6(I類二聯體)共同結合 53BP1 N端序列(DTPCLIIED [pS25]QPESQVLEDD), 而且BRCT3-4或 BRCT5-6都不能單獨結合該序列(Munoz et al, 2007)。這兩個二聯體中只有 PTIP BRCT4和BRCT5有磷酸結合口袋, PTIP BRCT5-6傾向于結合磷酸絲氨酸 C-端第三位為疏水殘基的肽段如pSQVF (Munoz et al, 2007), 但PTIP結合53BP1磷酸絲氨酸 pS25 C端的第三位為谷氨酸(Glu28), 因而可能不是 BRCT5-6結合磷酸絲氨酸pS25及其附近序列。另外, 53BP1 pS25兩端三個殘基的序列與TopBP1 BRCT1結合的RAD9的序列相同或相似, 而且PTIP BRCT4與TopBP1 BRCT1的溝槽區具有相似的電荷分布(圖 2), 因此很可能是PTIP BRCT4結合 pS25及其附近的序列, 而BRCT5-6結合pS25 N-端或C端較遠的序列。ECT2 BRCT0-2通過與ECT2 C-端的DH(Dbl homology)/ PH(pleckstrin homology)結構域區相互作用而抑制后者催化二磷酸腺苷轉換三磷酸腺苷的功能(Kim et al, 2005), 這一功能可能受到磷酸化作用的調控,但具體的機制以及ECT2 BRCT1在其中的作用還不清楚。此外, 由于磷酸結合口袋附近的溝槽中存在一個較大的環區, 因此我們推測該區域所結合的配體殘基可能會含有較小的側鏈, 這一推測在 TopBP1 BRCT1配體上得到了證實, 其第389位為Gly殘基。
綜上所述, 本文探討了BRCT結構域結合磷酸化配體的另一種可能的機制, 并為進一步研究BRCT結構域的功能機制奠定了基礎。我們的結構模型對探討不同BRCT結合磷酸化配體的特異性和親和性分子機理有一定意義, 同時對 DNA損傷修復中的細胞周期調控機理研究有幫助作用。
Altschul SF, Madden TL, Schaffer AA, Zhang JH, Zhang Z, Miller W, Lipman DJ. 1997. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs [J].Nucleic Acids Res, 25, 3389-3402.
Baker NA, Sept D, Joseph S, Holst, MJ, Mccammon JA. 2001. Electrostatics of nanosystems: application to microtubules and the ribosome [J].Proc Natl Acad Sci U S A, 98, 10037-41.
Bork P, Hofmann K, Bucher P, Neuwald AF, Altschul SF, Koovin EV. 1997. A superfamily of conserved domains in DNA damage-responsive cell cycle checkpoint proteins [J].FASEB J, 11, 68-76.
Dulic A, Bates PA, Zhang X, Martin SR, Freemont PS, Lindahl, T, Barns, DE. 2001. BRCT domain interactions in the heterodimeric DNA repair protein XRCC1-DNA ligase III [J].Biochemistry, 40, 5906-13.
Glover JNM, Wliiams RS, Lee MS. 2004. Interactions between BRCT repeats and phosphoproteins: tangled up in two [J].Trends Biochem Sci, 29, 579-585.
Katoh K, Misawa K, Kuma K, Miyaya T. 2002. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform [J].Nucleic Acids Res, 30, 3059-66.
Kim JE, Billadeau DD, Chen JJ. 2005. The tandem BRCT domains of Ect2 are required for both negative and positive regulation of Ect2 in cytokinesis [J].J Biol Chem, 280, 5733-5739.
Kobayashi M, Eiso AB, Bonvin AMJJ, SIEGAL G. 2010. Structure of the DNA-bound BRCA1 C-terminal Region from Human Replication Factor C p140 and Model of the Protein-DNA Complex [J].J Biol Chem, 285, 10087-10097.
Landau M, Mayrose I, Rosenberg Y, Glaser F, Martz E, Pupko T, Ben-tal N. 2005. ConSurf 2005: the projection of evolutionary conservation scores of residues on protein structures [J].Nucleic Acids Res, 33, W299-W302.
Masson M, Niedergang C, Schreiber V, Muller S, Menissier-de Murcia J, De Murcia G. 1998. XRCC1 is specifically associated with poly(ADP-ribose) polymerase and negatively regulates its activity following DNA damage [J].Mol Cell Biol, 18, 3563-3571.
Mohammad DH, Yaffe MB. 2009. 14-3-3 proteins, FHA domains and BRCT domains in the DNA damage response [J].DNA Repair (Amst),8, 1009-17.
Munoz IM, Jowsey PA, Toth R, Rouse J. 2007. Phospho-epitope binding by the BRCT domains of hPTIP controls multiple aspects of the cellular response to DNA damage [J].Nucleic Acids Res, 35, 5312-22.
Rappas M, Oliver AW, Pearl H. 2011. Structure and function of the Rad9-binding region of the DNA-damage checkpoint adaptor TopBP1 [J].Nucleic Acids Res, 39, 313-24.
SCHRODINGER. LLC. 2010. The PyMOL Molecular Graphics System, Version 1.3r1[DB/OL].
Sheng ZZ, Zhao YQ, Huang JF. 2011. Functional Evolution of BRCT Domains from Binding DNA to Protein [J/OL].Evol Bioinform Online (In Press).
Williams RS, Green R, Glover JNM. 2001. Crystal structure of the BRCT repeat region from the breast cancer-associated protein BRCA1 [J].Nat Struct Biol, 8, 838-842.
Williams RS, Lee MS, Hau DD, Glover JN. 2004. Structural basis of phosphopeptide recognition by the BRCT domain of BRCA1 [J].Nat Struct Mol Biol, 11, 519-25.
Yu XC, Chini CCS, He M, Mer G, Chen JJ. 2003. The BRCT domain is a phospho-protein binding domain [J].Science, 302, 639-642.
Zhang X, Morera S, Bates PA, Whitehead PC, Coffer AI, Hainbucher K, Nash RA, Sternberg MJ, Lindahl T, Freemont PS. 1998. Structure of an XRCC1 BRCT domain: a new protein-protein interaction module [J].EMBO J, 17, 6404-11.
Functional site prediction of BRCT domain containing phosphate binding pocket
SHENG Zi-Zhang1,2, HUANG Jing-Fei1,3,*
(1.State Key Laboratory of Genetic Resources and Evolution,Kunming Institute of Zoology,the Chinese Academy of Sciences,Kunming650223China; 2.Graduate School of the Chinese Academy of Sciences,Beijing100049China; 3.Kunming Institute of Zoology-Chinese University of Hong Kong Joint Research Center for Bio-resources and Human Disease Mechanisms,Kunming 650223,China)
The BRCT domain (after the C-terminal domain of a breast cancer susceptibility protein) is an important signaling and protein targeting motif in the DNA damage response system. To clarify possible interaction mechanisms between the BRCT domain, which contains phosphate binding pocket and its phosphorylated ligand, we analyzed the structural conservation and electrostatic surface potentials of XRCC1 BRCT1, PTIP BRCT4, ECT2 BRCT1 and TopBP1 BRCT1. The results showed common structurally conserved and positively charged grooves located around the phosphate binding pockets of these domains. These grooves possibly act as functional sites in the four BRCT domains due to the extensive existence of similar grooves in the BRCT domains containing phosphate binding pocket. The two sides of the groove were composed of positively charged and hydrophilic residues and the bottom was composed of hydrophobic and hydrophilic residues, suggesting that the groove binds to BRCT domain ligand mainly through electrostatic and hydrophobic interactions. The groove was mainly located in individual BRCT domains and differences in shape and charge distribution among the four BRCT domain grooves were observed, indicating that ligand binding specificity was predominantly determined by individual BRCT domains. The groove was centered by the phosphate binding pocket, implying that the groove interacted with residues located at both the N-terminal and C-terminal sides of the phosphorylated residue.
BRCT domain; Phosphate binding pocket; DNA damage repair; Electrostatic surface potential
Q5-3; Q811.4; TP399; R711.75
A
0254-5853-(2011)05-0509-06
10.3724/SP.J.1141.2011.05509
2011-04-11; 接受日期:2011-07-01
國家重點基礎研究發展計劃項目“973”(2009CB941302); 國家自然科學基金項目(30470939、30623007); 中國科學院基金項目(2007211311091)
?通訊作者(Corresponding author), E-mail: huangjf@mail.kiz.ac.cn
- Zoological Research的其它文章
- 白眉山鷓鴣冬季覓食地選擇
- Association of RELN promoter SNPs with schizophrenia in the Chinese population
- Decreased contrast sensitivity of visual cortical cells to visual stimuli accompanies a reduction of intracortical inhibition in old cats
- Complete mitochondrial genome of the laced fritillary Argyreus hyperbius (Lepidoptera: Nymphalidae)
- Possible genetic reproductive isolation between two tilapiine genera and species: Oreochromis niloticus and Sarotherodonmelanotheron
- A new blind loach species, Triplophysa huanjiangensis (Teleostei: Balitoridae), from Guangxi, China

