基于SPSS空列正交設計的茶黃素動態提制工藝快速優化
孔俊豪 楊秀芳 涂云飛 孫慶磊 陳小強
(中華全國供銷合作總社杭州茶葉研究院,浙江杭州 310016)
基于SPSS空列正交設計的茶黃素動態提制工藝快速優化
孔俊豪 楊秀芳﹡涂云飛 孫慶磊 陳小強
(中華全國供銷合作總社杭州茶葉研究院,浙江杭州 310016)
以茶多酚為原料,采用動態-雙相萃取法制備茶黃素。運用SPSS軟件,以反應時間、多酚氧化酶濃度、水酯兩相比為過程調控因素進行有空白列正交試驗設計,對反應條件進行了優化分析,優化后的反應條件為:酶濃度1600U/g,水酯兩相比1:0.5,反應時長60min,該反應條件下茶黃素的合成均量為846mg,粗品茶黃素組分含量為47%。
空列正交試驗 茶黃素 動態 優化
茶黃素是紅茶加工過程中經兒茶素類氧化聚合形成的具有苯駢卓酚酮結構的高活性二聚體,含量一般在0.5%到2%之間,其含量高低與紅茶品質呈正相關。近年來其確切的生物學活性及藥理作用已被眾多試驗研究所證實[1-3],越來越多地應用于保健食品、添加劑、臨床醫藥、高端日化領域,旺盛的市場需求使得茶黃素的離體轉化技術成為學界研究的熱點之一。
報道的茶黃素制備方法有化學氧化法、固定化酶膜法、雙液相氧化法[4-8],尚未見有分批補料—動態萃取的反應方式用于實驗。本研究根據前期預試驗及模式比較,選取了反應時間、酶濃度、水酯兩相比作為主要因素,以減量處理實現動態輸入的過程控制,通過SPSS空列設計,將復雜問題簡單化,通過少量試驗獲得可信度高的有用信息,從而快速、高效得到優化的反應工藝參數,為規模化制備技術的實際應用提供有效的依據。
1 材料與方法
1.1 材料與試劑
材料:90%茶多酚(兒茶素含量46%,浙江東方茶葉科技有限公司購買);鮮葉(龍井43,杭州翠峰茶葉基地提供)。
試劑:乙酸乙酯,AR,杭州雙林化工試劑廠;檸檬酸,AR,如皋市金陵試劑廠;磷酸氫二鈉,AR,湖州湖試化學試劑有限公司;甲醇,AR,衢州巨化試劑有限公司;聚乙烯聚吡咯烷酮,AR,上海伯奧生物科技有限公司;石英砂,AR,國藥集團化學試劑有限公司;EDTA,AR,天津華特化研科技有限公司;乙腈,HPLC級,天津市康科德科技有限公司;乙酸,AR,湖州湖試化學試劑有限公司。
1.2 儀器與設備
JPR-2雙層玻璃反應釜,杭州歐爾柏維科技有限公司;DHJF-4005低溫恒溫反應槽,杭州惠創儀器設備有限公司;HL-2D數顯恒流泵,上海滬西分析儀器廠;MJ-250BP02A植物組織搗碎機,廣州美的生活電器制造有限公司;3K15低溫冷凍離心機,德國SIGMA公司;MDF-U338低溫冰箱,大連三洋冷鏈有限公司;UV-2102 PC型分光光度計,尤尼柯(上海)儀器有限公司;H.H.S.11-2K電熱恒溫水浴鍋,上海醫療器械五廠。
1.3 試驗方法
1.3.1 PPO酶液提取及活性測定
PPO粗酶液提取:準確稱取茶鮮葉25g于植物搗碎機中,加入pH4.8的檸檬酸-磷酸氫二鈉緩沖液125mL、石英砂10g、聚乙烯聚吡咯烷酮1.5g,勻漿提取粗酶液,過濾,轉速1000r/min離心15min,取上清液,置4℃冰箱備用。
酶活測定方法[9]:取酶上清液1mL,加3mL反應混合液(0.1M檸檬酸-磷酸鹽緩沖液:0.1%脯氨酸:1%鄰苯二酚=2:0.4:0.6),于30℃恒溫水浴反應10min,平行測定三次。酶活性以單位體積酶液每分鐘OD460增加0.001為一活性單位(U)。
1.3.2 茶黃素濃度測定
準確移取茶黃素反應釜中酯相層溶液5mL,0.45μm膜過濾,70%甲醇定容至 50mL,進樣10μg, 以 HPLC 方法(ISO14520-2)進行 組分 檢測[10]。流動相A:分別將90mL乙腈,20mL乙酸,2mLEDTA加入1000mL容量瓶中,用水定容至刻度,搖勻,過0.45μm膜。流動相B:分別將800mL乙腈,20mL乙酸,2mLEDTA加入1000mL容量瓶中,用水定容至刻度,搖勻,過0.45μm膜。色譜條件如下:
流動相流速:1mL/min,柱溫:35℃,紫外檢測器:λ=278nm
梯度條件:100%A相保持10min→15min內由100%A相→68%A相、32%B相保持10min→100%A相
1.3.3 茶黃素動態雙相酶促制備工藝
用pH4.8的檸檬酸-磷酸氫二鈉緩沖液為水相溶劑,配制茶多酚底物溶液,待用。在雙層玻璃反應器內加入乙酸乙酯相,然后將1.3.1中的酶清液加入,通入氧氣(12Mpa,0.5L/min),數顯恒流泵速度40r/min,反應器攪拌轉速 360r/min,進行反應,反應結束收集反應液,低溫冷凍離心機1000r/min離心20min,收集酯相溶液,記錄準確體積,轉相,冷凍干燥可得茶黃素產品。
1.3.3 SPSS空列設計的L9(34)正交實驗
試驗反應體系條件下,考慮酯相體積和酯相濃度組別之間的差異性,以茶黃素生成量(Y)為工藝考查指標,以反應時間(A)、酶濃度(B)、水酯兩相比(C)為考查變量,設置空列誤差項(D),進行四因素三水平L9(34)空列正交試驗設計,結合統計分析和參數顯著性評判,以快速確定動態反應提制茶黃素的最佳工藝參數,試驗因素表如表1所示。
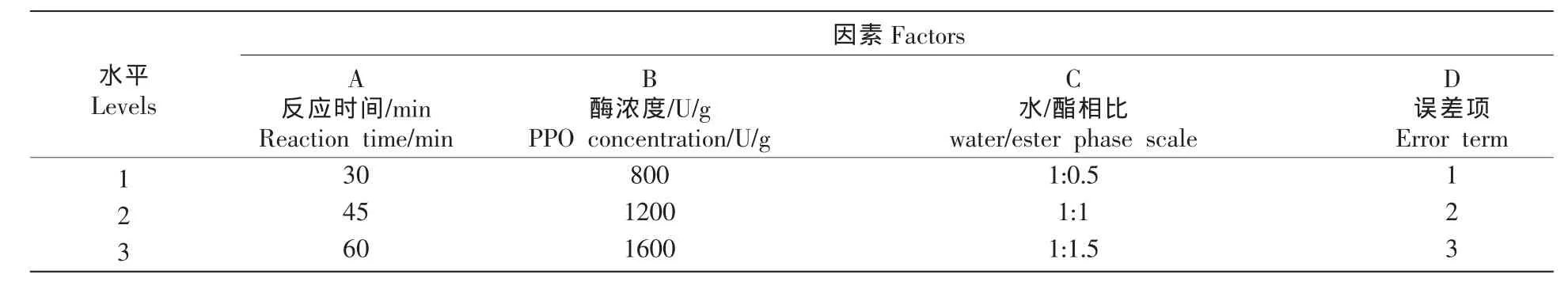
表1 茶黃素提制優化因素水平表Table1 Between-subjects factors for preparation of theaflavins
直接運用SPSS16.0軟件進行有空列正交設計,所有試驗均進行三次重復,試驗結果經計算處理,取均值后輸入SPSS16.0運行分析[11-12]。
2 結果與分析
依據正交試驗組的計算結果,進行極差分析和方差分析。

表2 茶黃素動態提制試驗結果直觀分析Table2 Range analysis of experiment results for preparation of theaflavins
2.1 極差分析
從直觀分析表2中各因素的極差項R可以看出,試驗因素組別范圍內,各因素對產物茶黃素合成量及收率影響程度的順序為:A>B>C,即反應時間是最主要的影響因素,酶濃度和水酯兩相比是影響相對較次要的因素。根據各因素水平對應的平均值k可以推斷,采用方案A3B3C1可獲得較高的產物量。
在正交表的處理過程中,各因素間交互作用的存在可從空白列(誤差項)中反映出來。本試驗條件范圍內,主因素之外的第四列(誤差列)極差最小,因而可以初步判定不存在顯著的交互作用以及未考慮到的其它重要因素。
2.2 方差分析
極差分析的局限性在于不能估計試驗過程及試驗結果測定中必然存在的誤差,因而不能區分某因素各水平間所對應的試驗結果,其差異性的來源。采用SPSS軟件進行單變量方差分析,以期把因素水平的變化所引起的試驗結果間的差異與誤差的波動所引起的試驗結果間的差異區分開,并給出可靠的數量估計。方差分析結果見表3。
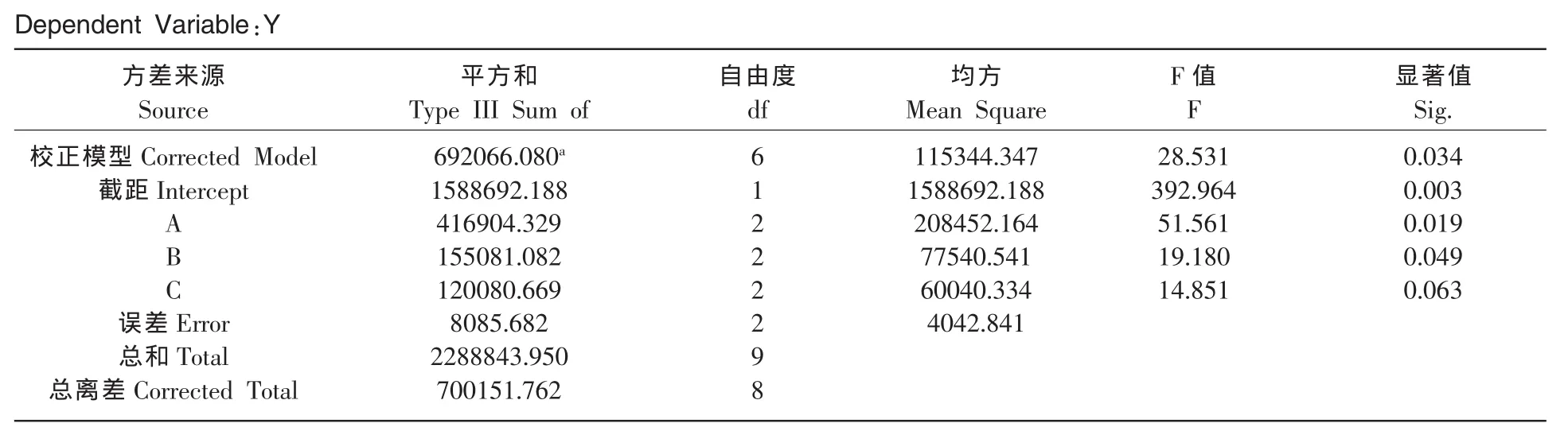
表3 單變量多因素方差分析Table3 Tests of between-subjects effects
方差分析表(表3)對三個因素(不含空列項)作出了方差分析,可以看出,A的顯著值為0.019,B的顯著值為0.049,在α=0.05水平上均具有顯著意義 (P<0.05),而C因素不具有顯著性意義(P=0.063>0.05),由F值的量值比較也可看出。因此試驗反應體系下反應時間和酶濃度同為影響反應的主要因素,反應時間對于茶黃素累積量的顯著性高于酶濃度,水酯兩相對試驗結果的影響較小。
由表4單因素統計量表分析可知,A選水平3、B選水平3,C的顯著值為0.063,無顯著意義(P>0.05),水平 1、2、3 均可,但從節省能源考慮,以1水平為宜。

表4 單因素統計量表Table4 Estimated marginal means
綜上方差分析可知,酶催化合成茶黃素的最佳工藝水平為A3B3C1,與極差分析結果高度吻合。

圖1 酯相層產物的HPLC圖Fig.1 HPLC spectra of product in ethyl acetate phase

圖2 反應產物粗品茶黃素的HPLC圖Fig.2 HPLC spectra of crude theaflavins
2.3 驗證性試驗
為了驗證優選工藝條件的可靠性和重現性,按照動態反應過程控制條件:酶濃度1600U/g,水酯兩相比1:0.5,反應時長60min開展重復試驗進行驗證。收集酯相層溶液 (10倍稀釋樣品HPLC圖譜見圖1),試驗平行3次,取均值,計算轉化后茶黃素的合成量為846mg,證明預測條件下的試驗結果比原先正交試驗組合方案要高,說明工藝條件預測的可靠性較好。經過濾轉相,冷凍干燥得到茶黃素樣品經分析其純度為47%(HPLC圖譜見圖2),優于靜態雙液相酶促氧化法。
3 結論
將動態酶促反應模式引入茶黃素的雙相合成研究,基于產物茶黃素合成量的最大化,采用空列正交試驗設計對試驗的主要因素進行顯著性分析,極差分析和方差分析共同表明,反應時間和酶濃度是影響反應產物合成量的顯著性因子,而水酯兩相比對反應結果的影響相對較小。獲得的最佳工藝條件是:酶濃度1600U/g,水酯兩相比1:0.5,反應時長60min,經驗證結果高于正交試驗組中的產物合量。由此可見,通過SPSS空列正交試驗及正交分析,所得出的優化工藝條件是可靠的,為生產工藝的技術改進提供了試驗技術基礎。
[1]Ya-Lun Su,Jin-Ze Xu,Chi Ho Ng,et al.AntioxidantActivity of Tea Theaflavins and Methylated Catechins in Canola Oil[J].JAOCS,2004,81(3):269-274.
[2]Ya Lun Su,Lai Kwok Leung,Yu Huang,et al.Stability of tea theaflavins and catechins[J].Food Chemistry,2003,83(2):189-195.
[3]Shengmin Sang,Shiying Tian,Jin-woo Jhoo,etal.Chemical studies of the antioxidant mechanism of theaflavins:radical reaction products of theaflavin 3,3’-digallate with hydrogen peroxide[J].Tetrahedron Letters,2003,44(30):5583-5587.
[4]王坤波,劉仲華,黃建安.兒茶素體外氧化制備茶黃素的研究[J].茶葉科學,2004,24(1):53-59.
[5]屠幼英,方青,梁惠玲,等.固定化酶膜催化茶多酚形成茶黃素反應條件優選[J].茶葉科學,2004,24(2):129-134.
[6]丁兆堂,王秀峰,于海寧,等.茶多酚固定化酶體外氧化產物茶黃素組成及其化學發光分析[J].茶葉科學,2005,25(1):49-55.
[7]谷記平,劉仲華,黃建安,等.單雙液相下不同多酚氧化酶源對酶性合成茶黃素的影響[J].茶葉科學,2007,27(1):76-82.
[8]毛清黎,朱旗,劉仲華,等.紅茶發酵中pH調控對多酚氧化酶活性及茶黃素形成的影響[J].湖南農業大學學報(自然科學版),2005,31(5):524-526.
[9]鐘蘿.茶葉品質理化分析[M].上海:上海科學技術出版社,1989:469-470.
[10]周衛龍,徐建峰,許凌.茶葉中茶黃素測定的提取方法探討[J].中國茶葉加工,2007,(3):42-44.
[11]鄧振偉,于萍,陳玲.SPSS軟件在正交試驗設計、結果分析中的應用[J].電腦學習,2009,(5):15-17.
[12]王如德,懷燕,程琮.SPSS13.0在空白列正交試驗設計及其數據處理中的應用[J].中國衛生統計,2007,24(4):426-427.
Fast Optimization of Dynamic Preparation of Theaflavins through Blank Column-Orthogonal Design by SPSS
KONG Jun-hao,YANG Xiu-fang﹡,TU Yun-fei,SUN Qing-lei,CHEN Xiao-qiang
(Hangzhou Tea Research Institute,CHINA COOP,Hangzhou 310016,China)
The preparation technology oftheaflavins with dynamic two-phase system using tea polyphenols as raw material was introduced.The reaction conditions were optimized with blank column orthogonal experiment design by SPSS.The reaction factors such as polyphenol oxidase(PPO)concentration,the ratio of water/ethyl acetate and reaction time were studied.It was indicated that the optimum reaction conditions were as follows.PPO concentration was 1600U/g,the ratio of water/ethyl acetate was 1:0.5,reaction time was for 60min,846 mg of theaflavins were synthesized at the optimum extraction conditions,accordingly,the content of crude product reached 47%.
Blank column-orthogonal,Theaflavins,Dynamic,Optimization
2011-04-26
孔俊豪(1982-),男,河南漯河人,研究實習員,主要從事茶葉生物活性物質的提純及衍生產品開發。
﹡通訊作者:teatesting@sina.com

