正電子發射斷層顯像劑[18F]FET前體藥物的合成
劉春艷, 姜申德, 孟愛國
(1. 天津大學 藥物科學與技術學院,天津 300072;2. 河北聯合大學 a. 藥學系; b. 附屬醫院,河北 唐山 063000)
正電子發射斷層顯像(PET)是近年來迅速發展起來的一種先進的核醫學診斷技術,已廣泛用于臨床上的腫瘤診斷和基礎研究中。氨基酸類PET藥物與目前臨床常規顯像藥物[18F]FDG{2-脫氧-2-[18F]氟-D-葡萄糖}相比較,對腫瘤組織和炎癥部位或其它糖代謝旺盛病灶的特異性高,在腦腫瘤顯像方面具有獨特的優勢,所得圖像清晰,準確率高,更容易診斷[1,2],因此,放射性標記的氨基酸已經逐漸成為臨床上潛在的PET腫瘤顯像劑[3,4]。在氟標記的氨基酸中,O-{2-[18F]氟乙基}-L-氨基酸{[18F]FET}有望成為一種新型PET顯像藥物用于腦部腫瘤的檢測和診斷[5]。
[18F]FET常用的標記方法為親核取代法。Hamacher小組[6,7]和Wang小組[8]分別合成了[18F]FET前體藥物N-(叔丁氧羰基)-O-(2-對甲苯磺酰氧乙基)-L-酪氨酸甲酯(5b)和N-(三苯甲基)-O-(2-對甲苯磺酰氧乙基)-L-酪氨酸叔丁酯;18F與其進行SN2親核氟化反應,隨即水解便可得到[18F]FET。這種方法的優劣主要取決于18F與前體藥物進行親核取代反應的離去基團,離去基團反應活性高有利于提高放化標記率。常用的離去基團有三氟甲磺酰氧基(TfO),甲磺酰氧基(MsO),對甲苯磺酰氧基(TsO),對硝基苯磺酰氧基(NsO),環狀硫酰氧基,溴和碘等。其中,TfO是反應活性最好的,現已用于[18F]FDG放化標記的前體藥物[9]。
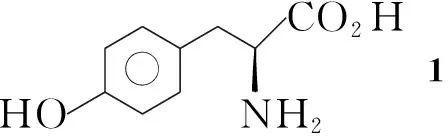


Compa(d)b(e)c(f)RMe(But)Me(But)Me(But)R1SO O - SO O - O2NSO O -
Scheme1
最近,我們報道了以TfO為離去基團,用于[18F]FET放化標記的兩個新型前體藥物的合成[10,11]。本文選擇比TsO反應活性更好的MsO和NsO作為離去基團,采用與文獻[10,11]不同的合成路線,以L-酪氨酸為原料,設計并合成了6個[18F]FET前體藥物(5a~5f, Scheme 1),其結構經1H NMR, IR, MS及元素分析表征。其中5a,5c~5f未見文獻報道。
1 實驗部分
1.1 儀器與試劑
Reichert Thermovar型熔點儀(溫度未校正);Bruker AV 400 MHz型核磁共振儀(CDCl3為溶劑,TMS為內標);Thermo Nicolet Avtar FT 370型傅立葉變換紅外光譜儀(KBr壓片); EI-MS MS-7070型質譜儀;Flash EA-1112型元素分析儀。
2, 3參考文獻[12~14]方法合成;所用試劑均為化學純;溶劑均作無水處理;所有反應在氮氣保護條件下進行。
1.2 合成
(1)N-叔丁氧羰基-O-(2-羥乙基)-L-酪氨酸甲酯(4a)的合成
在反應瓶中依次加入N-叔丁氧羰基-L-酪氨酸甲酯(3a)1.00 g(3.4 mmol), K2CO31.17 g(8.5 mmol), 18-冠-6 0.18 g(0.68 mmol), 四正丁基碘化胺(n-Bu4NI)0.13 g(0.34 mmol)及DMF 25 mL,攪拌使其溶解;滴加氯乙醇0.57 mL(8.5 mmol),滴畢,于125 ℃反應12 h。濃縮后加水30 mL,用二氯甲烷(3×30 mL)萃取,合并萃取液,用無水硫酸鈉干燥,濃縮得油狀液體4a,直接使用。
用類似的方法合成4d。
(2)5的合成(以5a為例)
在反應瓶中加入4a1.00 g(2.95 mmol)和N,N-二甲基-4-氨基吡啶(DMAP)36 mg(0.295 mmol)及吡啶15 mL,攪拌使其溶解;于0 ℃緩慢加入甲磺酰氯(MsOCl)370 mg(3.24 mmol);于室溫反應12 h。濃縮后加水30 mL,用二氯甲烷(3×30 mL)萃取,合并萃取液,用無水硫酸鈉干燥, 濃縮呈油狀物,經硅膠柱層析[洗脫劑:V(石油醚) ∶V(乙酸乙酯)=3 ∶1]純化得N-(叔丁氧羰基)-O-(2-甲磺酰氧乙基)-L-酪氨酸甲酯(5a)。
用類似的方法合成5b, 5c。以4d代替4a,同法合成5d~5f。
5a: 無色晶體,收率82%(以3a計算,下同), m.p.71 ℃~73 ℃(乙酸乙酯/石油醚重結晶,下同);1H NMRδ: 7.02(d,J=8.5 Hz, 2H, ArH), 6.80(d,J=8.6 Hz, 2H, ArH), 4.97(d,J=8.1 Hz, 1H, NH), 4.53(dd,J=3.5 Hz, 5.3 Hz, 2H, OCH2), 4.49(m, 1H, CH), 4.18(dd,J=3.5 Hz, 5.3 Hz, 2H, OCH2), 3.69(s, 3H, OCH3), 3.09(s, 3H, CH3), 3.02(m, 2H, CH2), 1.40(s, 9H, CH3in Boc); IRν: 3 380, 2 983, 2 938, 1 733, 1 694, 1 586, 1 511, 1 456, 1 355, 1 246, 1 176 cm-1; MS-EIm/z: 440.2(M++Na); Anal.calcd for C18H27NO8S: C 51.79, H 6.52, N 3.36; found C 52.02, H 6.31, N 3.43。
5b: 乳白色固體,收率80%, m.p.68 ℃~70 ℃;1H NMRδ: 7.82(d,J=8.3 Hz, 2H, ArH), 7.73(d,J=8.3 Hz, 2H, ArH), 7.04(d,J=8.5 Hz, 2H, ArH), 6.87(d,J=8.6 Hz, 2H, ArH), 4.95(d,J=6.7 Hz, 1H, NH), 4.52(m, 1H, CH), 4.35(dd,J=4.0 Hz, 5.5 Hz, 2H, OCH2), 4.11(dd,J=4.1 Hz, 5.4 Hz, 2H, OCH2), 3.71(s, 3H, OCH3), 2.93(m, 2H, CH2), 2.46(s, 3H, CH3), 1.41(s, 9H, CH3in Boc); IRν: 3 385, 2 980, 2 954, 2 927, 1 743, 1 688, 1 597, 1 512, 1 453, 1 362, 1 250, 1 178 cm-1; MS-EIm/z: 516.2(M++Na); Anal.calcd for C24H31NO8S: C 58.40, H 6.33, N 2.84; found C 58.26, H 6.48, N 2.77。
5c: 無色固體,收率76%, m.p.112 ℃~113 ℃;1H NMRδ: 8.37(d,J=8.9 Hz, 2H, ArH), 8.13(d,J=8.9 Hz, 2H, ArH), 6.99(d,J=8.5 Hz, 2H, ArH), 6.65(d,J=8.6 Hz, 2H, ArH), 4.95(d,J=8.7 Hz, 1H, NH), 4.54(m, 1H, CH), 4.50(dd,J=2.5 Hz, 3.8 Hz, 2H, OCH2), 4.15(dd,J=3.7 Hz, 5.3 Hz, 2H, OCH2), 3.71(s, 3H, OCH3), 3.02(m, 2H, CH2), 1.42(s, 9H, CH3in Boc); IRν: 3 377, 2 985, 2 939, 1 744, 1 683, 1 611, 1 536, 1 511, 1 453, 1 368, 1 349, 1 248, 1 123 cm-1; MS-EIm/z: 547.2(M++Na); Anal.calcd for C23H28N2O10S: C 52.66, H 5.38, N 5.34; found C 52.83, H 5.29, N 5.42。
5d: 無色固體,收率81%, m.p.64 ℃~65 ℃;1H NMRδ: 7.08(d,J=7.8 Hz, 2H, ArH), 6.84(d,J=7.8 Hz, 2H, ArH), 4.99(d,J=8.3 Hz, 1H, NH), 4.56(dd,J=4.2 Hz, 6.3 Hz, 2H, OCH2), 4.40(m, 1H, CH), 4.22(dd,J=4.2 Hz, 6.3 Hz, 2H, OCH2), 3.09(s,3H, CH3), 2.98(m, 2H, CH2), 1.40(s, 18H, CH3in Boc); IRν: 3 400, 2 980, 2 934, 1 731, 1 691, 1 615, 1 512, 1 459, 1 354, 1 251, 1 172 cm-1; MS-EIm/z: 482.1(M++Na); Anal.calcd for C21H33NO8S: C 54.88, H 7.24, N 3.05; found C 54.64, H 7.35, N 3.12。
5e: 乳白色油狀物,收率83%;1H NMRδ: 7.82(d,J=8.2 Hz, 2H, ArH), 7.36(d,J=8.2 Hz, 2H, ArH), 7.04(d,J=8.6 Hz, 2H, ArH), 6.71(d,J=8.6 Hz, 2H, ArH), 4.96(d,J=6.7 Hz, 1H, NH), 4.39(m, 1H, CH), 4.40(dd,J=4.0 Hz, 5.5 Hz, 2H, OCH2), 4.12(dd,J=4.1 Hz, 5.4 Hz, 2H, OCH2), 2.98(m, 2H, CH2), 2.46(s, 3H, CH3), 1.41(s, 18H, CH3in Boc); IRν: 3 400, 3 007, 2 982, 2 934, 1 731, 1 691, 1 588, 1 509, 1 464, 1 354, 1 252, 1 172 cm-1; MS-EIm/z: 558.3(M++Na); Anal.calcd for C27H37NO8S: C 60.54, H 6.96, N 2.61; found C 60.28, H 7.08, N 2.55。
5f: 無色固體,收率78%, m.p.97 ℃~99 ℃;1H NMRδ: 8.37(d,J=9.0 Hz, 2H, ArH), 8.12(d,J=9.0 Hz, 2H, ArH), 7.04(d,J=8.6 Hz, 2H, ArH), 6.65(d,J=8.6 Hz, 2H, ArH), 4.95(d,J=7.7 Hz, 1H, NH), 4.50(dd,J=5.2 Hz, 3.8 Hz, 2H, OCH2), 4.38(m, 1H, CH), 4.15(dd,J=5.2 Hz, 3.8 Hz, 2H, OCH2), 2.97(m, 2H, CH2), 1.42(s, 18H, CH3in Boc); IRν: 3 399, 2 978, 2 932, 1 736, 1 695, 1 611, 1 537, 1 510, 1 453, 1 366, 1 347, 1 247, 1 181 cm-1; MS-EIm/z: 589.2(M++Na); Anal.calcd for C26H34N2O10S: C 55.11, H 6.05, N 4.94; found C 55.03, H 6.18, N 4.87。
2 結果與討論
我們按文獻[6~8]方法合成5a~5f時,收率較低。為此,設計了Scheme 1的路線合成5a~5f,收率較高。
以L-酪氨酸為原料,在甲醇中緩慢滴加氯化亞砜,即時產生氯化氫催化酯化反應形成甲酯(2a)[12]或在酸催化下與乙酸叔丁酯進行酯交換反應形成叔丁酯(3d)[13]。 2懸浮在含有三乙胺的二氯甲烷中,滴加Boc2O,形成氨基被保護的N-叔丁氧羰基-L-酪氨酸甲酯(3a)或叔丁酯(3d)[14],兩步反應的收率分別是81.5%和38.7%。3d收率低是因為第一步酯交換的收率低(2d, 45%)。
在3的酚羥基上引入羥乙基形成關鍵中間體4。選擇氯代乙醇作為羥乙基的來源,3作為親核試劑,進行SN2親核取代反應。3只有在堿性環境下形成負離子才能發揮親核試劑的作用,我們選擇碳酸鉀為反應體系提供堿性環境[15],加入相轉移催化劑18-冠-6增強其在有機溶劑中的堿性,有利于反應進行。氯代乙醇中的氯作為離去基團,其反應活性不強,加入催化劑n-Bu4NI,使反應易于完成。反應在125 ℃,DMF中經12 h完成,經硅膠柱色譜純化后得晶體4,但收率較低[4a(41%),4d(42%)]。經觀察色譜行為,推測4可能在硅膠柱上分解了。實驗嘗試不經硅膠柱層析直接結晶,但失敗了;最后通過快速硅膠短柱除去雜質后結晶的方法,收率較高(68%或71%)。
在吡啶溶液中,以DMAP為催化劑,4a和4d分別與甲磺酰氯(MsOCl),對甲苯磺酰氯(TsOCl),對硝基苯磺酰氯(NsOCl)反應得到5a~5f,收率92%~95%。
實驗嘗試4的粗品不過柱直接進行下步反應,發現5的收率較高,這進一步說明了4在硅膠柱色譜中分解,可能這類結構的化合物在硅膠柱上不穩定,有待進一步證實。
3 結論
以L-酪氨酸為原料,設計并合成了6個正電子發射斷層顯像劑[18F]FET前體藥物。5a~5c的總收率62%~68%(以3計算),5d~5f的總收率比較低(30%~35%),相關的反應正在改善。目前,這6個化合物的標記和臨床研究工作正在進行中。
[1] Couturier O, Luxen A, Chatal J F,etal. Fluorinated tracers for imaging cancer with positron emission tomography[J].Eur J Nucl Med Mol Imaging,2004,31(8):1182-1206.
[2] Laverman P, Boerman O C, Corstens F H,etal. Fluorinated amino acids for tumour imaging with positron emission tomography[J].Eur J Nucl Med Mol Imaging,2002,29(5):681-690.
[3] Fedorova O S, Kuznetsova O F, Shatik S V,etal.18F-labeled tyrosine derivatives:Synthesis and experimental studies on accumulation in tumors and abscesses[J].Bioorg Khim,2009,35(3):334-343.
[4] Iwata R. Development of molecular imaging probes in oncology[J].Gan To Kagaku Ryoho,2008,35(8):1286-1290.
[5] Rickhey M, Koelbl O, Eilles C,etal. A biologically adapted dose-escalation approach,demonstrated for18F-FET-PET in brain tumor[J].Strahlenther Onkol,2008,184(10):536-542.
[6] Hamacher K, Coenen H H. Convenient synthesis of N.C.A.O-{2-[18F]fluoroethyl}-L-tyrosine[J].J Label Compd Radiopharm[J].2001,44:S855-S858.
[7] Hamacher K, Coenen H H. Efficient routine production of the18F-labelled amino acidO-{2-[18F]fluoroethyl}-L-tyrosine[J].Appl Radiat Isot[J].2002,57(6):853-856.
[8] Wang H E, Wu S Y, Chang C W,etal. Evaluation of F-18-labeled amino acid derivatives and [18F]FDG as PET probes in a brain tumor-bearing animal model[J].J Nucl Med Biol[J].2005,32(4):367-375.
[9] Luo L, Tang G, Tang X. Automated synthesis of 2-[18F]-fluoro-2-deoxy-D-glucose by on-column hydrolysis[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2009,34(11):1151-1156.
[10] Liu C Y, Jiang S D. Preparation of two triflate precursors forO-{2-[18F] fluoroethyl}-L-tyrosine used in positron emission tomography(PET)[J].Sci China Ser B-Chem[J].2009,52(12):2195-2199.
[11] 劉春艷,姜申德. 正電子發射斷層顯像劑[18F]FET前體N-叔丁氧羰基-O-(2-三氟甲磺酰氧乙基)-L-酪氨酸甲酯/叔丁酯的合成[J].中國科學B:化學,2010,40(2):189-194.
[12] Aime S, Gianolio E, Corpillo D. Designing novel contrast agents for magnetic resonance imaging.Synthesis and relaxometric characterization of three gadolinium(Ⅲ) complexes based on functionalized pyridine-containing macrocyclic ligands[J].Helv Chim Acta,2003,86(3):615-632.
[13] Taschner Von E, Chimiak A, Bator B,etal. Neue veresterungsmethoden in der peptidehemie ⅧD dar stellung von tert-butylestern freier aminosauren[J].Liebig Ann Chem[J].1961,646(1):134-136.
[14] Kolodziejcyk A M, Manning M. A convenient method forO-alkylation ofN-substituted tyrosines using a crown ether[J].J Org Chem,1981,46(9):1944-1946.
[15] Bender J L, Shen Q D, Fraser C L. Poly(ε-caprolactone) macroligands withβ-diketonate binding sites:Synthesis and coordination chemistry[J].Tetrahedron,2004,60(34):7277-7285.

